En el tratamiento del cáncer de pulmón de células no pequeñas se ha conseguido mucho en poco tiempo. Seguir la pista a tantas innovaciones rápidas puede ser bastante difícil, pero merece la pena. Porque los pacientes ya pueden beneficiarse enormemente de los nuevos enfoques terapéuticos.
Clásicamente, existían directrices claras para la terapia del cáncer de pulmón de células no pequeñas en función del estadio TNM. En la actualidad, el desarrollo de nuevas terapias dirigidas a , como los inhibidores de la tirosina quinasa de tercera generación o los inmunoterapéuticos, las ponen cada vez más en tela de juicio. Un ejemplo de ello es la nueva recomendación de realizar una terapia de mantenimiento con un inhibidor de puntos de control durante un año tras la radioquimioterapia en caso de expresión de PD-L1 en el estadio III [1].
Novedades en terapia neoadyuvante
No sólo existen nuevos enfoques de tratamiento para la terapia de mantenimiento en el estadio III, sino que también hay nuevas y emocionantes opciones en preparación para la terapia neoadyuvante. Por ejemplo, recientemente se ha descubierto que tras sólo dos dosis neoadyuvantes de un inhibidor de PD-L1, muchos pacientes muestran una proporción significativa de células tumorales muertas en el resecado, aunque radiológicamente no sea necesariamente detectable una respuesta [2]. Dado que el riesgo de recidiva aumenta significativamente con la proporción de células tumorales vivas en el tejido extirpado [3], este hallazgo es de gran relevancia para la terapia y demuestra que el bloqueo de los puntos de control podría ser al menos una alternativa válida a la quimioterapia también en la terapia neoadyuvante. Actualmente se están probando varios fármacos para este campo de aplicación con resultados prometedores hasta el momento. Incluso en el estadio IIIA, se pudieron demostrar los efectos positivos de la inmunoterapia perioperatoria además de la quimioterapia neoadyuvante [4].
Diagnóstico molecular
Teniendo en cuenta el beneficio potencial de la inmunoterapia o de los inhibidores de la tirosina quinasa incluso en estadios tempranos del tumor, las directrices actuales para el diagnóstico molecular parecen bastante prudentes. El análisis de la expresión de PD-L1 se recomienda en los estadios III y IV, el análisis de las mutaciones comunes para las que existen terapias dirigidas aprobadas, sólo en el estadio IV. (Tab. 1). Sin duda, este concepto debe cuestionarse en la situación actual de los datos, en la que, por ejemplo, el uso de inhibidores de la tirosina cinasa como el osimertinib como terapia adyuvante para tumores mutados por EGFR de estadios inferiores suscita esperanzas justificadas [5, 6].
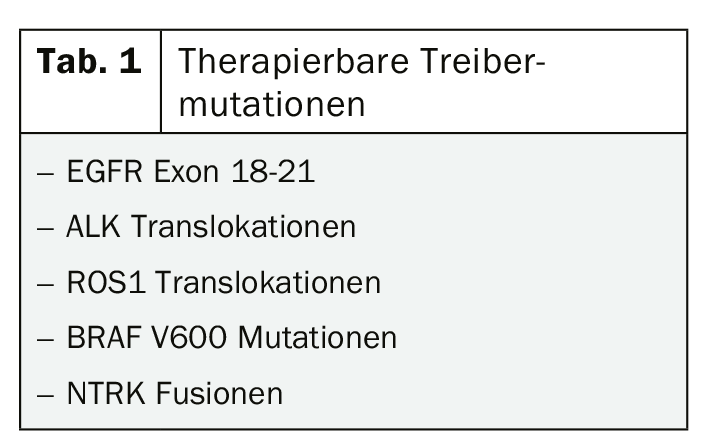
Aunque las nuevas opciones para el tratamiento del CPNM mutante en particular están provocando cierta euforia y las pruebas moleculares probablemente se ampliarán en un futuro próximo, es importante tener en cuenta que el 80% de los CPNM no tienen una mutación impulsora tratable. Sin embargo, para aquellos pacientes en los que puede detectarse una mutación direccionable, la terapia dirigida es la mejor opción, al menos en el estadio IV. En consecuencia, en los últimos meses se ha avanzado mucho en este ámbito con las nuevas aprobaciones de los inhibidores de ALK brigatinib y lorlatinib, entre otros.
¿Qué hacer si no hay mutación conductora?
En el caso más común de que no pueda detectarse ninguna mutación impulsora en el CPNM en estadio IV, lamentablemente existen menos opciones terapéuticas. Sin embargo, también se utilizan cada vez más inmunoterapéuticos para estos tumores. En el caso de una expresión de PD-L1 superior al 50%, se han utilizado principalmente inhibidores del punto de control, que son claramente superiores a la quimioterapia en este grupo de pacientes. Independientemente de la expresión de PD-L1, la combinación de inmunoterapia y quimioterapia también demostró ser más eficaz que la quimioterapia sola [7].
Recientemente, también han surgido conceptos adicionales para el tratamiento del CPNM avanzado sin una mutación conductora tratable, como la combinación de dos inmunoterapias independientes del nivel de expresión de PD-L1 [8]. Este enfoque parece ser claramente superior a la quimioterapia sola, pero aún no se ha comparado con la combinación de inmunoterapia y quimioterapia. De los datos disponibles hasta la fecha se desprende que la expresión de PD-L1 no es un requisito obligatorio para la respuesta a la inmunoterapia, en particular a la inmunoterapia intensificada con diferentes clases de fármacos.
Además de otras combinaciones terapéuticas, recientemente se han dado a conocer nuevas dianas. Entre ellos se incluye el TIGIT (inmunorreceptor de células T con inmunoglobulina y dominio ITIM), que a menudo se expresa junto con el PD-L1. Un estudio que combinó un inhibidor correspondiente con el bloqueo de PD-L1 ofreció los primeros resultados prometedores [9].
La tapa adecuada para la olla adecuada
La selección correcta y más eficaz de los pacientes para la multitud de terapias disponibles sigue siendo un escollo. Las terapias cada vez más específicas y los grupos diana más reducidos contribuyen a la importancia de los marcadores predictivos y los diagnósticos genéticos moleculares fiables. Aunque la tubería está burbujeando, todavía faltan datos a largo plazo para muchas de las nuevas sustancias y combinaciones. Así que a cada paso surgen nuevas preguntas, obstáculos, pero también muchas más posibilidades. En resumen, sólo hay una cosa que ayuda: ¡permanezca atento!
Fuente: Foro de Formación Médica Continua (FOMF), Actualización, Inmunoncología y terapias dirigidas – Presentación sobre “Cáncer de pulmón de células no pequeñas”, Livestream 20.06.2020, PD Dr. Niels Reinmuth, Médico Jefe de Oncología de la Clínica Asklepios
en Munich-Gauting (D).
Literatura:
- Antonia SJ, Villegas A, Daniel D, et al: Durvalumab tras quimiorradioterapia en cáncer de pulmón no microcítico en estadio III. New England Journal of Medicine. 2017;377(20): 1919-1929.
- Forde PM, Chaft JE, Smith KN, et al: Bloqueo neoadyuvante de PD-1 en cáncer de pulmón resecable. N Engl J Med. 2018;378(21): 1976-1986.
- Hellmann MD, Chaft JE, William WN, Jr, et al: Respuesta patológica tras quimioterapia neoadyuvante en cánceres de pulmón no microcíticos resecables: propuesta para el uso de la respuesta patológica mayor como criterio de valoración sustitutivo. Lancet Oncol. 2014;15(1): e42-50.
- Rothschild S, Zippelius A, Savic S, et al.: SAKK 16/14: Anti-PD-L1 antibody durvalumab (MEDI4736) in addition to neoadjuvant chemotherapy in patients with stage IIIA(N2) non-small cell lung cancer (NSCLC)-A multicenter single-arm phase II trial. Revista de Oncología Clínica. 2016;34(15_suppl): TPS8573-TPS.
- Zhong WZ, Wang Q, Mao WM, et al: Gefitinib frente a vinorelbina más cisplatino como tratamiento adyuvante para el CPNM con mutación del EGFR en estadio II-IIIA (N1-N2) (ADJUVANT/CTONG1104): un estudio aleatorizado, abierto, de fase 3. Lancet Oncol. 2018;19(1): 139-148.
- Wu YL, Herbst RS, Mann H, et al: ADAURA: Estudio de fase III, doble ciego y aleatorizado de osimertinib frente a placebo en CPNM en estadio temprano con mutación EGFR positiva tras resección quirúrgica completa. Clin Lung Cancer. 2018;19(4): e533-e536.
- Jotte RM, editor IMpower131: Primary PFS and safety analysis of a randomized phase III study of atezolizumab + carboplatin + paclitaxel or nab-paclitaxel vs carboplatin + nab-paclitaxel as 1L therapy in advanced squamous NSCLC2018; ASCO Annual Meeting: American Society of Clinical Oncology.
- Hellmann MD, Paz-Ares L, Bernabé Caro R, et al: Nivolumab más ipilimumab en cáncer de pulmón no microcítico avanzado. New England Journal of Medicine. 2019;381(21): 2020-2031.
- Rodriguez-Abreu D, Johnson ML, Hussein MA, et al: Primary analysis of a randomized, double-blind, phase II study of the anti-TIGIT antibody tiragolumab (tira) plus atezolizumab (atezo) versus placebo plus atezo as first-line (1L) treatment in patients with PD-L1-selected NSCLC (CITYSCAPE). Revista de Oncología Clínica. 2020;38(15_suppl): 9503.
InFo ONCOLOGY & HEMATOLOGY 2020; 8(4): 30-31 (publicado el 20.9.20, antes de impresión).
InFo NEUMOLOGÍA Y ALERGOLOGÍA 2020, 2(3): 34-35