Le cancer du sein est aussi hétérogène que les patientes concernées. Les prévisions varient en conséquence. Plusieurs analyses ont maintenant examiné l’impact des maladies auto-immunes ou du statut socio-économique, par exemple, sur la survie globale. En outre, la survie sans progression et le délai avant la prochaine ligne de traitement ont été étudiés dans des conditions réelles.
Les patientes atteintes de maladies auto-immunes – notamment le lupus érythémateux disséminé (LED), la polyarthrite rhumatoïde (PR) et le syndrome de Sjogren – ont moins de risques de développer un cancer du sein que les patientes sans antécédents de maladie auto-immune. Par conséquent, peu d’attention a été accordée à cette clientèle et on sait peu de choses sur la survie des patientes souffrant à la fois d’une maladie auto-immune et d’un cancer du sein. Une analyse rétrospective a donc comparé les résultats chez les patientes atteintes d’un cancer du sein avec ou sans maladie auto-immune [1]. Les données sont basées sur les bases de données SEER-Medicare de 2007 à 2014 concernant le cancer du sein. Les patientes ayant des antécédents de maladie auto-immune ont été identifiées à l’aide des codes CIM-9. L’impact de la maladie auto-immune sur la survie globale (OS) et la survie spécifique au cancer (CSS) a été estimé à l’aide de la régression multivariable de Cox ou de la méthode de Gray, en contrôlant les effets de l’âge, de la race et de la maladie rénale chronique (MRC). Le CSS cumulatif a été estimé en considérant le décès comme un risque concurrent.
La prévalence totale des maladies auto-immunes étudiées parmi les 137 324 patientes atteintes d’un cancer du sein était de 26,69%. Les maladies auto-immunes les plus fréquemment identifiées étaient la PR (23,35%), le psoriasis (2,41%) et le LED (1,12%). Chez les patientes atteintes d’un cancer du sein de stade IV, l’OS et le CSS étaient significativement plus élevés chez les patientes atteintes de maladies auto-immunes (valeurs de p <0,0001), avec une OS médiane de 36 mois contre 30 mois chez les patientes sans maladies auto-immunes. Après ajustement pour les effets de l’âge, de la race et de l’IRC, la maladie auto-immune restait prédictive d’une OS plus élevée (HR : 1,46, IC à 95% : 1,37-1,57, p<0,0001) et d’une CSS (HR : 1,39, IC à 95% : 1,29-1,5, p<0,0001). Les patientes atteintes d’une maladie auto-immune et d’un cancer du sein de stade I-III avaient un OS plus faible (p<0,0001, p<0,0001 et p=0,026, respectivement) par rapport aux patientes sans maladie auto-immune.
Les chercheurs ont constaté une prévalence plus élevée de la PR, de la maladie de Crohn, de la colite ulcéreuse et du LED chez les patientes atteintes d’un cancer du sein par rapport à des cohortes d’âge similaire dans la population générale. Des antécédents de maladie auto-immune ont entraîné une amélioration significative de l’OS et du CSS chez les patientes atteintes d’un cancer du sein de stade IV, même en tenant compte de l’âge, de la race et de l’IRC dans cette cohorte pré-immunothérapie. Ces résultats suggèrent que l’immunité anti-tumorale joue un rôle important dans le cancer du sein au stade tardif et pourrait éventuellement être utilisée pour améliorer l’efficacité de l’immunothérapie. Des recherches supplémentaires sur le lien entre l’auto-immunité et le cancer du sein sont justifiées.
Dis-moi d’où tu viens
Le statut socio-économique (SES) et l’appartenance ethnique sont des déterminants importants des résultats en matière de santé – en particulier aux États-Unis. Par conséquent, l’impact du SES, mesuré par le Neighborhood Deprivation Index (NDI), et de la race sur les résultats du traitement des patientes atteintes d’un cancer du sein métastasé a été examiné de plus près [2]. Pour ce faire, les scores NDI de 1246 patientes atteintes d’un cancer du sein métastasé entre 2000 et 2017 ont été déterminés à partir du Neighborhood Atlas en fonction de leur code postal. Les groupes SES ont été définis comme ayant une faible privation avec un score NDI dans le tertile inférieur et une privation élevée avec un score NDI dans le tertile supérieur ou moyen. Les caractéristiques de départ ont été comparées entre les groupes SES après la correction de Bonferroni. Des analyses de survie univariées et multivariées ont été effectuées avec les paquets R “survival” et “survminer”. Il s’est avéré que la race était la seule caractéristique de départ qui différait significativement entre les groupes SES. Le pourcentage d’Afro-Américains était plus élevé dans le groupe à forte privation (10,5%) que dans le groupe à faible privation (3,7%). Dans l’analyse de survie univariée de Kaplan-Meier, le statut social et la race avaient tous deux une influence significative sur la survie globale, de sorte que le groupe à forte privation avait une moins bonne survie que le groupe à faible privation et que les Afro-Américains avaient une moins bonne survie que les Caucasiens. Dans le modèle multivarié de risque proportionnel de Cox, le statut social, mais pas la race, avait une influence significative sur la survie globale. La survie sans progression après une chimiothérapie de première ligne ne différait pas entre les groupes SES ou les groupes raciaux, que ce soit en analyse univariée ou multivariée.
L’étude actuelle montre que les patientes du groupe à forte déprivation (c’est-à-dire à faible SES) ont une moins bonne survie en cas de cancer du sein métastasé. La race n’était plus un prédicteur significatif de la survie lorsque le SES était pris en compte dans l’analyse. Cela suggère peut-être que les moins bonnes chances de survie dans la population afro-américaine s’expliquent par le lien entre un SES faible et la race afro-américaine, selon les experts.
Focalisation sur les points finaux du monde réel
La survie sans progression en vie réelle (rwPFS) et le temps jusqu’à la prochaine ligne de traitement (TTNT) sont deux critères d’intérêt clinique chez les patientes atteintes d’un cancer du sein métastatique (MBC). Cependant, leur validation en tant que critères intermédiaires de survie globale (SG) dans un cadre réel n’a pas encore été totalement établie. Une étude de cohorte rétrospective a donc été menée en utilisant la base de données nationale dé-identifiée Flatiron Health des États-Unis, dérivée des dossiers médicaux électroniques [3]. La population de l’étude comprenait des patientes chez qui un diagnostic de MBC avait été posé entre le 1er janvier 2011 et le 30 février 2021. La rwPFS a été définie comme le temps écoulé entre le début du traitement systémique de première ligne du MBC et la progression de la maladie ou le décès. Le TTNT était défini comme le temps écoulé entre le début du traitement systémique de première ligne et le début de la ligne de traitement suivante.
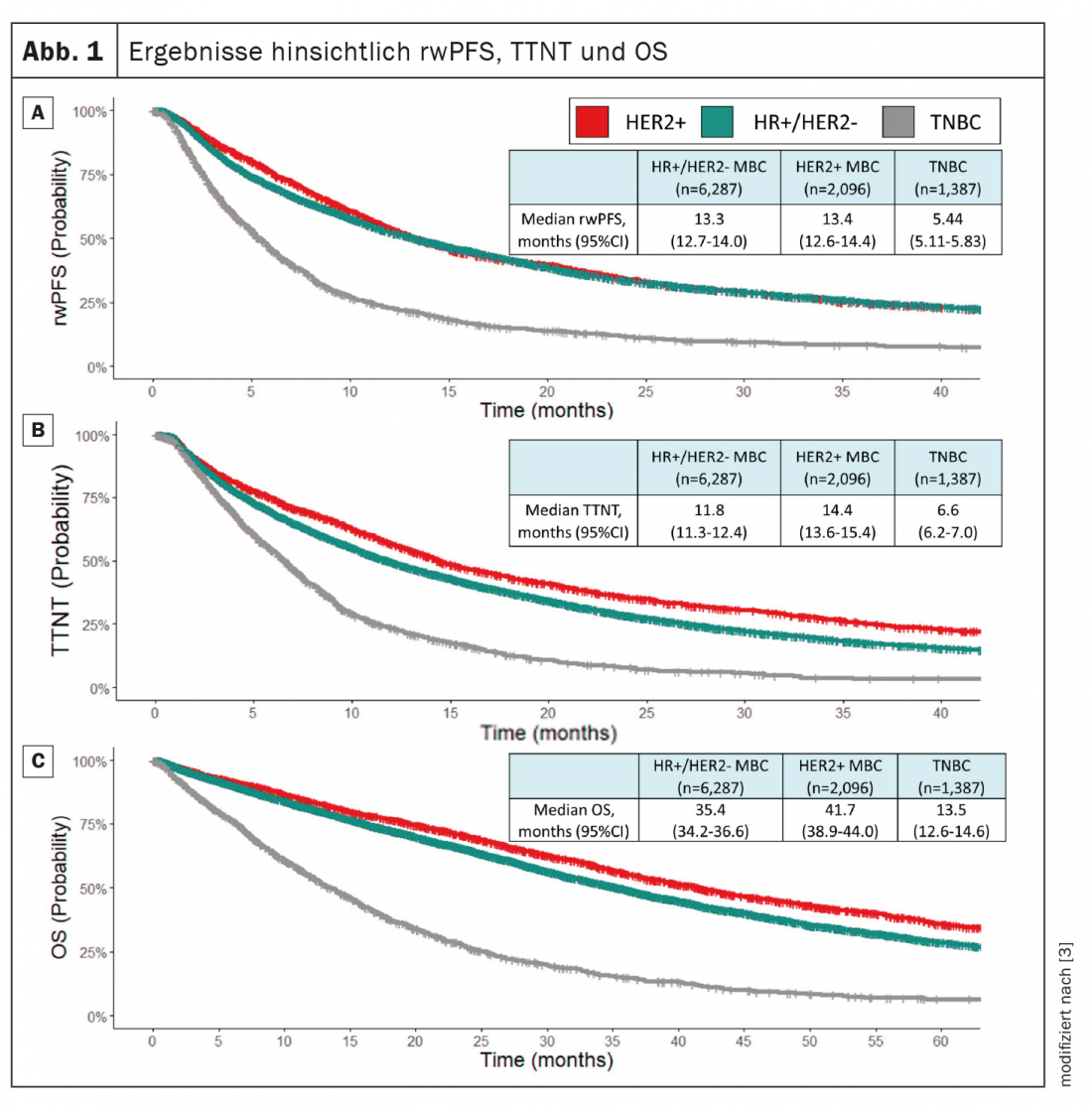
Au total, 9770 patients atteints de MBC ont été inclus. La maladie HR+/HER2 était le sous-type de MBC le plus fréquent (64,4%), suivi de la maladie HER2+ (21,5%) et de la maladie triple-négative (14,2%). L’OS médian dans la population totale était de 32,4 mois. La rwPFS médiane était de 11,5 mois et le TTNT médian de 11,1 mois. Dans l’ensemble de la population, la corrélation entre rwPFS et OS était de 0,54 (IC à 95% : 0,53-0,56), tandis que la corrélation entre TTNT et OS était de 0,47 (IC à 95% : 0,46-0,48). Les chercheurs concluent que la rwPFS et la TTNT peuvent constituer des critères intermédiaires significatifs pour l’OS chez les patientes atteintes de MBC dans leur ensemble et au sein des différents sous-groupes de la maladie (figure 1).
Congrès : ASCO Annual Meeting
Littérature :
- Dedousis D, Zhang A, Vassiliou A, et al : Survival in patients with breast cancer and history of autoimmune disease. J Clin Oncol 40, 2022 (suppl 16 ; abstr 1020)
- Puthanmadhom Narayana S, Rosenzweig MQ, Ren D, et al. : Effect of socioeconomic status as measured by Neighborhood Deprivation Index on survival in metastatic breast cancer. J Clin Oncol 40, 2022 (suppl 16 ; abstr 1013)
- Labaki C, Bakouny Z, Sanglier T, et al : Real-world progression-free survival (rwPFS) and time to next line of therapy (TTNT) as intermediate endpoints for survival in metastatic breast cancer : A real-world experience. J Clin Oncol 40, 2022 (suppl 16 ; abstr 6520).
InFo ONKOLOGIE & HÄMATOLOGIE 2022 ; 10(3) : 22-23 (publié le 20.6.22, ahead of print)