Le carcinome urothélial est responsable de 90% des tumeurs de la vessie. Chaque année, 1250 nouvelles personnes en sont atteintes en Suisse, principalement des hommes âgés. Le traitement standard est une chimiothérapie à base de cisplatine. Dans les formes métastatiques, l’immunothérapie joue un rôle de plus en plus important.
Le carcinome urothélial est responsable de 90% des tumeurs de la vessie. Dans les pays occidentaux, les carcinomes épidermoïdes, les adénocarcinomes et les carcinomes à petites cellules sont rares. Les sarcomes, les lymphomes ou les mélanomes sont encore plus rares. Le carcinome urothélial de la vessie est responsable d’environ 3% des cas de cancer en Suisse, ce qui signifie que 1250 nouvelles personnes sont atteintes chaque année [1]. 75% des personnes touchées sont des hommes. Plus de 60% ont plus de 70 ans au moment du diagnostic. Les facteurs de risque sont la nicotine et les polluants tels que les amines aromatiques (maladie professionnelle), les st. après chimiothérapie et radiothérapie. Les carcinomes urothéliaux du tractus urothélial supérieur surviennent rarement dans le cadre d’un syndrome de Lynch. Au moment du diagnostic, les patients se présentent souvent avec une macrohématurie, une pollakiurie, une dysurie et des symptômes d’urgence urinaire. Malheureusement, lors de la première manifestation, 20 à 25% sont déjà envahis par le muscle. Historiquement, les patients atteints de métastases ont une survie moyenne de 12 à 18 mois seulement.
Le stade localisé
Les stades précoces fréquents (carcinomes urothéliaux non invasifs pour le muscle) sont réséqués de manière radicale par résection transurétrale (TUR vessie). Les patients à risque intermédiaire ou élevé sont ensuite traités par BCG intravésical ou par chimiothérapie. Les patients qui ne répondent pas au BCG ont aujourd’hui la possibilité d’être traités par immunothérapie. Dans l’étude de phase 2 (étude Keynote-057), des patients atteints d’un carcinome de la vessie à haut risque non invasif sur le plan musculaire et ne répondant pas au BCG ont été traités par pembrolizumab toutes les 3 semaines pendant 2 ans. Un taux de rémission complète de 41% a pu être atteint. Les effets secondaires sont comparables à ceux observés dans le cadre d’un traitement métastatique. Ce traitement a été approuvé par la FDA aux États-Unis [2].
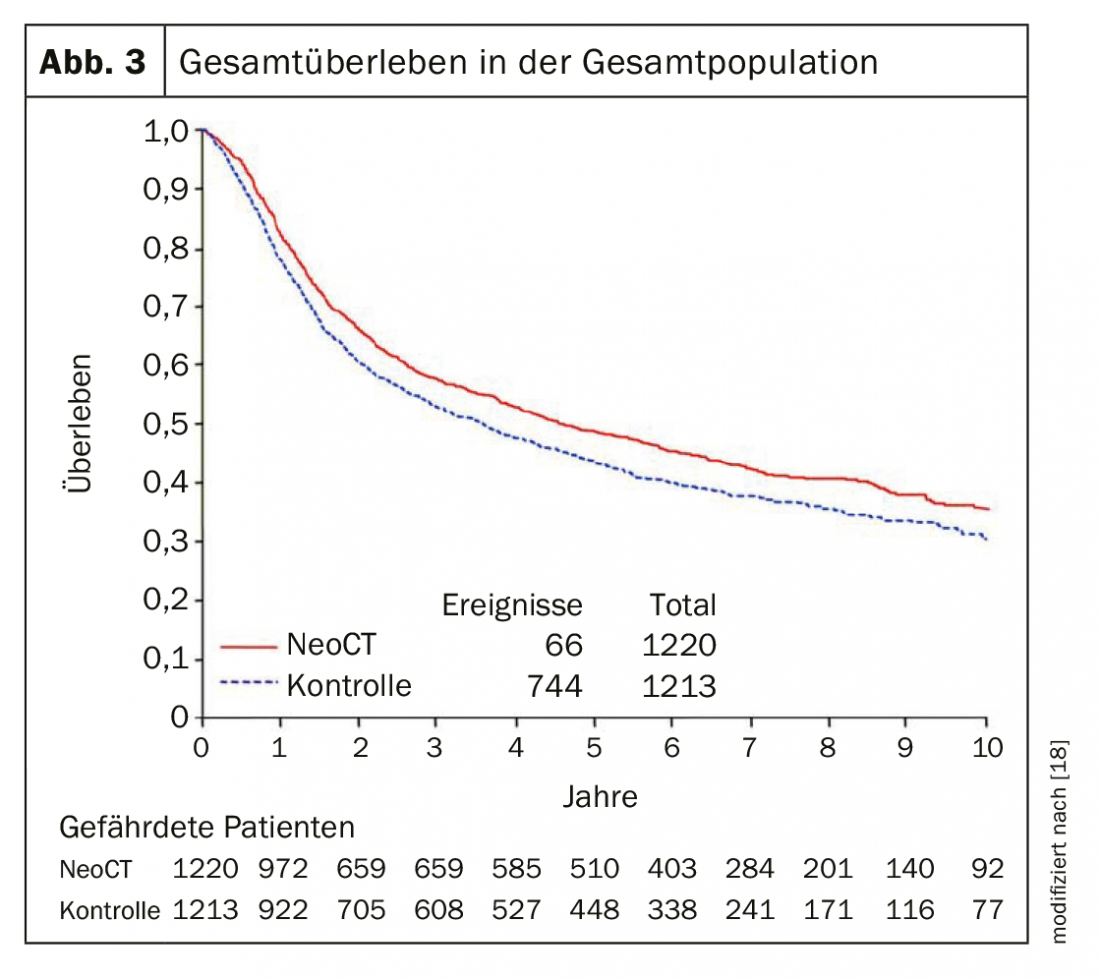
Le cancer urothélial invasif du muscle au stade localisé reste un problème majeur. Environ 50% des patients atteints d’un carcinome de la vessie invasif sur le plan musculaire meurent dans les 3 ans en raison d’une métastase, malgré une cystectomie. A partir du stade T2 ou N+, une chimiothérapie néoadjuvante (NAC) devrait donc être proposée aux patients. Avec 3-4 cycles de chimiothérapie contenant du cisplatine (cisplatine et gemcitabine ou MVAC à dose fixe), la survie à 5 ans a pu être augmentée de 5% en valeur absolue (fig. 1). Une méta-analyse a montré qu’une NAC avec cisplatine et gemcitabine permettait d’obtenir un downstaging pathologique (<pT2) chez 49% des patients. Après NAC, le taux postopératoire de tumeurs ypT0-N0 était de 25-30%, ce qui a un impact significatif sur la survie sans progression et la survie globale [3]. Malheureusement, l’acceptation de la chimiothérapie néoadjuvante n’a que peu progressé ces dernières années. Seule une partie des patients est soumise à une chimiothérapie néoadjuvante. De plus, certains patients ne sont pas éligibles à la chimiothérapie en raison de leur co-morbidité, c’est-à-dire qu’une chimiothérapie à base de cisplatine n’est pas envisageable pour eux. Le remplacement du cisplatine par le carboplatine est associé à un résultat nettement moins bon et ne devrait donc pas être effectué. Les bons résultats de l’immunothérapie dans le cadre d’un traitement métastatique ont conduit à ce que l’ajout d’une immunothérapie à une chimiothérapie néoadjuvante soit actuellement évalué dans le cadre de différentes études. Des études de phase 2 ont montré qu’un traitement néoadjuvant avec les inhibiteurs de point de contrôle atezolizumab et pembrolizumab permettait d’obtenir un taux de réponse pathologique complète de 30-40% et que le taux de réponse global (<pT2) était de 40-50% [4,5]. Le facteur décisif était l’expression de PDL-1, qui était associée à un meilleur taux de réponse.
Les résultats de l’étude BLASST-1, qui a évalué le nivolumab en combinaison avec le cisplatine et la gemcitabine, ont montré une rémission pathologique complète de 49% [6]. Avec une chimiothérapie néoadjuvante à base de cisplatine/gemcitabine seule, on trouve une pCR d’environ 30%. L’étude SAKK 06/17, qui évaluait une chimiothérapie néoadjuvante à base de cisplatine et de gemcitabine associée à l’immunothérapie durvalumab, suivie d’un traitement d’entretien postopératoire à base de durvalumab, a récemment été close. Une analyse intérimaire a montré un taux de rémission pathologique complète de 30%. Les résultats définitifs sont attendus avec impatience.
Le gold standard pour le traitement du carcinome urothélial invasif au niveau musculaire à partir des stades T2-4a, N0-X M0 reste la cystectomie radicale et la lymphadénectomie pelvienne (avec conduit iléal ou vessie de remplacement). Dans les situations à risque, telles que les récidives après instillation de BCG ou les tumeurs de haut grade étendues ou multilocalisées, la cystectomie précoce est recommandée dès le stade pT1. Le timing de l’opération après NAC est important. Si l’intervalle entre la chimiothérapie et la cystectomie dépasse 10 semaines, la survie globale se dégrade significativement. De même, renoncer à l’opération en cas de réponse clinique complète est une négligence, car 64% des patients ont encore une tumeur résiduelle après la cystectomie. La proportion de carcinomes urothéliaux pT3/4 avec ou sans atteinte ganglionnaire était de 25%.
Le “traitement trimodal” de préservation de la vessie, qui associe une résection transurétrale radicale et une radiochimiothérapie, peut constituer une alternative pour les patients inopérables ou ceux qui souhaitent vivement conserver leur organe, mais ses résultats oncologiques sont moins bons [7].
Une chimiothérapie adjuvante doit être envisagée si aucune chimiothérapie néoadjuvante n’a été effectuée. En particulier à partir des stades T3 et N+. Les données des méta-analyses à ce sujet sont moins solides, mais il semble que ces patients en bénéficient également [8].
Stades métastatiques
Les patients atteints d’une maladie récidivante ou métastatique ont un très mauvais pronostic (12 à 18 mois). Les facteurs pronostiques particulièrement défavorables en termes de survie globale sont : un mauvais état général avec un statut de performance de Karnofsky <80% et des métastases viscérales, y compris des métastases du squelette. La chimiothérapie standard à base de cisplatine et de gemcitabine permet d’obtenir une réponse de 50% [9]. La survie moyenne est de 14 mois. Après tout, 13 à 15% des patients sont encore en vie après 5 ans. Chez les patients en bon état général et en l’absence de métastases viscérales, la survie médiane est même de 33 mois et 20% sont encore en vie après 5 ans. Malheureusement, ce traitement n’est pas réalisable chez de nombreux patients âgés en raison de la co-morbidité. Dans la pratique clinique quotidienne, le carboplatine est souvent utilisé à la place du cisplatine, qui est nettement moins efficace pour le carcinome urothélial.
Avec les inhibiteurs de points de contrôle, il existe désormais une nouvelle option thérapeutique qui offre une possibilité de traitement, en particulier chez les patients âgés qui ne peuvent pas recevoir de cisplatine. Dans l’étude de phase 2 Keynote-052, les patients ont été traités avec du pembrolizumab 200 mg toutes les 3 semaines pendant une durée allant jusqu’à 2 ans [10]. Le taux de réponse est de 29%, dont 7% de rémission complète. La réponse s’est principalement manifestée lorsque l’expression de PD-L1 était supérieure à 10% (38%), bien qu’une réponse ait également été observée lorsque l’expression de PD-L1 était inférieure à 10%. Dans l’étude de phase 2 IMvigor 210, l’atezolizumab a permis d’atteindre une survie moyenne d’environ 16 mois [11]. Les patients qui avaient une forte expression de PD-L1 ont nettement mieux profité de l’immunothérapie (survie moyenne de 19 mois). La réponse a été de 32% avec 9% de rémissions complètes.
En deuxième ligne, après l’échec du traitement au platine, on peut s’attendre à une réponse d’environ 10-20%. La vinflunine a été testée dans une étude de phase 3 contre les meilleurs soins de support [12]. Une réponse de 9% et un avantage en termes de survie médiane (6,9 contre 4,6 mois) ont été observés.
Dans IMvigor 211, une étude de phase 3 comparant l’atezolizumab à différents agents chimiothérapeutiques, aucun effet significatif de l’immunothérapie n’a été observé [13]. L’étude de phase 3 Keynote-045, qui a également comparé l’immunothérapie (pembrolizumab) aux différents traitements (vinflunine, taxanes), a toutefois été positive, avec une survie de 10,3 vs 7,4 mois. Après un an, 44% des patients ayant reçu une chimiothérapie étaient encore en vie, contre 33% [14].
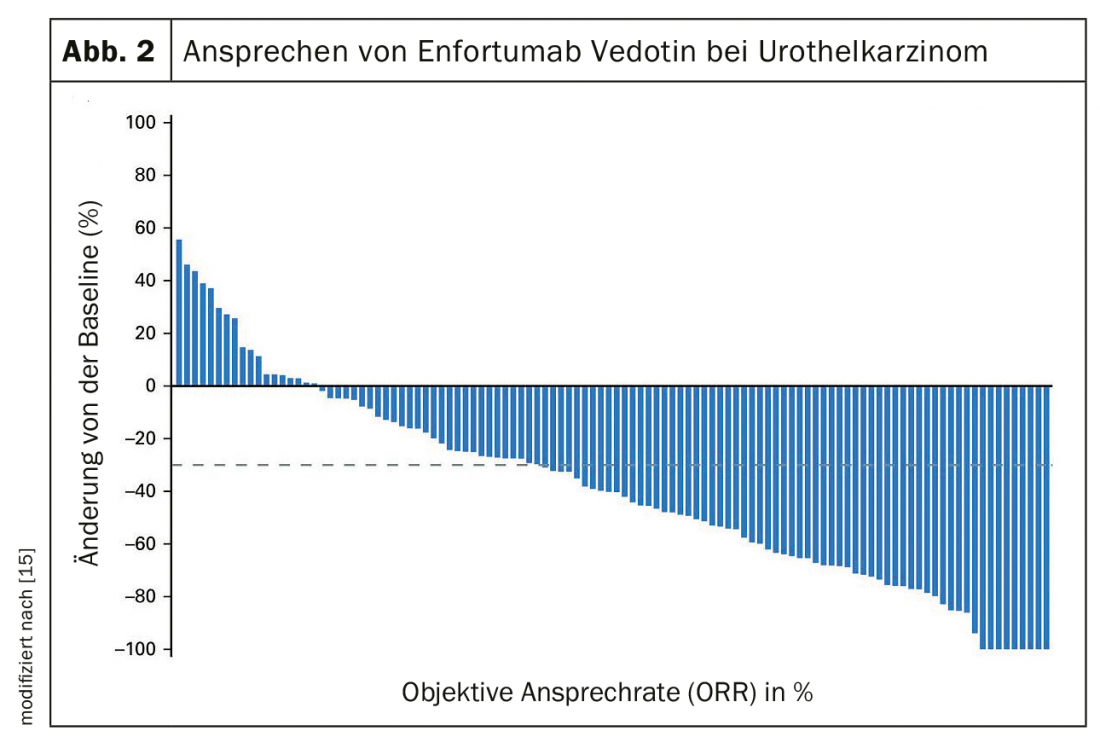
Après l’échec d’une chimiothérapie à base de platine et d’une immunothérapie, un traitement par enfortumab vedotin, un conjugué anti-body drug, peut être envisagé [15]. La réponse au traitement dans l’étude de phase 2 était tout de même de 44% avec 12% de rémissions complètes (Fig. 2). La réponse médiane a été de 7,6 mois.
Pour les patients présentant une mutation du gène FGFR 3 ou une fusion du gène FGFR 2 ou 3, il existe une possibilité de traitement par l’erdafitinib, un inhibiteur du FGFR. Une étude ouverte de phase 2 a été menée chez des patients ayant reçu au moins un traitement antérieur par erdafitinib [16]. Une réponse de 40% et une survie sans progression et globale de 5,5 et 5,5 respectivement ont été observées. 13,8 mois. L’autorisation de mise sur le marché aux États-Unis a été accordée sur la base du taux de réponse. Dans une phase 3, le traitement est maintenant testé contre la chimiothérapie et l’immunothérapie.
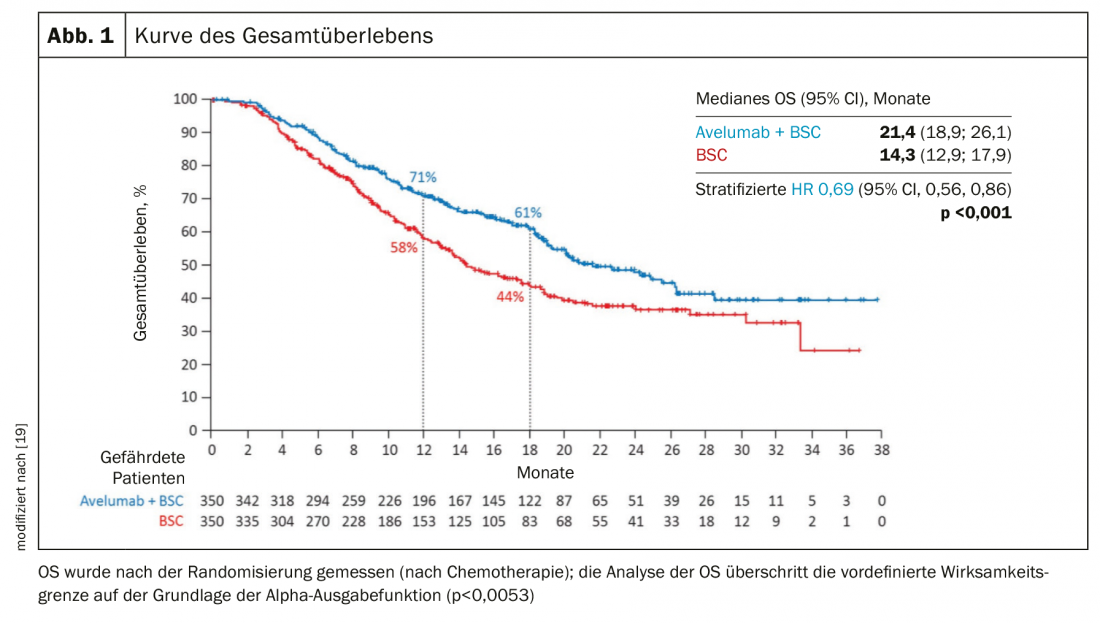
On ne sait pas encore si la chimio-immunothérapie primaire, qui est déjà un standard dans le cancer bronchique, est également un avantage dans le cancer urothélial. En raison de la charge mutationnelle tumorale élevée qui, dans de nombreuses tumeurs, indique une bonne réponse à l’immunothérapie, il est plausible qu’il y ait un avantage à utiliser l’immunothérapie à un stade précoce. IMvigor130, une étude de phase 3 comparant platine/gemcitabine +/- atezolizumab, s’est révélée négative en termes de survie globale co-primaire par ponction finale [17]. En revanche, la survie sans progression a été améliorée de 1,9 mois (6,3 vs 8,2 mois). Dans l’étude JAVELIN Bladder 100 de phase 3, les patients qui n’ont pas progressé après une chimiothérapie à base de cisplatine ont été traités par immunothérapie à l’avelumab. Les patients sous avelumab ont vécu en moyenne 7 mois de plus (OS 14,3 vs 21,4 mois) (Fig. 3) [18].
Messages Take-Home
- La chimiothérapie néoadjuvante à base de cisplatine reste la norme pour les tumeurs localisées à partir du stade T2 et améliore la survie de 5% en valeur absolue.
- Dans le cas du carcinome urothélial métastatique, le traitement d’entretien par l’inhibiteur de point de contrôle avelumab améliore la survie de 7 mois en cas de réponse à une chimiothérapie à base de platine.
- Chez les patients âgés et polymorbides atteints d’un carcinome urothélial localement avancé et métastasé, il existe une option d’immunothérapie seule avec une bonne tolérance.
- Les marqueurs moléculaires ont également une importance croissante dans le traitement du carcinome urothélial avec l’option d’une “thérapie ciblée”, par exemple avec l’inhibiteur du FGFR, l’erdafitinib.
- Le traitement par le conjugué anti-body drug enfortumab vedotin a également un taux de réponse élevé chez les patients prétraités.
Littérature :
- www.nicer.org
- www.fda.org/drugs
- Advanced Bladder Cancer (ABC) Meta-analysis Collaboration : Neoadjuvant chemotherapy in invasive bladder cancer : update of a systematic review and meta-analysis for individual patient data advanced bladder cancer (ABC) meta-analysis collaboration. Eur Urol 2005 ; 48(2) : 202-205.
- Powles T, et al : A phase II study investigating the safety and efficacy of neoadjuvant atezolizumab in muscle invasive bladder cancer (ABACUS). J Clin Oncol.2018;36(suppl 15 ; abstr 4506).
- Necchi A. et al : Pembrolizumab as neoadjuvant therapy before radical cystectomy in patients with muscle-invasive bladder carcinoma (PURE-01) : an open-label, single-arm, phase II study. J Clin Oncol 2018;36(34) : 3353-3360.
- Gupta S, et al : Résultats de BLASST-1 (Bladder Cancer Signal Seeking Trial) de nivolumab, gemcitabine, et cisplatine dans le cancer invasif de la vessie musculaire (MIBC) subissant une cystectomie. J Clin Oncol 2020;38(suppl 6 ; abstr 439).
- Chedgy ECP, et al : La cystectomie radicale et la prise en charge multidisciplinaire du cancer de la vessie invasif sur le plan musculaire. JAMA Oncol 2016;2(7):855-856.
- Leow JJ et al. Chimiothérapie adjuvante pour le cancer invasif de la vessie : une revue systématique et une méta-analyse des essais randomisés mises à jour en 2013. Eur Urol. 2014 Jul;66(1):42-54.
- Van der Maase H, et al : Long-term survival results of randomized trial comparing gemcitabine plus cisplatin with methotrexate, vinblastine, doxorubicin plus cisplatin in patients with bladder cancer. J Clin Oncol 2005;23(21) : 4602-4608.
- Balar AV, et al : Première ligne de pembrolizumab chez les patients acceptant le cisplatine et atteints d’un cancer urothélial localement avancé et non résécable ou métastatique (KEYNOTE-052) : étude multicentrique, à un seul bras, de phase 2. Lancet Oncol. 2017;18(11) : 1483.
- Balar AV, et al : Atezolizumab as first-line treatment in cisplatin-ineligible patients with locally advanced and metastatic urothelial carcinoma : a single-arm, multicentre, phase 2 trial. Lancet 2017;389(10064) : 67.
- Bellmunt J, et al : Phase III trial of vinflunine plus best supportive care compared with best supportive care alone after a platinum-containing regimen in patients with advanced transitional cell carcinoma of the urothelial tract. J Clin Oncol. 2009;27(27) : 4454.
- Powles T, et al : Atezolizumab versus chemotherapy in patients with platinum-treated locally advanced or metastatic urothelial carcinoma (IMvigor211) : a multicentre, open-label, phase 3 randomised controlled trial. Lancet . 2018 ; 391 : 748-757.
- Bellmunt J, et al : Pembrolizumab as Second-Line Therapy for Advanced Urothelial Carcinoma. N Engl J Med. 2017;376(11) : 1015.
- Rosenberg JE et al. Essai pivot de l’enfortumab vedotin dans le carcinome urothélial après platine et traitement anti-programmé de mort 1/ligand de mort 1 programmé. J Clin Oncol. 2019;37(29):2592.
- Loriot Y et al. Erdafitinib dans le carcinome urothélial localement avancé ou métastatique. N Engl J Med. 2019;381(4) : 338
- IMvigor 130. ESMO 2019.
- Powles, et al : Javelin Bladder 100. ASCO 2020. Journal of Clinical Oncology 38, no. 18_suppl ; DOI : 10.1200/JCO.2020.38.18_suppl.LBA1
- Vale CL : Neoadjuvant Chemotherapy in invasive bladder cancer : Update of a systematic review and Metaanalysis. Urologie européenne 2005.
InFo ONKOLOGIE & HÉMATOLOGIE 2020 ; 8(4) : 6-9