Le diagnostic de l’épanchement pleural est très complexe, car un grand nombre de pathologies peuvent provoquer un épanchement pleural. La principale distinction est entre les épanchements trans- et exsudatifs et leurs causes. Les paramètres chimiques de laboratoire et les examens cytologiques sont alors d’une grande aide. En fonction de la cause, un traitement supplémentaire peut être mis en place. Pour cela, de nombreuses méthodes sont disponibles, de la simple ponction de décharge à la thoracoscopie en passant par les drains pleuraux.
La plèvre, en tant que peau séreuse recouvrant les poumons, est une partie importante de la mécanique respiratoire de l’ensemble du système. Une fine couche de liquide est nécessaire pour assurer un glissement aisé des feuillets pleuraux les uns sur les autres et donc des poumons à l’intérieur du thorax. Cela permet une transmission rapide de la force des muscles respiratoires et de l’excursion thoracique vers les poumons. Le poumon lui-même est relié à la paroi thoracique par ce liquide. Les cellules mésothéliales de la plèvre ont d’une part un rôle passif dans la lubrification du système respiratoire et d’autre part un rôle actif dans la production de macromolécules, de cytokines inflammatoires, de facteurs de croissance et de peptides chimiotactiques. Une fonction importante est le transport actif de protéines, de liquide lymphatique et de cellules à travers la séreuse, ainsi que l’absorption de liquide couplée à des électrolytes.
Modification de la perméabilité pleurale par des processus pathologiques
En cas d’inflammation de la plèvre et/ou des structures pulmonaires voisines, des modifications des cellules mésothéliales et de la structure de la surface de la plèvre entraînent une perte de protéines dans l’espace pleural. Les forces motrices de l’augmentation de l’accumulation de liquide sont une augmentation de la pression hydrostatique, une diminution de la pression oncotique et une modification de l’évacuation du liquide lymphatique. La perméabilité pleurale est modifiée par le contact avec les bactéries, les lipopolysaccharides, la thrombine [1]. Ce contact augmente la sécrétion de VEGF dans les cellules mésothéliales, qui est un puissant médiateur de l’augmentation de la perméabilité [2].
Clinique et présentation
Les symptômes typiques d’un épanchement pleural sont des douleurs thoraciques, une toux et une dyspnée. La douleur pleurétique se produit au niveau de la plèvre pariétale, car ni la plèvre viscérale ni les poumons ne possèdent de récepteurs de la douleur. Il s’agit typiquement d’une douleur violente d’apparition rapide, irradiant vers l’épaule et la partie supérieure de l’abdomen. La douleur diminue généralement avec l’augmentation de l’épanchement pleural. La toux dans les affections pleurales est un symptôme non spécifique, plutôt sec et persistant, associé à des difficultés respiratoires. La dyspnée résulte initialement de la fièvre et de la douleur et, lorsque les épanchements augmentent rapidement, de la compression des poumons. Typiquement, la dyspnée est dépendante de la position [3].
Diagnostic par imagerie
L’épanchement pleural et les maladies pleurales peuvent être détectés par toutes les techniques radiologiques et faire l’objet d’un examen plus approfondi. La radiographie thoracique antéro-postérieure permet de visualiser des épanchements de plus de 200 ml, bien que des volumes d’épanchement plus importants puissent souvent être ignorés par la radiographie thoracique. Le scanner permet déjà de détecter beaucoup moins d’épanchement et peut permettre de diagnostiquer une multitude de pathologies pulmonaires et pleurales concomitantes. Les maladies sous-jacentes telles que les pneumonies, les embolies pulmonaires, les tumeurs malignes thoraciques, les maladies pulmonaires interstitielles, les maladies pleurales ainsi que les pathologies cardiaques et les pathologies de l’abdomen supérieur adjacentes peuvent être diagnostiquées de manière satisfaisante. La distinction entre les dépôts bénins et les structures malignes est possible avec une sensibilité de 90% [4].
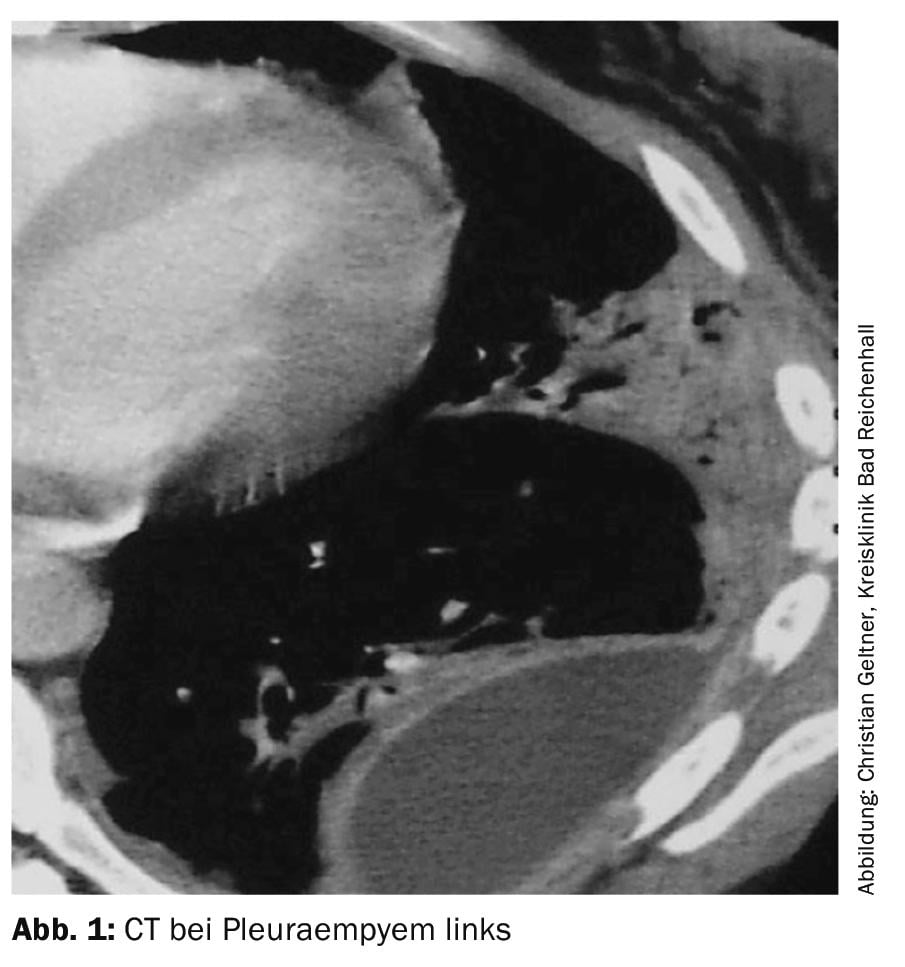
Un scanner doit être réalisé avec un rehaussement du contraste et un faible volume de liquide résiduel (Fig. 1). Les épanchements volumineux doivent d’abord être drainés [4].
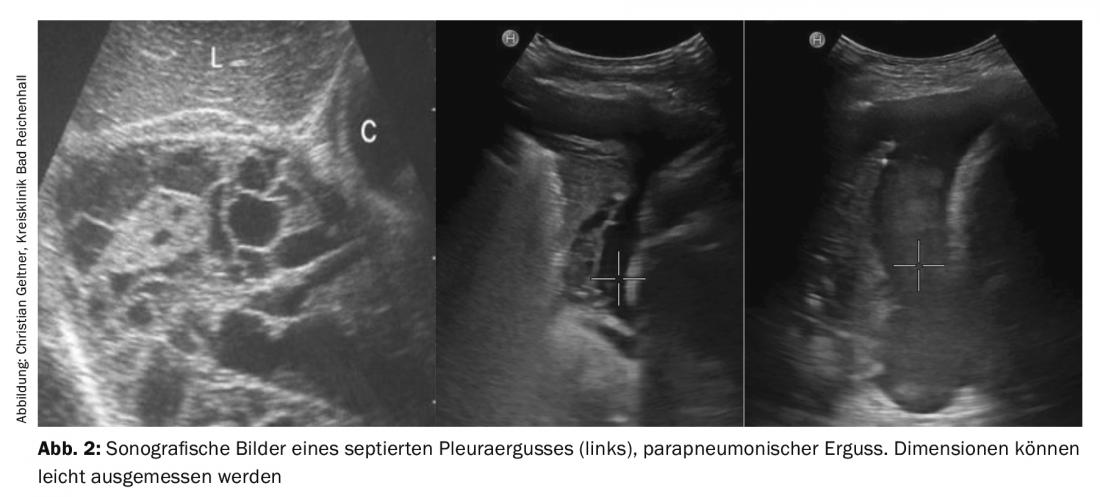
L’échographie thoracique et pleurale est une méthode sûre et inoffensive pour diagnostiquer et quantifier les épanchements, ainsi que pour visualiser les pathologies associées (Fig. 2). Elle permet également de distinguer les épanchements parapneumoniques simples et compliqués, les dépôts malins et les infiltrats pulmonaires. L’IRM ne doit pas être réalisée de manière systématique. La seule amélioration diagnostique est donnée dans le staging des mésothéliomes pleuraux avérés [5].
Diagnostic invasif
Une ponction pleurale (thoracocentèse) est nécessaire pour le diagnostic différentiel de tous les épanchements pleuraux après avoir exclu les principales causes de transsudation [6]. Les épanchements transsudatifs ne doivent pas être ponctionnés si la cause est claire. Dans ce cas, un traitement médicamenteux de la cause est d’abord nécessaire. Une échographie avant la ponction est utile car elle permet d’estimer le site de ponction et la quantité de liquide ponctionné. La ponction pleurale est une méthode invasive de diagnostic très sûre. Le pneumothorax se produit dans environ 3 à 10 % des cas. Une analyse chimique du liquide pleural permet généralement d’en expliquer la cause. La cytologie permet de poser un diagnostic sûr dans 60% des cas de tuberculose et seulement dans 25% des cas de malignité. Une cytologie négative n’exclut pas un épanchement pleural malin.
Il existe différentes techniques de biopsie pleurale pour obtenir des échantillons histologiques de la plèvre . Différentes aiguilles ont été mises au point pour la biopsie de la plèvre pariétale. Elles permettent de prélever des tissus en vue d’un examen histologique. Les risques sont des hémorragies importantes, des pneumothorax et des lésions du diaphragme et de la surface des poumons. Le rendement diagnostique est d’environ 80% pour la tuberculose, 43% pour la carcinose pleurale et 25% pour le mésothéliome pleural malin [7,8].
La thoracoscopie médicale, en tant que procédure simple et peu invasive, a connu une renaissance grâce au développement de petits systèmes optiques et d’endoscopes semi-flexibles. Dans ce cas, il est possible de réaliser une biopsie sous contrôle optique de la plèvre et des poumons avec une sensibilité et une spécificité diagnostiques pouvant atteindre 98%.
La thoracoscopie chirurgicale vidéo-assistée (VATS) est, outre l’obtention de biopsies et de résections wedge pulmonaires plus importantes, une procédure thérapeutique offrant toutes les possibilités d’interventions chirurgicales thoraciques telles que l’abrasion pleurale, la pleurectomie, la décortication ainsi que les lobotomies et les pneumectomies.
Distinction entre exsudat et transsudat
En cas d’épanchement macroscopiquement clair, il convient de faire la distinction entre les transsudats purs et les exsudats. L’analyse chimique du ponctionnement et les critères de Light (mesure des taux de protéines et de LDH dans le liquide pleural et le sérum) ont la plus grande sensibilité.
Un critère clinique important est de savoir si les épanchements sont unilatéraux ou bilatéraux ; cela aide au diagnostic différentiel. Les transsudats sont typiquement bilatéraux, bien qu’ils puissent également être unilatéraux dans environ 20% des cas. Les épanchements inflammatoires se produisent généralement du côté de la pathologie, à la grande exception des maladies systémiques (comme les collagénoses ou les carcinomes métastatiques).
L’épanchement pleural transsudatif
Les épanchements transsudatifs sont causés par des changements de pression dans la plèvre. Une augmentation de l’afflux de liquide dans la plèvre d’une part et une diminution de l’évacuation du liquide d’autre part se produisent en cas d’augmentation de la pression veineuse dans la circulation systémique (insuffisance cardiaque droite), dans la circulation pulmonaire (insuffisance cardiaque gauche), dans la circulation portale (cirrhose du foie) ou en cas de baisse de la pression pleurale en cas d’atélectasie pulmonaire ou d’embolies pulmonaires. La quantité de liquide dépend de la modification des conditions de pression et de la filtration par la plèvre. Les principales causes sont l’insuffisance cardiaque gauche et les maladies rénales avec perte de protéines.
L’exsudat dans la plèvre
La base de tout exsudat est une réaction inflammatoire pleurale. L’inflammation de la plèvre peut résulter soit d’une infection, soit de l’implication de la plèvre dans un grand nombre de maladies systémiques. La pleurésie infectieuse est fréquente en cas d’atteinte de la plèvre dans le cadre de pneumonies. Cela peut aller d’une simple pleurésie concomitante à un empyème pleural, en passant par des épanchements parapneumoniques simples ou compliqués. Le degré et le type de réaction inflammatoire peuvent être identifiés par le nombre et le type de cellules inflammatoires présentes dans le liquide pleural.
Épanchements parapneumoniques
Les épanchements parapneumoniques surviennent chez 20 à 40% des patients hospitalisés pour une pneumonie. Le risque d’évolution prolongée et de mortalité est significativement plus élevé en cas de survenue d’un épanchement parapneumonique en cas de pneumonie. La survenue d’un empyème pleural sans pneumonie préalable est rare, mais doit être prise en compte dans le contexte d’une intervention chirurgicale, de manière iatrogène après une ponction ou chez les patients présentant une immunosuppression sévère. Si le traitement antibiotique systémique est suffisant et administré à temps, la plupart des épanchements infectieux guérissent. En principe, il existe une transition fluide entre l’épanchement exsudatif parapneumonique et l’empyème pleural, en passant par l’épanchement compliqué (tab. 1).
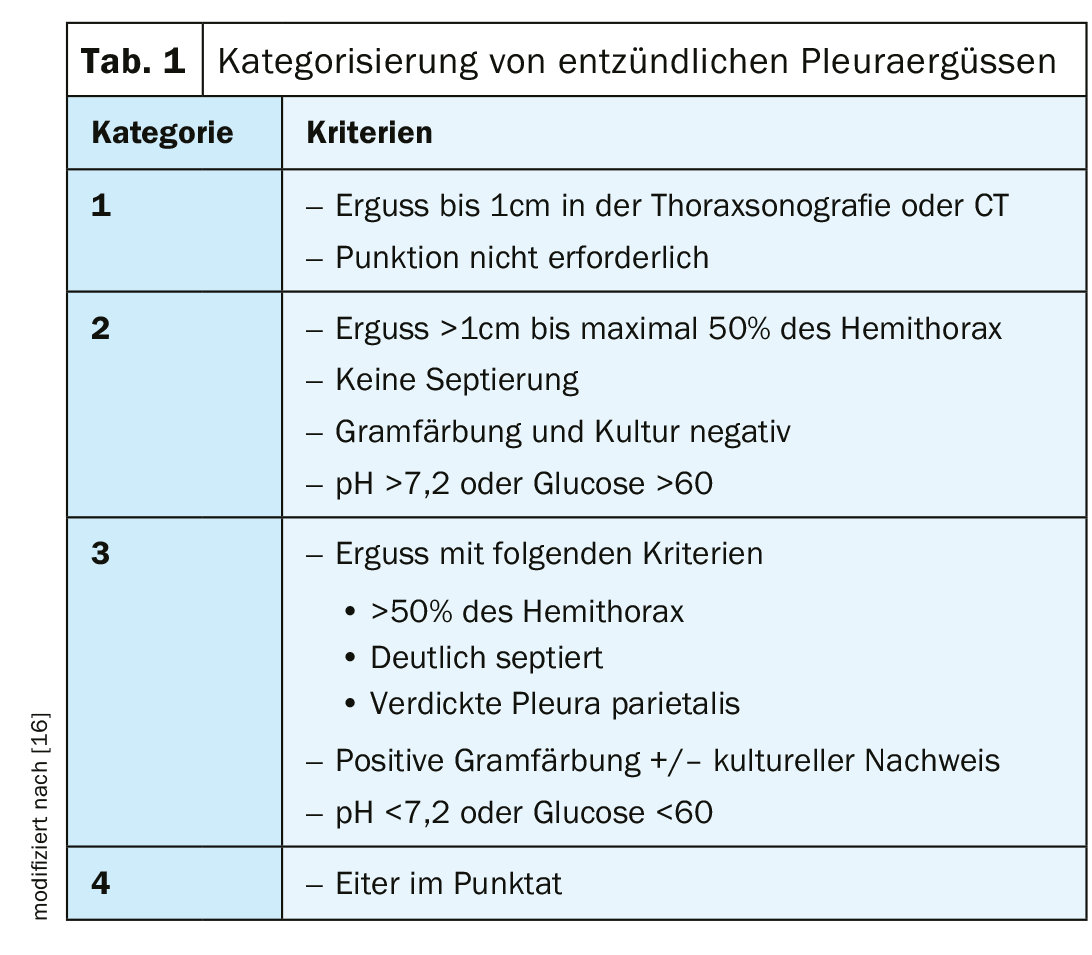
Le premier stade d’un épanchement inflammatoire est l’épanchement parapneumonique exsudatif à écoulement libre ; celui-ci est stérile et présente des paramètres de laboratoire normaux (leucocytes, LDH, pH, glucose). Un traitement antibiotique est suffisant. En cas de traitement inadéquat, un simple épanchement peut se compliquer jusqu’à un stade fibropurulent. La migration des bactéries et des cellules inflammatoires entraîne des processus inflammatoires avec une activité accrue de formation de fibrine, ce qui entraîne la formation de filaments de fibrine, de septa et la poursuite de la croissance bactérienne. Cela montre, à l’imagerie, un septage et une organisation croissants de l’épanchement. En laboratoire, les paramètres pathognomoniques sont les suivants : pH <7,2, glucose <60, LDH >1000. L’apparition de pus macroscopiquement visible est appelée empyème. Il en résulte une obstruction mécanique du poumon, la formation de septa purulents, la formation de nouveaux vaisseaux et l’organisation de l’épanchement par des fibroblastes et des leucocytes.
Après la chimie, qui permet de distinguer les transsudats des exsudats, le traitement cytologique de l’épanchement est d’une importance cruciale pour le diagnostic. On trouve des granulocytes neutrophiles dans les infections bactériennes précoces, jusqu’à l’empyème pleural. Les épanchements lymphocytaires sont typiques des tuberculoses, des sarcoïdoses, des lymphomes et des collagénoses, ainsi que de toutes les tumeurs malignes, tandis que nous trouvons des épanchements éosinophiles dans les embolies pulmonaires, les asbestoses, les aspergilloses, les mésothéliomes et les carcinoses pleurales. Les “anciens” épanchements montrent une augmentation de la population de lymphocytes dans le point [4]. Plus il y a de cellules inflammatoires dans la plèvre, plus il y a de chances qu’il y ait des complications, la formation de fibrine, la formation de membranes et des adhérences. En cas d’épanchement parapneumonique, un empyème pleural peut se développer par la suite. Dans ce cas, la culture bactériologique est généralement négative, car des anaérobies, difficiles à cultiver, sont souvent impliqués.
Pour les épanchements parapneumoniques, la graduation est la suivante :
- Epanchement parapneumonique non compliqué : exsudat, neutrophile prédominant
- Epanchement parapneumonique compliqué : invasion bactérienne croissante : le pH diminue, le glucose baisse, la LDH augmente. Des dépôts de fibrine et des formations de membranes se produisent.
- Empyème = présence de pus dans le ponction. Dans ce cas, une intervention chirurgicale est généralement nécessaire.
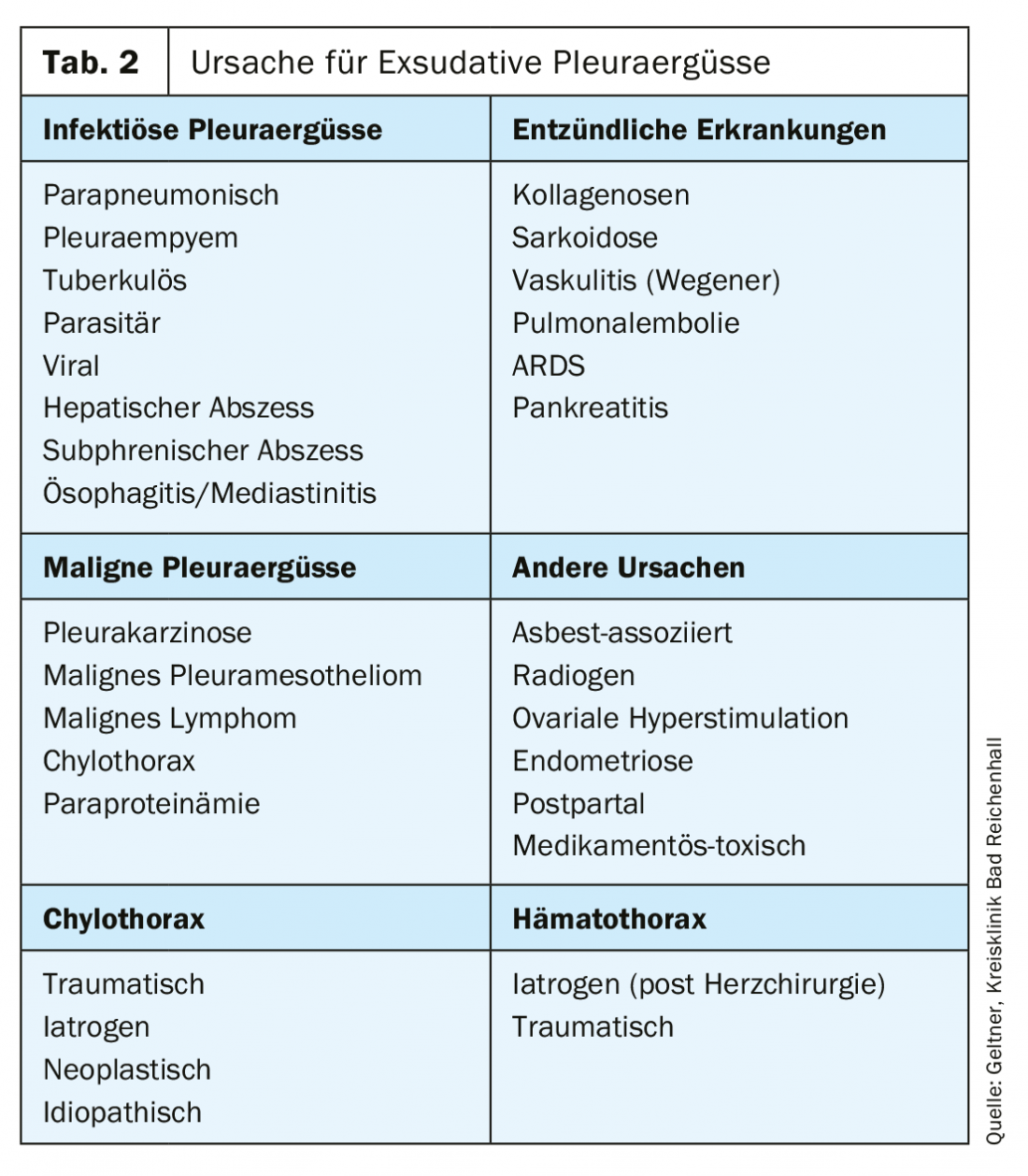
Les causes fréquentes d’exsudats sont les épanchements malins, qui surviennent le plus souvent en cas de carcinome bronchique, mammaire ou ovarien (tableau 2).
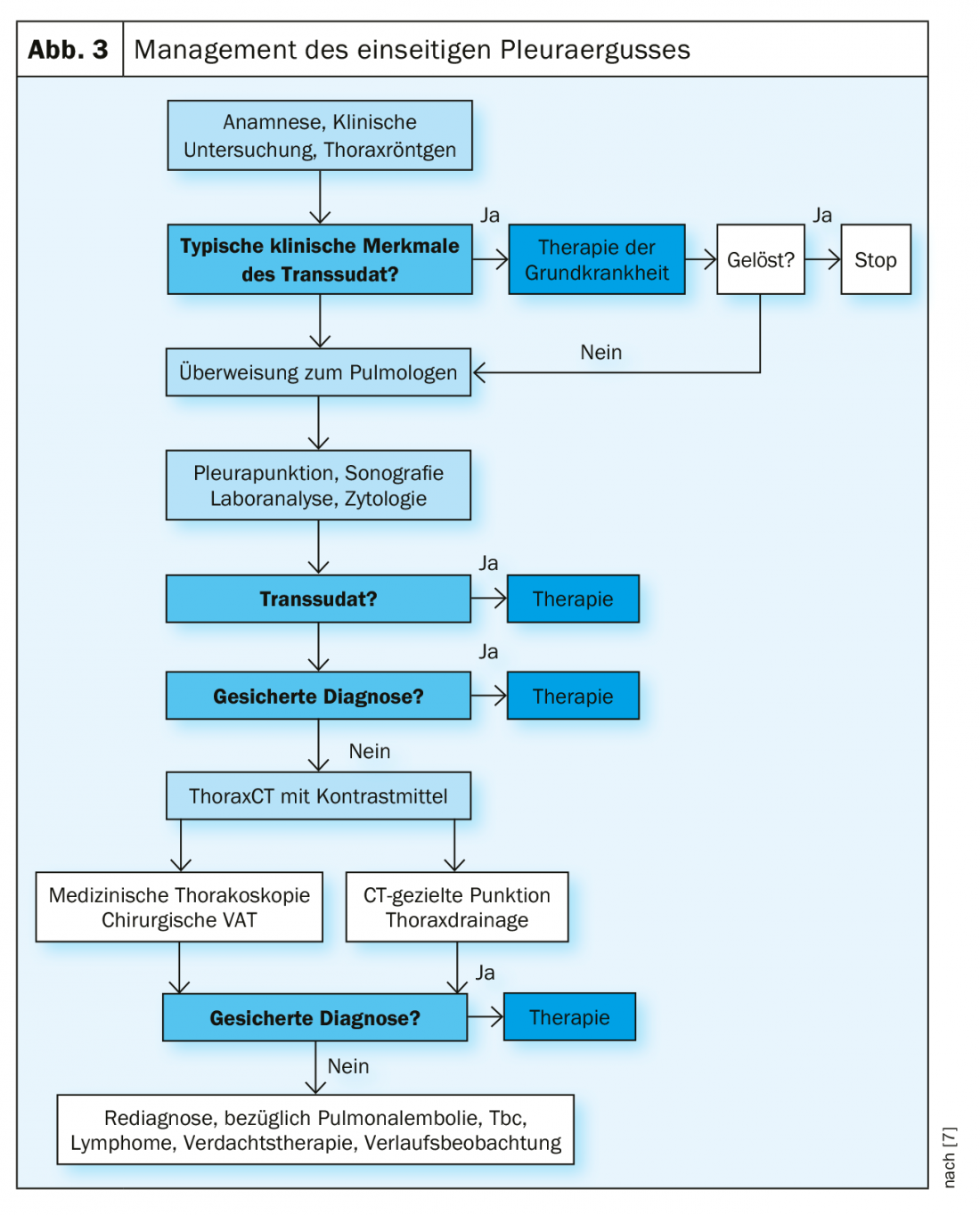
Gestion de l’épanchement pleural
La première étape de la prise en charge d’un épanchement est l’évaluation diagnostique de l’épanchement. La British Medical Society a développé un algorithme pratique dans ses guidelines (Fig. 3).
Gestion de l’épanchement malin
Les épanchements malins et la carcinose pleurale constituent une complication fréquente des tumeurs malignes thoraciques et extrathoraciques [9]. Ils sont très souvent nettement symptomatiques et nécessitent un traitement palliatif (fig. 4). Un traitement curatif n’est généralement plus possible à ce stade [10].
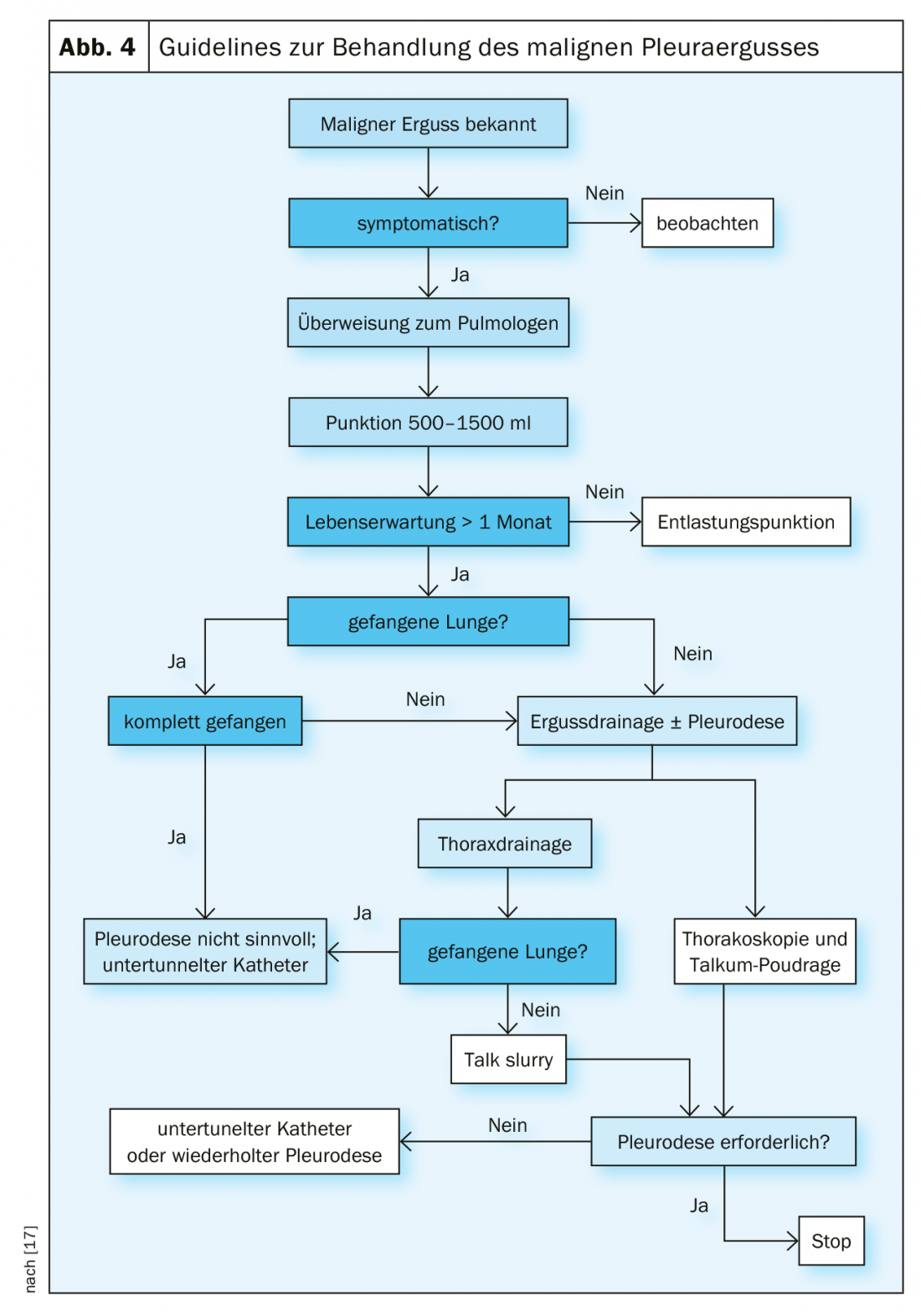
Ponction de décharge : cette procédure est la méthode de premier choix pour les patients symptomatiques. Les ponctions répétées ne doivent pas être pratiquées chez les patients dont l’espérance de vie est supérieure à un mois, car le risque d’une pleurésie et de la formation d’un poumon “piégé” est très élevé. Dans ce cas, il est recommandé de procéder à une pleurodèse. Si la décharge est supérieure à 1,5 litres, il y a un risque d’œdème de réexpansion des poumons. Dans ce cas, un drainage lent ou la mise en place d’un drain thoracique sont préférables. La ponction de décharge a un taux élevé de récidive de l’épanchement et un faible risque de pneumothorax ou d’empyème [11].
Drainage thoracique : pour les patients dont l’état général est acceptable et dont l’espérance de vie est supérieure à un mois, un drainage thoracique suivi d’une pleurodèse doit être effectué. Les substances sclérosantes créent une inflammation stérile de la plèvre et augmentent l’activité fibrinolytique. L’administration de stéroïdes réduit l’effet de la pleurodèse. Le talc est la substance la plus efficace et donc recommandée pour la pleurodèse. Les anti-inflammatoires non stéroïdiens (AINS) sont en principe possibles après une pleurodèse. Le traitement de la douleur est le même qu’avec les opiacés (mais il n’est pas meilleur). Il a été démontré qu’il n’y a pas d’impact négatif sur le taux de pleurodèse, de sorte que les AINS sont tout à fait utiles et recommandés après une pleurodèse (TIME-1-RCT) [12]. Le diamètre des drains thoraciques recommandés a encore diminué. En raison d’une douleur moindre, les guidelines 2010 recommandaient des drains fins (12F). Ces systèmes de drainage, fréquemment utilisés pour les épanchements pleuraux, ne présentent toutefois aucun avantage en termes de sensation de douleur et ont de moins bons résultats en ce qui concerne le succès de la pleurodèse au talc.
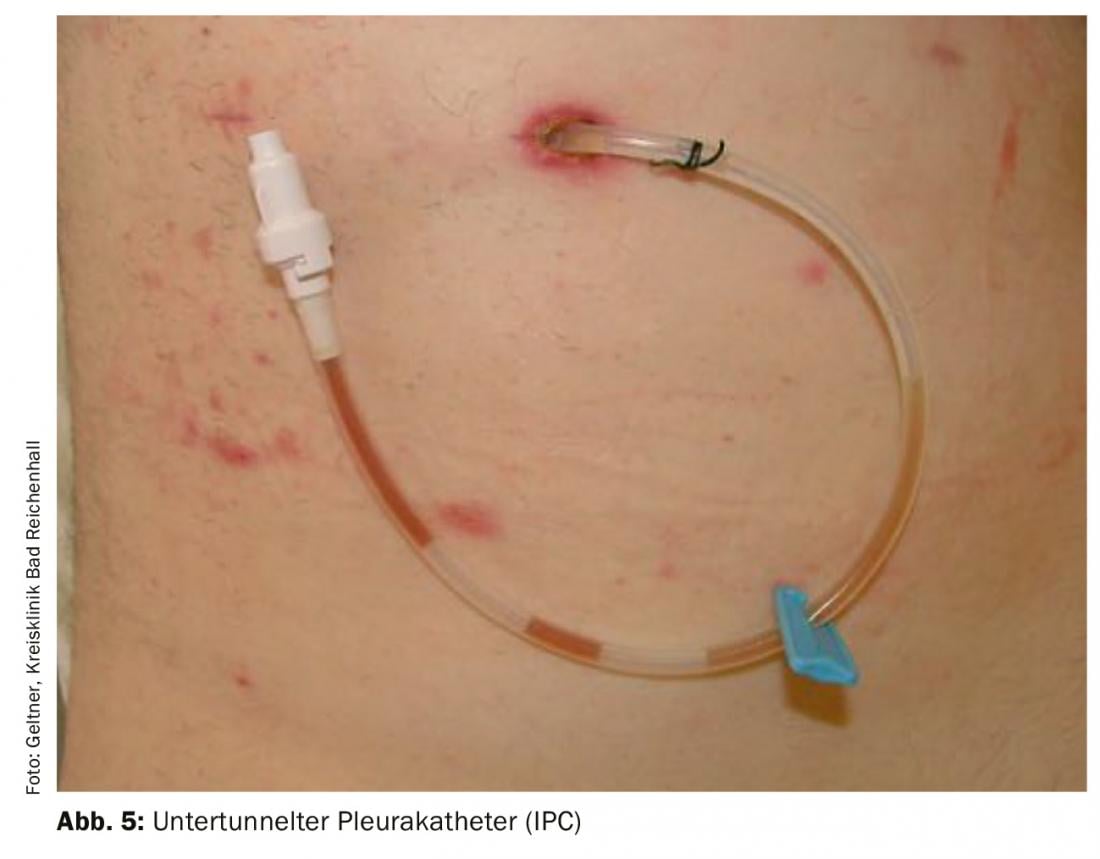
Cathéters pleuraux implantables permanents (CPI) [13] (Fig. 5) : Les CIP sont faciles à implanter et très sûrs en termes de taux d’infection et de complications. Les patients peuvent effectuer des ponctions de décharge en autogestion à l’aide de systèmes de décharge à vide simples. Le cas échéant, une pleurodèse peut également être effectuée via ces cathéters. L’implantation se fait le plus souvent en ambulatoire. La combinaison d’IPC sur lesquels du talc est ensuite appliqué a permis de multiplier par deux le taux de pleurodèse aiguë. Pleurodèse complète obtenue dans 45% des cas après 5 semaines. En l’état actuel des choses, l’application de talc doit être effectuée après la création d’une CIB. Le retrait est ainsi possible plus tôt dans de nombreux cas [14].
Thoracoscopie médicale mini-invasive : cette procédure est la méthode de choix pour réaliser une pleurodèse [15]. Sous anesthésie locale avec sédo-analgésie, une thoracoscopie peut être réalisée chez la plupart des patients. Aucune anesthésie avec intubation à double lumière n’est nécessaire. Même en cas de maladie très avancée et de mauvaise fonction pulmonaire ou cardiaque, une pleurodèse suffisante peut être obtenue par talcage. Le taux de réussite est de 80 à 90%.
Littérature :
- Krogel C : Immunobiologie de l’inflammation pleurale : implication potentielle pour la pathogenèse, le diagnostic et le traitement. ERJ 1997 ; 10 : 2411-2418
- Hott JW : Rôle du VEGF dans le développement des effusions pleurales malignes. AJRCCM 1999 ; A212 : 159.
- Yernault JC : Historique, symptômes et examen clinique dans les maladies pleurales. Eur Resp Monograph 2002 ; 22 : 60-75.
- Traill ZC, Davies RJO, Gleeson FV : Tomodensitométrie thoracique chez les patients présentant des effusions pleurales malignes suspectées. Clin Radiol 2001 ; 56 : 193-196.
- Giesel FL : Dynamic contrast enhanced MRI of malignant pleural mesothelioma : a feasibibility study of non-invasive assessment, therapeutic follow-up, and possible predictor of improved outcome. Chest 2006 ; 129 ; 1570-1576.
- Hooper C, et al. : Investigation of a unilateral pleural effusion in adults : British Thoracic Society pleural disease guideline 2010. BMJ Thorax 2010 ; 65(Suppl 2) : ii4-7.
- Loddenkemper R : Évaluation prospective des méthodes de biopsie dans le diagnostic de l’effusion pleurale maligne. Comparaison intra-patient entre la cytologie du liquide pleural, la biopsie à l’aiguille en aveugle, et la thoracoscopie. ARRD 1983 ; 127 : 114.
- Astoul P : Pleurodèse pour effusions pleurales malignes récurrentes : la quête du Saint Graal. Eur J Cardiothorac Surg 2011 ; 40(2) : 277-279.
- Geltner C, Errhalt P : Effusion pleurale maligne : pathogenesis, diagnosis, and management. MEMO 2016, en ligne le 19.11.2016. DOI 10.1007/s12254-015-0246-0.
- Feller-Kopman DJ, Prise en charge de l’effusion pleurale maligne. An Official ATS/STS/STR Clinical Practice Guideline. Am J Respir Crit Care Med 2018 ; 198(7) : 839-849.
- Sorensen PG, Svendsen TL, Enk B : Traitement de l’effusion pleurale maligne par drainage, avec ou sans instillation de talc. Eur J Respir Dis 1984 ; 65 : 131-135.
- Rahman NM : Effet des opioïdes contre les AINS et de la taille des tubes thoraciques plus ou moins grands sur le contrôle de la douleur et l’efficacité de la pleurésie chez les patients souffrant d’une effusion pleurale maligne : l’essai clinique randomisé TIME1. JAMA 2015 ; 314(24) : 2641-2653.
- Musani AI : Options de traitement de l’effusion pleurale maligne. Curr Opin Pulm Med 2009 ; 15 : 380-387.
- Bhatnagar R : Administration de talc en dehors du patient par cathéter pleural d’intubation pour l’effusion maligne. NEJM 2018 ; 378(14) : 1313-1322.
- Tschopp JM, et al : Pleurodèse par poudrage au talc sous simple thoracoscopie médicale : une opinion internationale. Thorax 2009 ; 64(3) : 273-274.
- Light RW : Effusions parapneumoniques et empyème. Proc Am Thorac Soc 2006 ; 3(1) : 75-80.
- Mac Duff A, Arnold A, Harvey J : Prise en charge du pneumothorax spontané : lignes directrices 2010 de la British Thoracic Society sur les maladies pleurales, Thorax 2010 ; 65 : ii18-ii31.
PRATIQUE DU MÉDECIN DE FAMILLE 2019 ; 14(9) : 16-20