L’accident vasculaire cérébral est l’une des principales causes d’invalidité. Les troubles cognitifs survenant après un AVC ont été plutôt négligés pendant de nombreuses années. L’examen porte sur l’incidence et la prévalence du déclin cognitif après un AVC, sur les principaux facteurs de prédisposition, sur les facteurs d’imagerie et sur les biomarqueurs candidats potentiels.
L’accident vasculaire cérébral est l’une des principales causes d’invalidité [1]. Alors que la plupart des recherches et des interventions se sont concentrées sur les handicaps physiques [2], les troubles cognitifs survenant après un AVC ont été plutôt négligés pendant de nombreuses années [3,4]. On sait aujourd’hui que les accidents vasculaires cérébraux, même mineurs, peuvent affecter le fonctionnement quotidien et la cognition et influencer ainsi la qualité de vie [5]. L’accident vasculaire cérébral ischémique peut faciliter l’apparition de la démence vasculaire ainsi qu’aggraver le déclin cognitif préexistant. Le début du déclin cognitif peut se manifester immédiatement après l’apparition d’un accident vasculaire cérébral ischémique, mais il y a souvent un retard dans le développement du déclin cognitif après un AVC [6]. Des mécanismes tant neurodégénératifs que vasculaires sont activés et entraînent probablement des processus qui se chevauchent au sein de l’unité neurovasculaire [7]. Dans la présente revue, nous nous concentrerons sur l’incidence et la prévalence du déclin cognitif après un AVC, sur les principaux facteurs de prédisposition, sur les facteurs d’imagerie et sur les biomarqueurs candidats potentiels.
Épidémiologie
Les survivants d’un AVC courent un risque accru de développer des troubles cognitifs. Les estimations rapportées de la prévalence de la démence sont cohérentes dans diverses études : 10 % des patients présentent une démence avant le premier AVC, 10 % développent une nouvelle démence après le premier AVC et plus d’un tiers présentent une démence après un AVC récurrent [8,9].
La forte association de la démence post-AVC avec les AVC multiples souligne le rôle causal central de l’AVC et, par conséquent, l’effet probable de soins optimaux de l’AVC en phase aiguë et de la prévention secondaire pour réduire la charge de la démence [8]. La prévalence des troubles cognitifs chez les survivants d’un AVC varie selon le contexte, la population, les critères d’exclusion (démence pré-AVC, AVC récurrent, aphasie), les critères utilisés pour le diagnostic des troubles cognitifs et l’intervalle de temps depuis l’AVC [10]. La prévalence de la démence post-AVC au cours de la première année suivant l’AVC varie de 7 % dans les études de population sur l’AVC primaire, à l’exclusion de la démence pré-AVC, à 41 % dans les études hospitalières incluant l’AVC récurrent et la démence pré-AVC [8]. Le risque de démence post-AVC s’est avéré être le plus élevé dans les premiers mois suivant l’AVC, ce qui pourrait être partiellement dû à une déficience cognitive non reconnue avant l’AVC [10]. Après l’incidence initiale de la démence post-AVC, l’incidence cumulée augmente linéairement à un taux de 3 % et de 1,7 % par an dans les études basées sur les hôpitaux et la population, respectivement [11]. Peu d’études ont utilisé des résultats à long terme : la plus longue période d’observation a été de 25 ans dans une étude basée sur la population qui a trouvé une incidence cumulative de démence post-AVC de 48 % à la 25e année [12].
Des troubles cognitifs peuvent également survenir après un AIT. Dans une récente revue systématique incluant 1167 patients, la prévalence de la déficience cognitive légère post-TIA variait de 29 à 68%. Des troubles cognitifs sévères ont été constatés chez 8 à 22 % des patients. Les études utilisant un instrument de dépistage cognitif et celles réalisées peu après l’AIT ou plusieurs années plus tard, ont rapporté les fréquences les plus élevées de déficience [13].
Définitions
La démence vasculaire est la deuxième cause la plus courante de déclin cognitif après la maladie d’Alzheimer et comprend la démence post-AVC. Par conséquent, les termes DSP et démence vasculaire ne sont pas synonymes. La démence vasculaire représente un concept qui inclut non seulement les infarctus corticaux et/ou sous-corticaux multiples, mais aussi les infarctus uniques stratégiques, les lésions de la substance blanche sans infarctus, les hémorragies et l’hypo perfusion comme causes possibles de démence. En outre, il faut souligner que tous les cas de démence post-AVC ne sont pas d’origine vasculaire. Par conséquent, le terme de démence post-AVC (DPA) est utilisé pour toute démence qui se développe à la suite d’un événement cérébrovasculaire clinique. De cette façon, le terme PSD ne suggère pas un processus neuropathologique particulier. En outre, la reconnaissance de l’état cognitif pré-AVC est essentielle pour permettre une classification appropriée. Un patient souffrant de troubles cognitifs préexistants qui présente un AVC mineur ne doit pas être étiqueté comme DSP. En outre, l’évaluation temporelle des troubles cognitifs est un autre facteur diagnostique pertinent. Des déficiences aiguës dans les résultats des tests cognitifs sont souvent observées après un AVC et un nouveau test après plusieurs semaines révèle souvent des améliorations [10]. Par conséquent, il est recommandé de retarder le diagnostic définitif de DSP jusqu’à au moins six mois après l’événement.
Il convient en outre de noter que le terme “post-AVC” inclut non seulement les accidents vasculaires cérébraux et les accidents vasculaires cérébraux mineurs, mais aussi les accidents ischémiques transitoires (AIT), car de nouvelles preuves suggèrent que les AIT peuvent également être associés à un pronostic cognitif défavorable [13].
Tests de dépistage
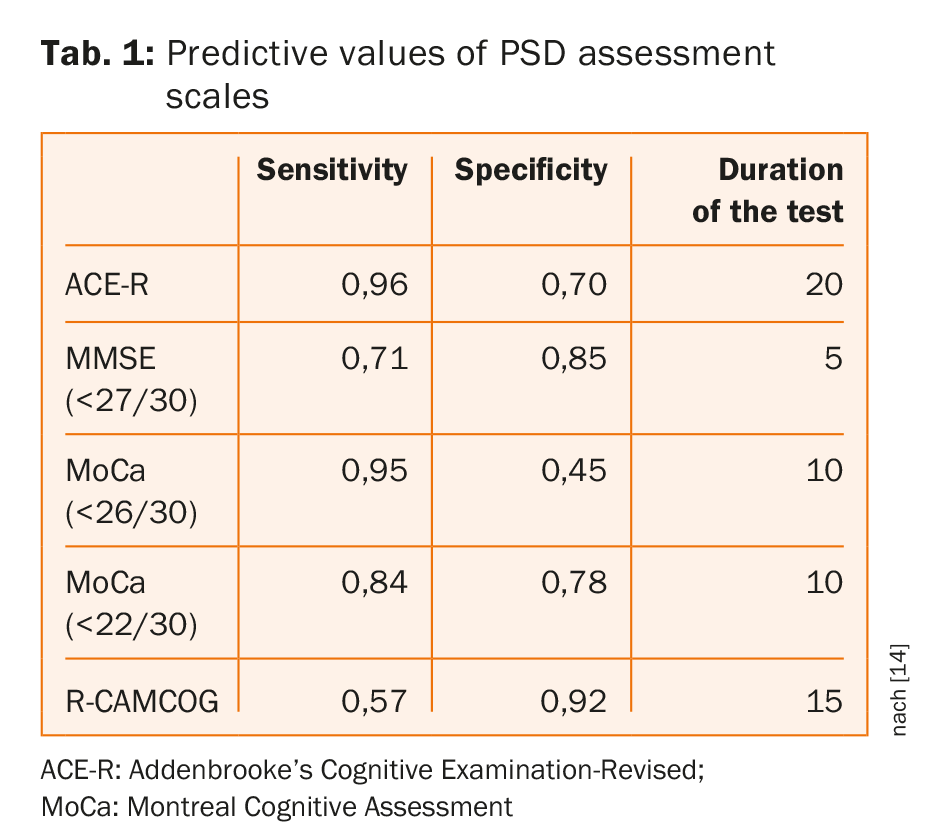
Les outils de dépistage cognitif couramment utilisés ont une précision similaire pour la détection de la démence/des déficiences multi-domaines, sans qu’il y ait de test clairement supérieur et sans qu’il soit prouvé que les outils de dépistage ayant un temps d’administration plus long donnent de meilleurs résultats [14]. Comme le montre le tableau 1, le MoCA au seuil habituel offre un temps d’évaluation court avec une sensibilité élevée mais au détriment de la spécificité ; des seuils adaptés ont amélioré la spécificité sans sacrifier la sensibilité [14].
Facteurs de risque de démence post-AVC
Les principaux facteurs de risque de démence post-AVC sont énumérés dans le tableau 2. En fait, ces paramètres agissent à des niveaux distincts, certains plutôt sur l’état pré-AVC et d’autres sur l’état post-AVC. Dans une revue systématique et une méta-analyse incluant 7511 patients, Pendlebury et ses collègues ont montré que l’atrophie du lobe temporal médian, le sexe féminin et des antécédents familiaux de démence étaient fortement associés à la démence pré-AVC, tandis que les caractéristiques et les complications de l’AVC et la présence de lésions multiples dans le temps et dans l’espace étaient plus fortement associées à la démence post-AVC [8].
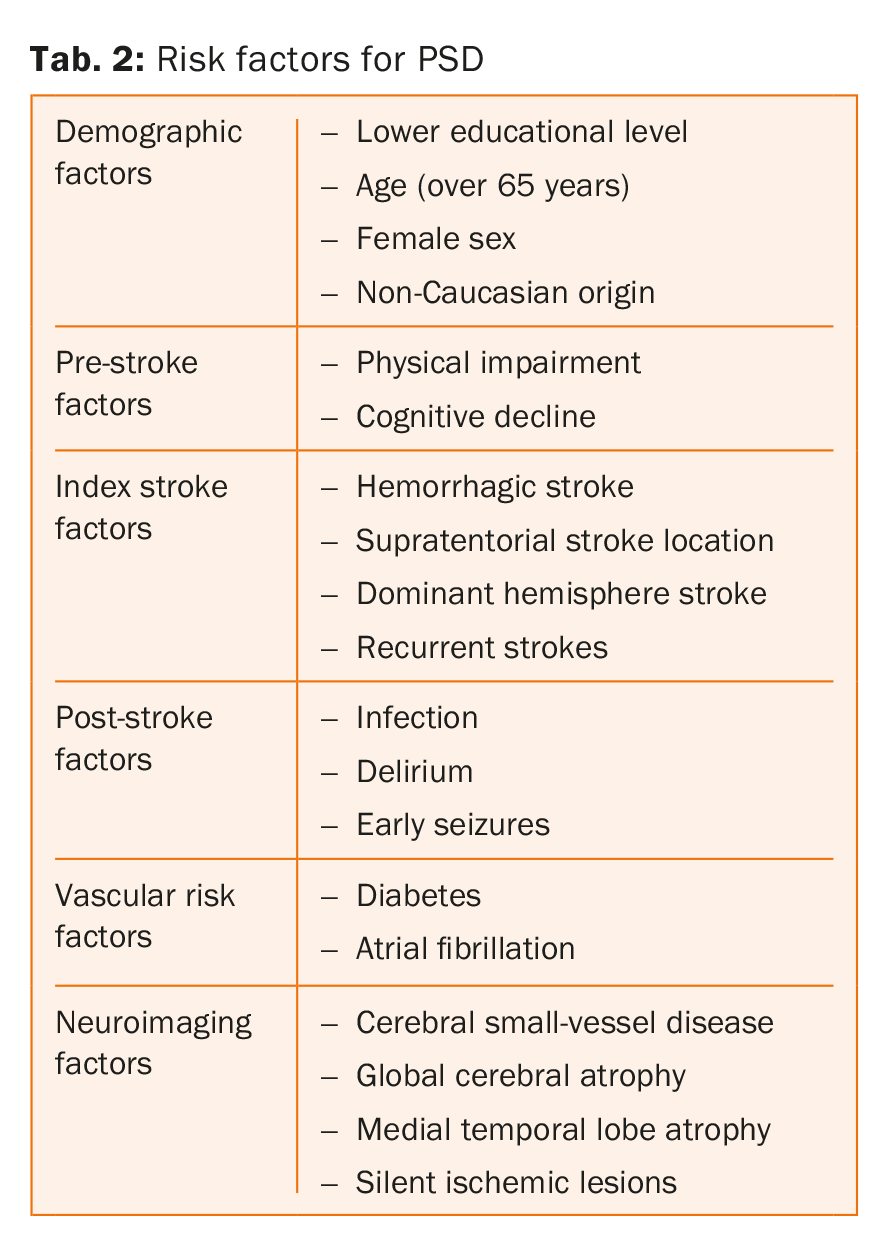
Il convient également de noter que les facteurs de risque vasculaires tels que le diabète et la fibrillation auriculaire sont associés à un risque accru de démence post-AVC indépendamment de la déficience cognitive pré-AVC, alors que cela n’a pas été constaté pour deux autres facteurs de risque bien établis, l’hypertension et le tabagisme [8,15-18]. Ce résultat est toutefois en contradiction avec les résultats d’autres études montrant que l’hypertension artérielle est un déterminant important des troubles cognitifs [19,20]. Enfin, il manque des preuves pour savoir si les facteurs de risque vasculaire liés au mode de vie, tels que l’inactivité physique et une alimentation malsaine, sont également des facteurs de risque indépendants de DSP [21].
Sous-types d’AVC
On pense généralement que les accidents vasculaires cérébraux lacunaires sont moins susceptibles d’affecter la cognition que les accidents vasculaires cérébraux corticaux plus graves et plus importants, cependant les accidents vasculaires cérébraux lacunaires sont généralement associés à une maladie des petits vaisseaux cérébraux, une cause fréquente de déficience cognitive et de démence, en particulier chez les personnes âgées [22]. Dans une méta-analyse récente, Makin et ses collègues ont comparé l’incidence des troubles cognitifs en fonction des différents sous-types d’AVC [23]. Les auteurs ont démontré que parmi 7575 patients, dont 2860 souffrant d’un AVC lacunaire, 24% présentaient une déficience cognitive légère (MCI) ou un PSD. La prévalence de la démence après un AVC lacunaire (six études, n=1421) était de 20 % (IC 95 % 9 à 33) et l’incidence du DCL ou de la démence (quatre études, n=275) était de 37 % (IC 95 % 23 à 53). Les auteurs ont conclu que les troubles cognitifs semblaient être fréquents après les accidents vasculaires cérébraux lacunaires, malgré leur petite taille, ce qui suggère que la MVD associée peut augmenter leur impact. Aucune différence significative concernant la prévalence des DSP entre les AVC lacunaires et non lacunaires n’a été observée.
Neuroimagerie
La neuro-imagerie est un outil de diagnostic important dans les DSP. L’imagerie par résonance magnétique (IRM) est la principale modalité de neuro-imagerie offrant une sensibilité et une spécificité élevées pour détecter les changements pathologiques, y compris les maladies des petits vaisseaux. Pour le diagnostic de la maladie des petits vaisseaux et du déclin cognitif post-AVC, l’IRM doit être utilisée avec plusieurs séquences. Des normes pour la neuro-imagerie sont recommandées avec une terminologie largement acceptée permettant la comparaison des résultats [26].
La tomographie par émission de positons (TEP) permet d’imager les perturbations métaboliques localisées et/ou diffuses responsables des troubles cognitifs et de la démence. Elle est efficace pour différencier la démence vasculaire de la démence dégénérative, telle que la maladie d’Alzheimer (métabolisme diminué dans les cortex temporo-mésial, temporo-pariétal et le cingulum postérieur, métabolisme préservé dans les cortex frontal et visuel, dans la région centrale et les ganglions de la base). Il peut également détecter les changements inflammatoires et leur interaction avec les dépôts amyloïdes pour le développement de démences mixtes après un AVC [27].
Prédicteurs d’imagerie
Certaines caractéristiques d’imagerie IRM ont une valeur prédictive concernant la survenue d’une DSP. Dans une étude récente, 294 patients atteints de MVD ont été évalués trois à cinq ans après la présentation initiale d’un AVC sous-cortical de type lacunaire [28]. Lors du suivi, une déficience cognitive vasculaire (DCV) de tout type a été détectée chez 188 (63,9%) des patients atteints de MCV, 65 (22,1%) répondant aux critères de la démence vasculaire. L’analyse de régression logistique multivariée ajustée en fonction de l’âge et du sexe a identifié la gravité globale des hyperintensités de la substance blanche (tARWMC HR 1,42, IC 95 % 1,01-2,00 ; p0,043) et le nombre total d’infarctus lacunaires (HR 3,06, IC 95 % 1,71-5,50, p < 0,001) comme des prédicteurs indépendants du déclin cognitif. Une autre étude a comparé la valeur pronostique de l’atrophie du lobe temporal médian et des caractéristiques de la MVS dans une cohorte de 234 patients ayant subi un AVC ou un AIT [29]. La relation entre les caractéristiques radiologiques suggestives de la maladie d’Alzheimer et de la MVD a été explorée et l’association de chacune de ces caractéristiques avec l’état cognitif à un an a été étudiée. Les caractéristiques du SVD étaient indépendamment associées à l’ATM (p<0,001). Après ajustement en fonction de l’âge, du sexe, du handicap après un AVC, de l’hypertension et du diabète sucré, l’atrophie temporale médiane était la seule caractéristique radiologique associée de manière indépendante à la déficience cognitive, définie à l’aide des seuils de mini état mental (MMSE) ≤26 (odds ratio 1,94 ; IC 95 %1,28-2,94) et MMSE ≤23 (odds ratio 2,31 ; IC 95 %1,48-3,62).
Biomarqueurs
Les biomarqueurs de la DSP peuvent inclure des médiateurs métaboliques, génétiques et inflammatoires. L’allèle e4 de l’apolipoprotéine E (APOE4) est un facteur de risque bien connu de la maladie d’Alzheimer [30,31). L’APOE4 est également associé aux maladies cardiovasculaires et aux infarctus du cerveau [31]. Des données contradictoires existent concernant l’association du polymorphisme de l’APOE4 avec la démence vasculaire et la PSD [32–35]. Le système rénine-angiotensine, via des effets à la fois métaboliques et vasculaires, serait impliqué dans la pathogenèse de la démence [36,37]. L’enzyme de conversion de l’angiotensine (ECA) est l’une des enzymes du système rénine-angiotensine. Les patients présentant le génotype ACE ont des taux élevés d’ACE dans le plasma et présentent un risque plus élevé de comorbidité cardiovasculaire [38–40]. Des études précédentes ont montré une association entre l’allèle ACE et le déclin cognitif. Cet effet peut être plus fort en présence de l’APOE4 [41,42]. Cependant, les études portant sur l’ECA en tant que facteur prédictif du déclin cognitif post-AVC se sont soldées par des données contradictoires [42,43]. Il a été suggéré que d’autres biomarqueurs, tels que l’enzyme sécrétase B (BACE1) et les niveaux de récepteurs des produits finaux de glycation avancée (sRAGE), sont en corrélation avec la déficience cognitive immédiatement après l’AVC (évaluée deux semaines après l’AVC) [39]. Les taux d’homocystéine, de vitamine B12 et d’acide folique étaient liés au déclin cognitif et aux accidents vasculaires cérébraux, et pourraient jouer un rôle dans la DSP. Cependant, dans l’essai VITATOPS, la supplémentation en vitamines B n’a eu aucun effet sur l’incidence des troubles cognitifs ou du déclin cognitif [44]. Un environnement inflammatoire excessif dans le cerveau pourrait aggraver les dommages post ischémiques. Par conséquent, les personnes présentant une réponse inflammatoire élevée à l’insulte ischémique peuvent être plus vulnérables à des dommages tissulaires supplémentaires et au développement de la DSP.
On sait que l’inflammation systémique et les marqueurs inflammatoires sont associés aux troubles cognitifs [45], en particulier à la démence dégénérative comme la maladie d’Alzheimer [46–48]. Des études longitudinales ont montré une corrélation entre une concentration initiale plus élevée d’interleukine 6 (IL-6) [48] et de protéine C-réactive (CRP) [49] et le déclin cognitif. Cependant, l’association entre l’inflammation et la DSP n’est pas encore établie. Plusieurs études récentes ont examiné la relation entre les marqueurs inflammatoires et les DSP. La vitesse de sédimentation des érythrocytes (ESR) [50], la CRP et l’IL-6 [51] ont été suggérés comme prédicteurs de la DSP.
Traitement pharmacologique et prévention
Il existe diverses interventions pharmacologiques pour la prévention du déclin cognitif post-AVC. L’abaissement de la pression artérielle à long terme après un AVC avec le périndopril a été associé à une réduction du déclin cognitif et à une tendance à moins de démence dans l’essai PROGRESS [52].
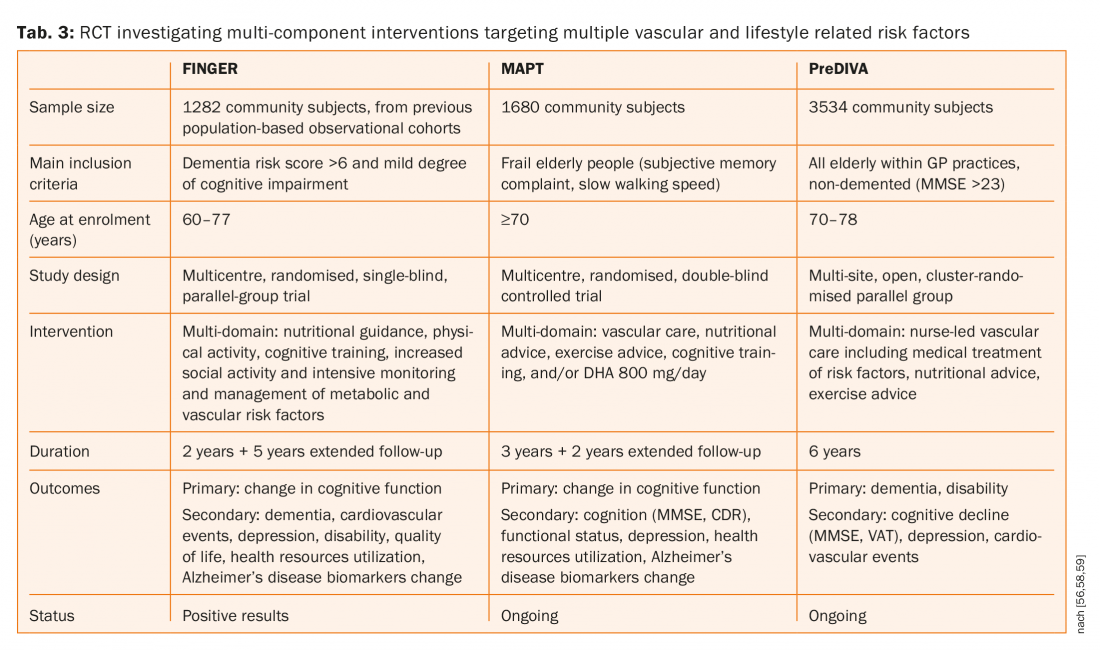
En outre, il a été démontré que les statines réduisent à la fois le premier accident vasculaire cérébral et les récidives, mais ni la simvastatine ni la pravastatine n’ont eu d’influence sur la cognition [53,54]. Trois grands essais contrôlés randomisés (FINGER, MAPT et preDIVA, onglet. 3) l’étude d’interventions à composantes multiples ciblant plusieurs facteurs de risque liés à la maladie vasculaire et au mode de vie par rapport à des conseils de santé généraux (groupe témoin) pour prévenir le déclin cognitif et la démence [55–58]. L’une de ces trois études (FINGER) a publié ses résultats et a suggéré qu’une intervention multi-domaine pourrait améliorer ou maintenir le fonctionnement cognitif chez les personnes âgées à risque [55,56]. Il y avait 1260 patients assignés au hasard au groupe d’intervention (n=631) ou au groupe de contrôle (n=629). 591 (94%) participants du groupe d’intervention et 599 (95%) du groupe de contrôle ont eu au moins une évaluation post-base et ont été inclus dans l’analyse modifiée en intention de traiter. Le changement moyen estimé du score de la batterie de tests neuropsychologiques à deux ans était de 0,20 dans le groupe d’intervention et de 0-16 dans le groupe de contrôle. La différence entre les groupes en ce qui concerne le changement du score total de la batterie de tests neuropsychologiques par an était de 0,022 (IC 95 % 0,002-0,042 ; p=0,030).
Conclusion
Une proportion importante de patients souffrira de démence ou de formes plus légères de détérioration cognitive après un AVC ou même un AIT. Un certain nombre de paramètres cliniques et radiologiques peuvent prédire la survenue d’une DSP. Bien que le risque soit réputé être le plus élevé dans la période suivant immédiatement l’AVC, il reste élevé même après plusieurs années. La présence de ce délai entre le moment de l’AVC et l’apparition de la démence permet en outre l’utilisation d’une fenêtre temporelle thérapeutique pour l’intervention. Des études pharmacologiques ont montré que l’abaissement à long terme de la pression artérielle après un accident vasculaire cérébral était associé à une réduction du déclin cognitif. Récemment, un vaste essai contrôlé randomisé a montré qu’une intervention multi-domaine pouvait améliorer ou maintenir le fonctionnement cognitif chez les personnes âgées à risque. Ces résultats suggèrent en outre l’influence positive d’interventions à composantes multiples ciblant plusieurs facteurs de risque liés à la maladie vasculaire et au mode de vie sur l’apparition de la démence post-AVC.
Take-Home-Messages
- Les survivants d’un AVC courent un risque accru de développer des troubles cognitifs.
- La démence post-AVC (DPS) est associée à plusieurs facteurs indiquant d’une part une réserve cognitive réduite, notamment le déclin cognitif pré-AVC, le handicap prémorbide, la maladie de la substance blanche et l’atrophie cérébrale, et d’autre part des aspects spécifiques de l’AVC.
- L’imagerie par résonance magnétique (IRM) est la principale modalité de neuro-imagerie.
- Bien qu’un grand nombre de biomarqueurs aient été proposés pour les DSP, aucun paramètre spécifique n’a encore été prouvé pour prédire de manière robuste les DSP.
- Des études pharmacologiques ont montré que l’abaissement à long terme de la pression artérielle après un accident vasculaire cérébral était associé à une réduction du déclin cognitif.
- Un vaste essai contrôlé randomisé a récemment suggéré qu’une intervention multi-domaine pourrait améliorer ou maintenir le fonctionnement cognitif chez les personnes âgées à risque.
Références :
- Strong K, Mathers C, et al : Prévenir les accidents vasculaires cérébraux : sauver des vies dans le monde entier. Lancet Neurol. 2007 ; 6 : 182-187.
- Lees R, Fearon P, Harrison JK, et al : Évaluation de la cognition et de l’humeur dans la recherche sur l’AVC : examen ciblé des études contemporaines. Accident vasculaire cérébral. 2012 ; 43 : 1678-1680.
- McKevitt C, Fudge N, et al : Self-reported long term needs after stroke. Accident vasculaire cérébral. 2011 ; 42 : 1398-1393.
- Pollock A, St George B, et al : Les dix principales priorités de recherche concernant la vie après un AVC. Lancet Neurol. 2012 ; 11 : 209.
- Fride Y, Adamit T, et al : Quels sont les corrélats de la cognition et de la participation à la reprise du travail après un premier AVC léger ? Top Stroke Rehabil. 2015;22(5) : 317-325.
- Ballard C, Rowan E, et al : Étude de suivi prospectif entre 3 et 15 mois après l’AVC : améliorations et déclin de la fonction cognitive chez les survivants d’AVC sans démence >75 ans. Stroke 2003 ; 34 : 2440-2444.
- Kalaria RN : Cerebrovascular disease and mechanisms of cognitive impairment : evidence from clinicopathological studies in humans.Stroke 2012 ; 43 : 2526-2534.
- Pendlebury ST, Rothwell PM : Prévalence, incidence et facteurs associés à la démence pré et post-AVC : une revue systématique et une méta-analyse. Lancet Neurol. 2009 ; 8 : 1006-1018.
- Pendlebury ST, Chen PJ, et al : Oxford Vascular Study. Facteurs méthodologiques dans la détermination du risque de démence après un accident ischémique transitoire et un accident vasculaire cérébral : (I) impact du biais de sélection de base. Accident vasculaire cérébral. 2015 ; 46 : 641-646.
- Henon H, Pasquier F, Leys D : La démence post-AVC. Cerebrovasc Dis 2006 ; 22 : 61-70.
- Mijajlović MD, Pavlović A, et al : La démence post-AVC – un examen complet. BMC Med. 2017 Jan 18 ; 15(1):11.
- Kokmen E, Whisnant JP, et al : Dementia after ischemic stroke : a population- based study in Rochester, Minnesota (1960-1984). Neurologie 1996 ; 46 : 154-159.
- Van Rooij FG, Kessels RP, et al : Cognitive impairment in transient ischemic attack patients : a systematic review. Cerebrovasc Dis. 2016 ; 42(1-2) : 1-9.
- Lees R, Selvarajah J et al. : Précision des tests de dépistage cognitif pour le diagnostic de la démence et de la déficience cognitive multidomaine dans l’AVC. Accident vasculaire cérébral. 2014 Oct ; 45(10) : 3008-3018.
- Gottesman RF, Hillis AE : Prédicteurs et évaluation de la dysfonction cognitive résultant d’un AVC ischémique. Lancet Neurol 2010 ; 9 : 895-905.
- Pasquier F, Hénon H, Leys D : Facteurs de risque et mécanismes de la démence post-AVC. Rev Neurol. 1999 ; 155(9) : 749-753.
- Chaudhari TS, Verma R, et al : Clinico-radiological predictors of vascular cognitive impairment (VCI) in patients with stroke : a prospective observational study. J Neurol Sci. 15 mai 2014 ; 340(1-2) : 150-158.
- Arba F, Quinn T, et al : Collaboration VISTA. Déterminants de la déficience cognitive post-AVC : analyse de VISTA. Acta Neurol Scand. 2017 Jun ; 135(6) : 603-607.
- Iulita MF, Girouard H : Traiter l’hypertension pour prévenir le déclin cognitif et la démence : Ré-ouvrir le débat. Adv Exp Med Biol. 2017 ; 956 : 447-473.
- Kalaria RN : Facteurs de risque et mécanismes neurodégénératifs dans la démence liée à un AVC. Panminerva Med. 2012 Sep ; 54(3):139-148.
- Teuschl Y, Matz K, Brainin M : Prevention of post-stroke cognitive decline : a review focusing on lifestyle interventions. Eur J Neurol. 2013 Jan ; 20(1) : 35-49.
- Wardlaw JM, Smith EE, et al : Normes de neuro-imagerie pour la recherche sur les maladies des petits vaisseaux et leur contribution au vieillissement et à la neurodégénération. Lancet Neurol 2013 ; 12 : 822-838.
- Makin SD, Turpin S, et al : Cognitive impairment after lacunar stroke : systematic review and meta-analysis of incidence, prevalence and comparison with other stroke subtypes. J Neurol Neurosurg Psychiatry. 2013 Août ; 84(8) : 893-900.
- Schmidt R, Ropele S, et al : Imagerie pondérée par diffusion et cognition dans l’étude sur la leucose et le handicap chez les personnes âgées. Stroke 2010 ; 41 : e402-e408.
- Blair GW, Hernandez MV, et al : Neuroimagerie avancée de la maladie des petits vaisseaux cérébraux. Curr Treat Options Cardiovasc Med. 2017 Jul ; 19(7) : 56.
- Wardlaw JM, Smith EE, et al : Normes de neuro-imagerie pour la recherche sur les maladies des petits vaisseaux et leur contribution au vieillissement et à la neurodégénération. Lancet Neurol. 2013 ; 12 : 822-838.
- Heiss W-D, Zimmermann-Meinzingen S : L’imagerie TEP dans le diagnostic différentiel de la démence vasculaire. J Neurol Sci 2012 ; 322 : 268-273.
- Pavlovic AM, Pekmezovic T, et al : Baseline predictors of cognitive decline in patients with cerebral small vessel disease. J Alzheimers Dis. 2014 ; 42 Suppl 3 : 37-43.
- Arba F, Quinn T, et al : VISTA. Collaboration.maladie des petits vaisseaux cérébraux, atrophie du lobe temporal médian et état cognitif chez les patients ayant subi un accident vasculaire cérébral ischémique et un accident ischémique transitoire. Eur J Neurol. 2017 Feb ; 24(2) : 276-282.
- Bu G : L’apolipoprotéine E et ses récepteurs dans la maladie d’Alzheimer : voies, pathogenèse et thérapie. Nat Rev Neurosci 2009 ; 10 : 333-344.
- Davidson Y, Gibbons L et al : Fréquence de l’allèle epsilon4 de l’apolipoprotéine E dans la démence vasculaire. Dement Geriatr Cogn Disord 2006 ; 22 : 15-19.
- Hsiung G-YR, Sadovnick AD, Feldman H : Le génotype de l’apolipoprotéine E epsilon4 comme facteur de risque de déclin cognitif et de démence : données de l’Étude canadienne sur la santé et le vieillissement. CMAJ 2004 ; 171 : 863-867.
- Mortimer JA, Snowdon DA, Markesbery WR : L’effet de l’APOE-epsilon4 sur la démence est médié par la neuropathologie de l’Alzheimer. Alzheimer Dis Assoc Disord 2009 ; 23 : 152-157.
- Rippon GA, Tang MX, et al : Familial Alzheimer disease in Latinos : interaction between APOE, stroke, and estrogen replacement. Neurology 2006 ; 66 : 35-40.
- Jin YP, Østbye T, et al : Effet conjoint de l’AVC et de l’APOE 4 sur le risque de démence : l’Étude canadienne sur la santé et le vieillissement. Neurologie 2008 ; 70 : 9-16.
- Qian L, Ding L, et al : Biomarqueurs précoces de troubles cognitifs post-AVC. J Neurol 2012 ; 259 : 2111-2118.
- Kolsch H, Jessen F, et al : Le polymorphisme ACE I/D est un facteur de risque de la maladie d’Alzheimer mais pas de la démence vasculaire. Neurosci Lett 2005 ; 377 : 37-39.
- Hassan A, Lansbury A, et al : Le génotype d’insertion/délétion de l’enzyme de conversion de l’angiotensine est associé à la leucoaraïose dans les syndromes lacunaires. J Neurol Neurosurg Psychiatry 2002 ; 72 : 343-346.
- Szolnoki Z, Maasz A, et al : La coexistence du récepteur de l’angiotensine II de type 1 A1166C et du polymorphisme de l’enzyme de conversion de l’angiotensine D/D suggère une susceptibilité aux accidents vasculaires cérébraux ischémiques associés aux petits vaisseaux. Neuromolecular Med 2006 ; 8 : 353-360.
- Bartres-Faz D, Junque C, et al : Polymorphisme de l’enzyme de conversion de l’angiotensine II chez les humains présentant des troubles de la mémoire associés à l’âge : relation avec la performance cognitive. Neurosci Lett 2000 ; 290 : 177-180.
- Richard F, Berr C, et al : Effet du polymorphisme I/D de l’enzyme de conversion de l’angiotensine I sur le déclin cognitif. Le groupe d’étude EVA. Neurobiol Aging 2000 ; 21 : 75-80.
- Bour AMJ, Rasquin SMC, et al : L’effet de l’allèle APOE-epsilon4 et du polymorphisme ACE-I/D sur la cognition au cours d’un suivi de deux ans chez des patients ayant subi un premier AVC. Dement Geriatr Cogn Disord 2010 ; 29 : 534-542.
- Bour AMJJ, Rasquin SMC, et al : L’effet de l’allèle APOE-epsilon4 et du polymorphisme ACE-I/D sur la cognition au cours d’un suivi de deux ans chez des patients ayant subi un premier AVC. Dement Geriatr Cogn Disord 2010 ; 29 : 534-542.
- Baum L, Chen X, et al : Polymorphismes et troubles cognitifs vasculaires après un accident ischémique cérébral. J Geriatr Psychiatry Neurol 2007 ; 20 : 93-99.
- Hankey GJ, Ford AH et al : Effect of B vitamins and lowering homocysteine on cognitive impairment in patients with previous stroke or transient ischemic attack : a prespecified secondary analysis of a randomised, placebo-controlled trial and meta-analysis. Stroke 2013 ; 44 : 2232-2239.
- Karlsson H, Ahlborg B, et al : Association entre la vitesse de sédimentation des érythrocytes et le QI chez les hommes suédois âgés de 18 à 20 ans. Brain Behav Immun 2010 ; 24 : 868-873.
- Craft S : Le rôle des troubles métaboliques dans la maladie d’Alzheimer et la démence vasculaire : deux routes convergent. Arch Neurol 2009 ; 66 : 300-305.
- Eikelenboom P, van Exel E, et al : La neuroinflammation – un événement précoce dans l’histoire et la pathogenèse de la maladie d’Alzheimer. Neurodegener Dis 2010 ; 7 : 38-41.
- Schram MT, Euser SM et al : Marqueurs systémiques d’inflammation et déclin cognitif dans la vieillesse. J Am Geriatr Soc 2007 ; 55 : 708-716.
- Hoth KF, Haley AP, et al : Elevated C-reactive protein is related to cognitive decline in older adults with cardiovascular disease. J Am Geriatr Soc 2008 ; 56 : 1898-1903.
- Kliper E, Bashat DB et al : Le déclin cognitif après un accident vasculaire cérébral : relation avec les biomarqueurs inflammatoires et le volume de l’hippocampe. Stroke 2013 ; 44 : 1433-1435.
- Rothenburg LS, Herrmann N, et al : La relation entre les marqueurs inflammatoires et les troubles cognitifs post-AVC. J Geriatr Psychiatry Neurol 2010 ; 23 : 199-205.
- Tzourio C, Anderson C, et al : Effets de l’abaissement de la pression artérielle par un traitement au périndopril et à l’indapamide sur la démence et le déclin cognitif chez les patients atteints de maladies cérébrovasculaires. Arch Intern Med 2003 ; 163 : 1069-1075.
- Collins R, Armitage J : Groupe collaboratif de l’étude sur la protection du cœur. Effets de la réduction du taux de cholestérol par la simvastatine sur les accidents vasculaires cérébraux et autres événements vasculaires majeurs chez 20536 personnes atteintes d’une maladie cérébrovasculaire ou d’autres conditions à haut risque. Lancet 2004 ; 363 : 757-767.
- Shepherd J, Blauw GJ, et al : Pravastatin in elderly individuals at risk of vascular disease (PROSPER) : a randomised controlled trial. Lancet 2002 ; 360 : 1623-1630.
- Kivipelto M, Solomon A, et al : The Finnish Geriatric Intervention Study to Prevent Cognitive Impairment and Disability (FINGER) : study design and progress. Alzheimers Dement 2013 ; 9 : 657-665.
- Ngandu T, Lehtisalo J, et al : A 2 year multidomain intervention of diet, exercise, cognitive training, and vascular risk monitoring versus control to prevent cognitive decline in at-risk elderly people (FINGER) : a randomised controlled trial. Lancet. 2015 Jun 6 ; 385(9984) : 2255-2263.
- Carrie I, van Kan GA, et al : Stratégies de recrutement pour les essais préventifs. L’étude MAPT (MultiDomain Alzheimer Preventive Trial). J Nutr Health Aging 2012 ; 16 : 355-359.
- Richard E, Van den Heuvel E, et al : Prevention of dementia by intensive vascular care (PreDIVA) : a cluster-randomised trial in progress. Alzheimer Dis Assoc Disord 2009 ; 23 : 198-204.
InFo NEUROLOGIE & PSYCHIATRIE 2018 ; 16(1) : 31-37