En raison du vieillissement de la population et de l’amélioration des soins médicaux, le nombre de patients ayant recours à une procédure de remplacement rénal a augmenté ces dernières années. Fin 2015, environ 4100 patients bénéficiaient d’un programme de dialyse, 423 d’une dialyse à domicile (dialyse péritonéale pour la plupart) [1], le reste d’une hémodialyse en centre. Par ailleurs, environ 5000 patients vivent en Suisse avec un greffon fonctionnel. De nombreuses spécialités médicales sont impliquées dans la prise en charge des patients souffrant d’insuffisance rénale chronique. Au stade MRC 1-3, le médecin généraliste est au premier plan de la prise en charge, alors qu’au stade MRC 4+5 (patients dialysés), la prise en charge relève plutôt du néphrologue (Fig. 1). Si la fonction rénale <30% (DFG <30 ml/min.), il convient d’adresser le patient à un néphrologue afin qu’il soit soigneusement préparé à une procédure de remplacement rénal [2].
En général, le début de la dialyse chronique se fait lorsque le DFG est compris entre 8 et 12 ml/min., la décision de commencer n’étant pas uniquement basée sur les résultats de laboratoire [3]. Chez les patients asymptomatiques, l’indication de commencer la dialyse peut être posée avec retenue [4]. Une indication absolue est une hyperkaliémie non contrôlable par des mesures conservatrices, une hypervolémie non contrôlable par des diurétiques (notamment en cas de syndrome cardiorénal). En cas de bonne coopération entre le néphrologue, le médecin généraliste et le patient, le tableau clinique d’une péricardite urémique ou d’une encéphalopathie urémique ne devrait pas se présenter ; ces deux états cliniques constitueraient une indication d’urgence pour le début de la dialyse.
Dialyse péritonéale [5]
- DPCA = dialyse péritonéale continue ambulatoire
- DPA = dialyse péritonéale automatisée
La dialyse péritonéale n’a pas de place en tant que méthode de dialyse aiguë chez l’adulte. En revanche, la procédure est bien établie pour l’insuffisance rénale chronique nécessitant une dialyse. En Suisse, la proportion de patients en dialyse péritonéale a augmenté ces dernières années (10-12%). Il n’existe pas d’études prospectives randomisées comparant directement la mortalité et la morbidité entre la DP et l’HD, mais les procédures semblent équivalentes, du moins pendant les premières années du traitement de substitution rénale. En cas d’insuffisance cardiaque sévère (et d’instabilité circulatoire pendant l’HD) et en l’absence de possibilités d’accès à un vaisseau d’hémodialyse, la DP est préférable. L’APD nocturne est une bonne alternative à l’hémodialyse en centre, en particulier pour les jeunes patients qui travaillent.
La figure 2 illustre les aspects techniques : la DP est réalisée via un cathéter de dialyse intrapéritonéal, généralement mis en place par voie laparoscopique. La procédure utilise le péritoine comme membrane semi-perméable pour éliminer les métabolites par diffusion et osmose. Dans le cas de la dialyse péritonéale, la compliance du patient est très essentielle, car c’est lui qui suit le traitement. Il est entraîné et surveillé par un personnel infirmier spécialisé et, si l’évolution est stable, des contrôles et des consultations néphrologiques ont lieu toutes les 4 à 6 semaines.
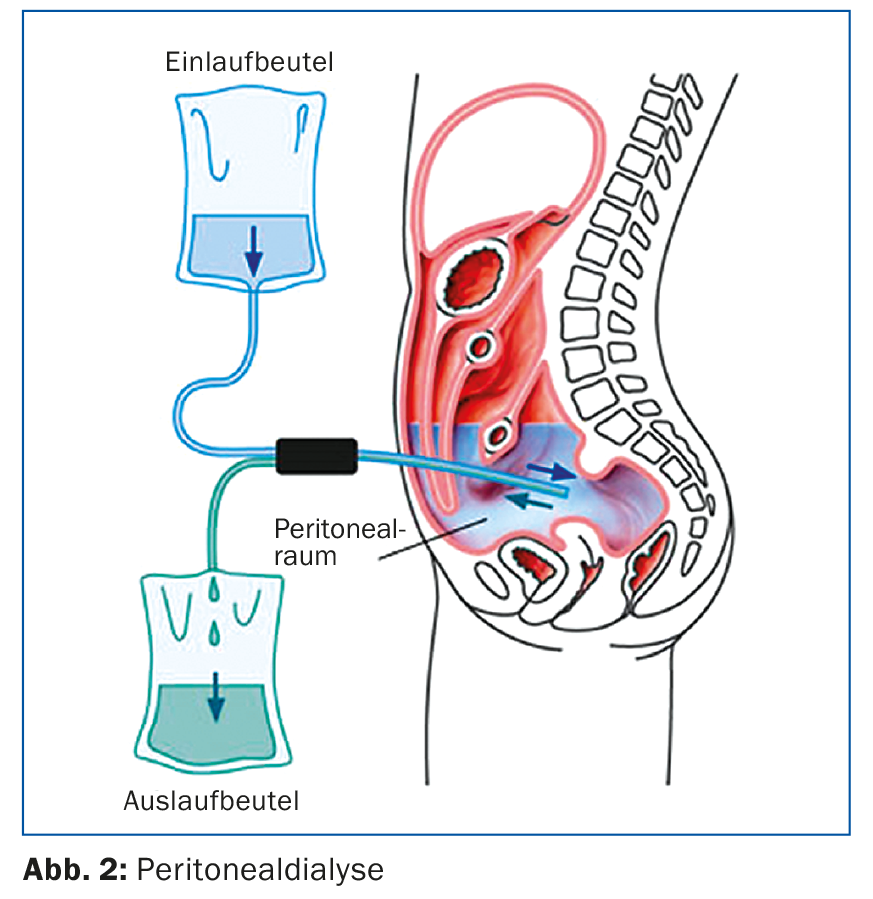
L’un des avantages possibles de la dialyse péritonéale par rapport à l’hémodialyse est que la fonction résiduelle, c’est-à-dire la quantité de sang qui reste dans le sang, peut être réduite. diurèse résiduelle est maintenue plus longtemps. Pour cette raison, il est important de réaliser le moins d’examens radiologiques possible avec un produit de contraste iodé. Il convient également d’éviter les anti-inflammatoires non stéroïdiens afin de préserver la fonction résiduelle, essentielle pour la dialyse péritonéale. En cas de complications de la dialyse péritonéale, c’est généralement le centre de néphrologie qui est compétent, en particulier en cas de problèmes de cathéter tels que la dislocation ou les fuites du cathéter. Avec les systèmes de dialyse péritonéale actuels, les péritonites sont rares, mais elles restent dangereuses [5]. En cas d’apparition d’un dialysat trouble ou de douleurs abdominales, il convient d’examiner le dialysat en urgence et de commencer un traitement antibiotique (généralement par voie intrapéritonéale, les hospitalisations peuvent souvent être évitées).
Hémodialyse
Pour la plupart des patients, l’hémodialyse est effectuée dans un centre de dialyse (dialyse en centre), seuls quelques patients effectuent la dialyse à domicile (hémodialyse à domicile). Un seul traitement d’hémodialyse dure entre 3,5 et 4,5 heures, en fonction de la fonction résiduelle et d’autres facteurs individuels. Trois séances d’hémodialyse sont généralement effectuées chaque semaine. Dans la plupart des centres, il est techniquement possible d’effectuer ce que l’on appelle une hémodiafiltration (désintoxication par combinaison de l’hémodialyse et de l’hémofiltration). Pour que la dialyse soit efficace, il faut un accès vasculaire [6] qui permette un débit sanguin suffisant (>300 ml/min.) est autorisé. L’accès vasculaire est toujours considéré comme le “pied de nez de la dialyse” en raison de divers problèmes techniques. Les différentes possibilités sont illustrées dans la figure 3 : si aucun shunt n’est disponible au début de la dialyse, la procédure se fait par un cathéter auriculaire tunnellisé par voie sous-cutanée. L’avantage est que la dialyse peut être commencée immédiatement. Le cathéter auriculaire peut également constituer le premier choix d’accès vasculaire, en particulier chez les patients âgés et les patients présentant de très mauvaises conditions vasculaires périphériques ainsi qu’une insuffisance cardiaque sévère. Après chaque dialyse, les volumes des cathéters sont bloqués avec une solution spéciale (par exemple, Liquemin ou solution de citrate). La manipulation des cathéters de dialyse de longue durée ne doit être effectuée que par un personnel de dialyse formé, sans quoi les complications telles que le dysfonctionnement du cathéter ou les infections du cathéter sont inévitables [7].
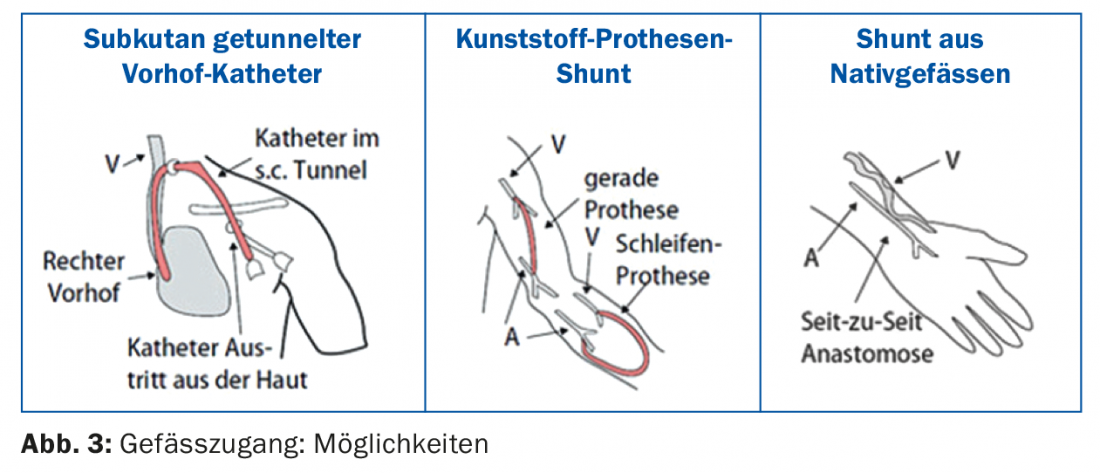
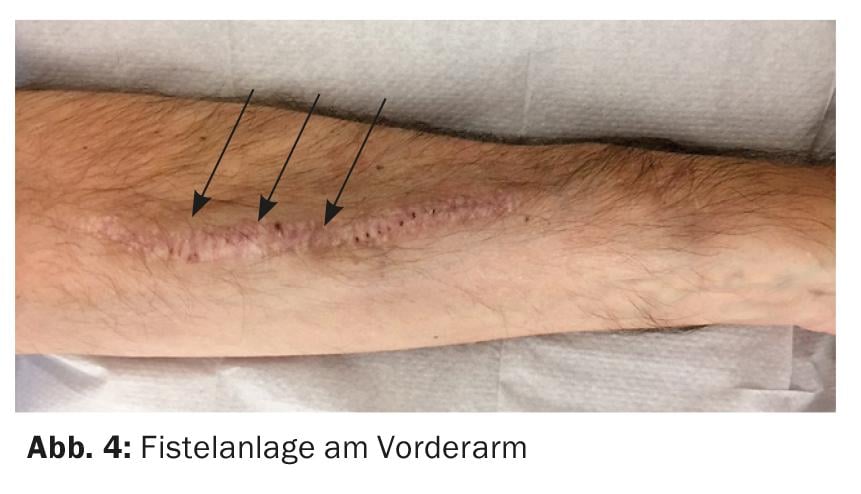
Le meilleur accès vasculaire reste une fistule artério-veineuse (AV) native. Il est préférable de créer la fistule sur l’avant-bras non dominant (Fig. 4). Une alternative consiste à utiliser la veine céphalique du bras, mais si le diamètre du vaisseau est important, il y a un risque de shunt hyperdynamique avec un risque de stress cardiaque.
L’alternative à une fistule native est un shunt prothétique en plastique, par exemple sous la forme d’une prothèse à anse sur l’avant-bras. Il est important de noter que le bras avec un shunt de dialyse fonctionnel ne doit être utilisé que comme accès vasculaire pour la dialyse, les prises de sang ou les canules à demeure doivent être évitées.
Aspects diététiques
Les aspects diététiques doivent être pris en compte tant pour la DP que pour la HD. Au cours du traitement par dialyse, il faut s’attendre à une diminution de la fonction résiduelle et, parallèlement, la restriction en potassium, phosphate, sel et liquides devient plus importante. Pour les deux procédures, le principe concernant l’apport en liquide est le suivant : diurèse résiduelle + 800 ml par jour, apport en sel de cuisine 4-6 g par jour. En particulier chez le patient hémodialysé, la restriction nutritionnelle en potassium est nécessaire (tableau 1) ainsi que l’utilisation d’échangeurs de catéchol (p.ex. sulfonate de polystérol, résonium A). Les médicaments qui augmentent le potassium sérique (inhibiteurs de l’ECA, bloqueurs de l’angiotensine II) doivent être utilisés avec précaution, la spirolonactone et le Bactrim à forte dose ne doivent pas être utilisés.

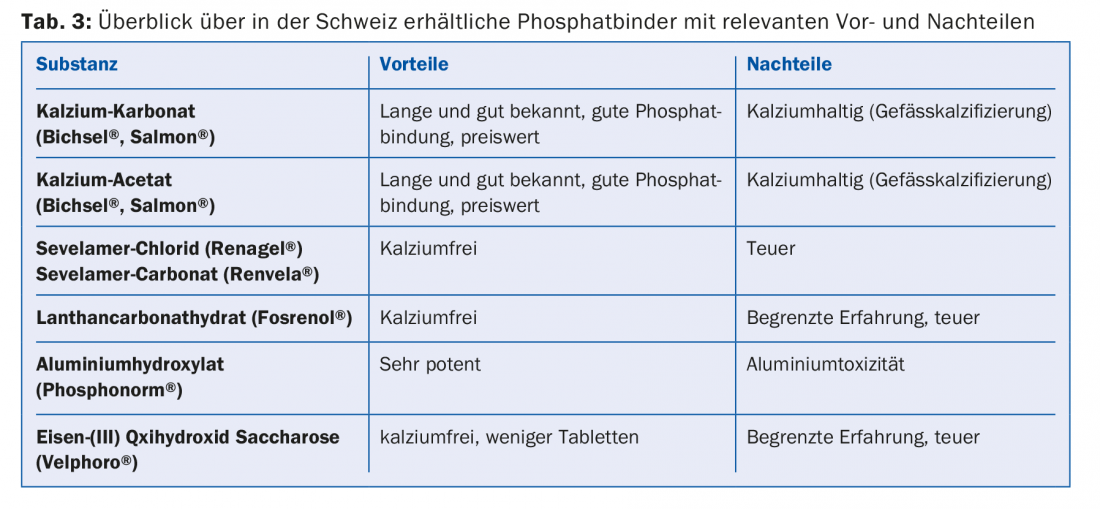
L’hyperphosphatémie est un autre problème, car la dialyse ne permet d’éliminer qu’une partie du phosphate absorbé. Une hyperphosphatémie persistante s’accompagne d’une calcification croissante des vaisseaux [9], de sorte que les patients dialysés depuis longtemps souffrent souvent d’une artériosclérose sévère généralisée. Parallèlement, l’hyperphosphatémie favorise l’hyperparathyroïdie secondaire rénale [8]. Pour ces raisons, il est nécessaire d’une part de suivre un régime pauvre en phosphates (aliments contenant des phosphates, tab. 2) avec la prise simultanée d’un chélateur de phosphates. Parmi ceux-ci, nous distinguons les adsorbants de phosphate contenant du calcium et les adsorbants de phosphate sans calcium, qui se différencient par leur puissance d’action, leur profil d’effets secondaires et leurs interactions (tab. 3).

Aspects pharmacologiques
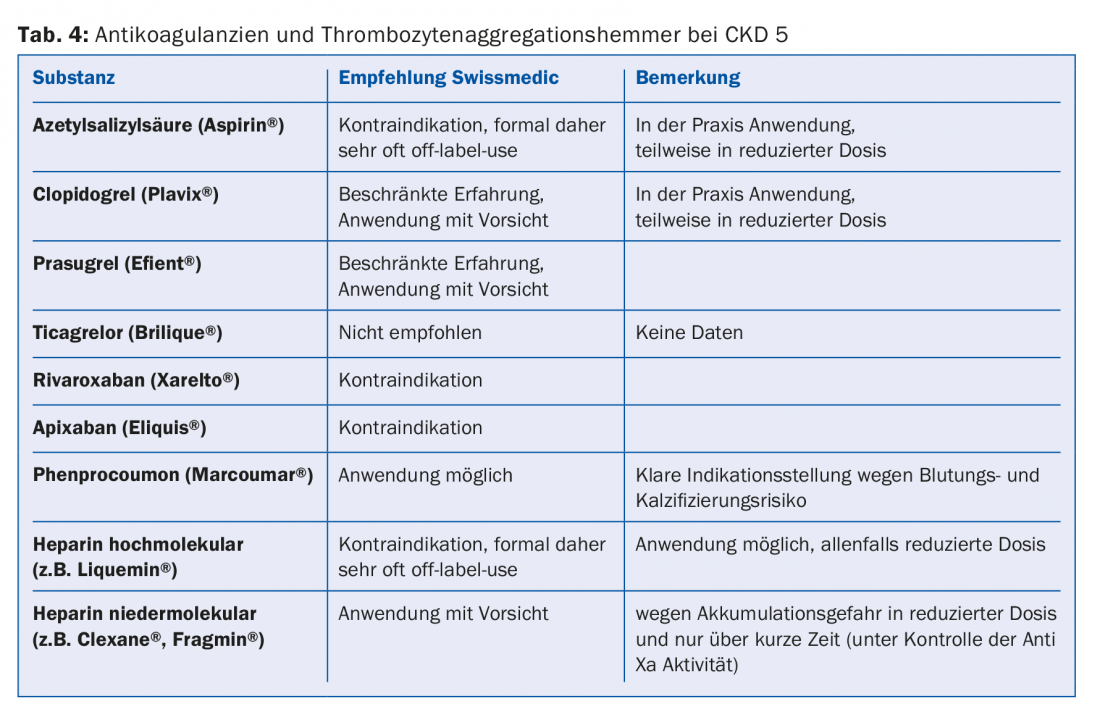
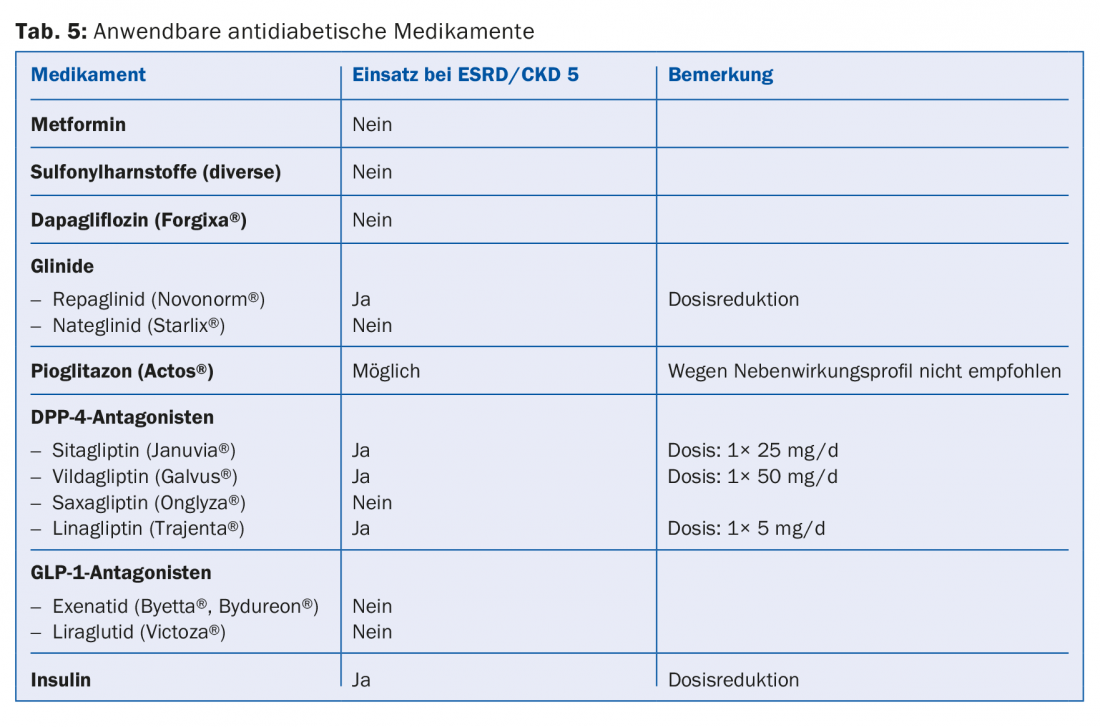
Une grande partie des médicaments ou des leurs métabolites sont éliminés par voie rénale. Par conséquent, les contre-indications absolues et relatives doivent être adaptées conformément aux directives (p. ex. Compendium). C’est notamment le cas de la plupart des antibiotiques, des anticoagulants et des antiplaquettaires (tableau 4). Comme 30 à 40% des patients dialysés souffrent de diabète, il est important d’éviter complètement certains médicaments antidiabétiques (p.ex. metformine, sulfonylurées) ou d’en réduire la dose (p.ex. sitagliptine, vildagliptine, etc.) (tab. 5) [10]. En ce qui concerne le traitement de la douleur, les anti-inflammatoires non stéroïdiens ne doivent être administrés que pendant une courte période (risque d’hyperkaliémie, réduction de la diurèse résiduelle, troubles supplémentaires de l’agrégation plaquettaire). Les préparations à base de paracétamol (jusqu’à 3 g/jour) et le métamizole sont considérés comme relativement sûrs. Les opiacés doivent être introduits à faible dose, en tenant compte là aussi de l’accumulation des métabolites. Les préparations à base de buprénorphine ou de fentanyl sont bien adaptées à cet effet (en règle générale, lorsque le DFG est <15 ml/min. Division de la dose par deux [11]. Les préparations à base de codéine sont moins appropriées (risque d’accumulation et potentiel d’interaction). De même, le tramadol ne doit être administré qu’à faible dose. La péthidine est contre-indiquée (risque de convulsions).
Importance des soins de médecine générale
Pour les patients hémodialysés, qui sont visités trois fois par semaine, le néphrologue est souvent aussi le médecin de famille. Pour les patients qui sont plus éloignés du centre de dialyse ou qui vivent dans une institution de soins, le médecin de famille conserve une place importante. C’est également le cas pour les patients sous DPCA, qui ne sont vus au centre de dialyse que tous les 1 à 2 mois.
Le médecin généraliste est également important en tant que personne de confiance lorsqu’un patient âgé, dont la qualité de vie diminue, décide d’interrompre son traitement par dialyse. L’arrêt actif de la dialyse est responsable de près de 20% des décès annuels chez les patients bénéficiant d’un traitement de suppléance rénale. Le médecin généraliste, qui connaît le patient depuis des années, est en mesure de juger s’il s’agit d’un bilan de vie ou, le cas échéant, d’une dépression (qui peut être traitée). Celle-ci doit être abordée par voie médicamenteuse avant de prendre la décision importante d’interrompre le traitement par dialyse.
Littérature :
- Fédération suisse pour tâches communes en matière d’assurance maladie (SVK) : www.svk.org/assets/uploads.
- Elsässer H, et al. : Planification d’une procédure de remplacement rénal : que faut-il savoir ? Forum Med Suisse 2008 ; 8 : 70-74.
- Kleophas W : Quel est le bon moment pour commencer une thérapie de remplacement rénal ? Néphrologue 2012 ; 7 : 96-103.
- Cooper BA, et al : A randomized, controlled trail of early versus late inittiation of dialysis. N Engl J Med 2010 ; 363 : 609-619.
- Kribben A, et al. : Place, indications et limites de la dialyse péritonéale. Nephrologue 2007 ; 2 : 74-81.
- KDOQI. Lignes directrices de pratique clinique pour l’accès vasculaire. Am J Kidney Dis 2006 ; 48 : 176-247.
- Alerte rapide : “Utilisation non conforme des cathéters de dialyse” ; en cours (Sécurité des patients Suisse).
- CKD-MBD Work Group Kidney disease : improving global outcomes (KDIGO). KDIGO clinical practice guidelines for the diagnosis, evaluation, prevention, and treatment of chronic kidney disease-mineral and bone disorder (CKD-MBD), Kidney Int 2009 ; 76(Suppl) : 1-130.
- Herzog CA, et al : Cardiovascular disease in chronic kidney disease. A clinical update form Kidney Disease ; Improving Global Outcomes (KDIGO. Kidney Int 2011 ; 80 : 572-586.
- Zanchi A, et al : Insuffisance rénale et diabète, anticiper. Forum Med Suisse 2014 ; 14(6) : 100-104.
- Liechti ME : Pharmacologie des analgésiques pour la pratique, Partie 2 : Opioïdes. Forum Med Suisse 2014 ; 14 : 460-464.
PRATIQUE DU MÉDECIN DE FAMILLE 2016 ; 11(10) : 32-38