En raison de sa fonction protectrice particulière pour le corps, la peau constitue une exception dans le processus de vieillissement : En tant que frontière mécanique et biologique entre les organes internes et l’environnement, la peau est en outre exposée quotidiennement à une multitude d’agressions exogènes, non seulement uniques et directes (blessures), mais aussi répétitives et à forte latence. C’est pourquoi on distingue le vieillissement intrinsèque et le vieillissement extrinsèque de la peau.
On parle souvent de vieillissement chronologique ou génétique pour le vieillissement intrinsèque, de vieillissement exogène ou prématuré pour le vieillissement extrinsèque et de photovieillissement si la lumière ultraviolette est la toxine exogène. Morphologiquement, le vieillissement intrinsèque de la peau ne peut pas toujours être séparé nettement du vieillissement extrinsèque. Les deux processus sont parallèles et le vieillissement extrinsèque de la peau peut se superposer au vieillissement intrinsèque dans différentes parties du corps, à des degrés divers.
Étant donné que les mécanismes sous-jacents au vieillissement intrinsèque et extrinsèque sont similaires et que les caractéristiques biochimiques, morphologiques et cliniques du vieillissement cutané peuvent être directement déduites des mécanismes pathologiques, nous allons d’abord présenter quelques aspects spécifiques. Certains facteurs extrinsèques sont examinés séparément.
L’importance des espèces réactives de l’oxygène [1, 2]
Les espèces réactives de l’oxygène (“reactive oxygen species”, ROS) jouent un rôle central dans le vieillissement de la peau. Selon la théorie des radicaux libres du vieillissement formulée par Harman [1], la formation de telles molécules est continue au cours de la vie. Cela se produit en particulier dans les tissus à forte consommation d’oxygène, comme le cerveau, les muscles et le foie.
Au niveau cellulaire, les mitochondries sont le lieu où le turnover des ROS est le plus élevé. Dans le cadre de la production d’énergie par la chaîne respiratoire, du H2O2 est produit au niveau de la membrane mitochondriale interne. Celui-ci est également produit dans le cadre du photovieillissement, où il est généré par des superoxydes dismutases à partir d’anions superoxydes. Un grand nombre d’études ont montré que, dans le cadre du vieillissement extrinsèque, H2O2 et l’oxygène singlet constituent les principaux ROS induits par les UVA. Les radicaux hydroxyles, en revanche, sont produits dans le cadre de la réaction physiologique de Fenton avec H2O2 et constituent les principaux radicaux d’oxygène lors du vieillissement extrinsèque de la peau dans le cadre de l’exposition aux UVB.
Les ROS jouent donc un rôle central dans le vieillissement intrinsèque et extrinsèque de la peau.
Au cours de l’évolution, l’organisme a développé plusieurs mécanismes de défense contre les ROS. Il s’agit notamment de la catalase, du cytochrome p450, du glutathion, etc. Lorsque la capacité des systèmes de l’organisme à neutraliser les ROS est dépassée, ces molécules hautement réactives peuvent réagir avec différents composants de la cellule et les endommager. Par exemple, les macromolécules cellulaires telles que l’ADN, les protéines et les lipoprotéines peuvent être directement endommagées. La surcharge des mécanismes de défense de l’organisme par la formation continue de ROS entraîne des mutations génétiques et projette le vieillissement de la peau.
S’appuyant sur la théorie des radicaux libres du vieillissement, une grande partie de la population – notamment caucasienne – tente aujourd’hui de limiter, voire d’empêcher la formation de ROS par voie systémique en prenant des compléments alimentaires et par voie topique en appliquant des produits contenant des antioxydants naturels et synthétiques. Malheureusement, il s’est avéré que les expériences de Harman ne pouvaient pas être entièrement reproduites et qu’en fonction du dispositif expérimental, une présence accrue de ROS chez les vers et les souris pouvait même entraîner un allongement de la durée de vie [3]. Il est postulé que les ROS mettent en place un réseau de réparation cellulaire. On pense même aujourd’hui que l’apport de doses élevées d’antioxydants sous forme de vitamines et d’autres compléments alimentaires peut être inefficace, voire nuisible.
Mutation de l’ADN mitochondrial [4, 5]
La tâche principale des mitochondries est de fournir de l’énergie sous forme d’ATP. Cela se fait par le biais de la chaîne respiratoire, qui se déroule au niveau de la membrane mitochondriale interne. Ce processus n’est pas toujours exempt d’erreurs. Des erreurs dans la chaîne respiratoire peuvent entraîner la production d’ERO, ce qui explique pourquoi la mitochondrie est l’endroit où le turnover des ERO est le plus élevé dans la cellule.
Les mitochondries contiennent leur propre matériel génétique (ADNmt). L’ADNmt se trouve à proximité immédiate de la chaîne respiratoire et donc à proximité immédiate de l’influence néfaste des ROS qui se forment. Il a été démontré que les mutations de l’ADNmt s’accumulent au cours du processus de vieillissement normal et que la fonction de la chaîne respiratoire diminue de manière inversement proportionnelle, ce qui entraîne une baisse de la fourniture d’énergie (théorie mitochondriale du vieillissement). En outre, il a été démontré qu’au-delà du vieillissement intrinsèque mentionné ci-dessus, les mutations de l’ADNmt jouent également un rôle dans le vieillissement extrinsèque de la peau (théorie mitochondriale du photovieillissement). La peau exposée de manière répétée aux UV a montré une induction de mutations de l’ADNmt, entraînant des troubles fonctionnels des mitochondries (consommation d’oxygène, potentiel de la membrane mt, métabolisme énergétique).
Métalloprotéases matricielles [6, 7]
Les marix métalloprotéinases (MMP) constituent une famille d’enzymes dont la fonction est de dégrader de manière protéolytique les protéines de la matrice dermique. Les principaux substrats des MMP sont les protéines structurelles du derme, telles que les collagènes et la gélatine. La fonction des MMP est importante dans le cadre du remodelage tissulaire qui se produit lors de différents processus biologiques tels que la morphogenèse, la cicatrisation des plaies, l’angiogenèse ou la croissance tumorale. En outre, les MMP ont d’autres fonctions dans le traitement des molécules de signalisation qui contrôlent le comportement cellulaire. Il existe des inhibiteurs spécifiques des MMP, appelés inhibiteurs spécifiques des tissus des métalloprotéinases matricielles (TIMP). Ils réduisent l’activité des MMP et limitent ainsi, par exemple, une dégradation excessive des protéines. L’interaction entre le MMP et le TIMP n’est pas encore tout à fait claire.
Un grand nombre de travaux suggèrent que les MMP jouent un rôle important dans le vieillissement extrinsèque de la peau. Les MMP sont induites directement et indirectement par la lumière ultraviolette. La dégradation des protéines de la matrice dermique ainsi induite entraîne une altération de la matrice extracellulaire qui contribue aux changements visibles cliniquement et histologiquement caractéristiques de la peau photovieillie.
Des études indiquent que les rétinoïdes ont un effet inhibiteur sur l’expression des MMP. L’enrichissement en nouveau collagène non fractionné peut ensuite entraîner une amélioration significative de l’aspect de la peau.
Activation des facteurs de transcription [8, 9]
L’activation de facteurs de transcription par les UV entraîne l’induction de MMP. L’exposition de la peau humaine aux UV entraîne non seulement l’induction directe de la MMP, mais aussi l’induction des facteurs de transcription AP-1 et NF-κB. Ces facteurs sont des activateurs des gènes MMP. Cette voie d’activation indirecte des MMP dans la peau vieillie de manière extrinsèque existe en plus de l’induction directe des MMP par les ROS.
Les résultats d’études en laboratoire et sur des animaux indiquent que l’induction des facteurs de transcription peut être inhibée par des extraits de plantes (magnolol).
“Advanced Glycation Endproducts” (produits finaux avancés de la glycation) [10, 11]
“Advanced Glycation Endproducts” (AGEs) se forment dans le cadre d’une réaction de Maillard par glycation et oxydation de différentes protéines structurelles. Dans ce cas, les protéines (groupes amino libres) ou les lipides réagissent de manière non enzymatique avec les glucides. Les AGE sont impliqués dans différentes maladies liées au vieillissement. La glycation est impliquée à la fois dans le vieillissement cutané intrinsèque et extrinsèque (exposition aux UV) et modifie les processus de croissance et de différenciation ainsi que les activités enzymatiques (MMP) dans la matrice extracellulaire de la peau. L’augmentation de la teneur en AGE dans la peau modifie les propriétés mécaniques. Ils se caractérisent par une élasticité réduite et une rigidité accrue.
Des résultats d’études en laboratoire indiquent que la formation d’AGE peut être inhibée par des extraits de plantes (pamplemousse rouge).
Vitamine D [12–15]
La vitamine D est une vitamine liposoluble qui est principalement produite par la peau humaine sous l’effet du rayonnement solaire (en particulier les UV-B). Il régule, entre autres, l’absorption du calcium et du phosphate par l’intestin et leur intégration dans les os. La diminution de l’épaisseur de la peau liée à l’âge entraîne une baisse significative de la synthèse de la vitamine D dans la peau. De plus, chez les personnes âgées et moins mobiles, la diminution de l’exposition au soleil a un effet négatif sur le statut en vitamine D. Les personnes âgées sont plus susceptibles de souffrir d’une carence en vitamine D que les autres.
L’importance de la vitamine D a suscité une grande attention ces dernières années et fait actuellement l’objet d’un vif débat. La revue systématique de Philippe Autier [15] du 6.12.13 montre clairement que les opinions souvent colportées sur la vitamine D doivent être nuancées. De nombreuses études prospectives ont montré une association entre de faibles concentrations de 25(OH)vitamine D et un certain nombre de maladies aiguës et chroniques. Cependant, un nombre similaire d’études randomisées n’a pas pu démontrer que l’augmentation de la concentration en vitamine D permettait de prévenir l’apparition de la maladie.
Sénescence immunitaire [16]
Même chez les personnes apparemment en bonne santé, le système immunitaire vieillissant subit des changements profonds et parfois irréversibles qui conduisent à une diminution progressive de la fonction immunitaire – l’immunosénescence. Elle concerne tous les organes et cellules du système immunitaire inné et acquis, y compris les cellules souches hématopoïétiques (CSH), les cellules progénitrices lymphoïdes (CLP) de la moelle osseuse et du thymus, les lymphocytes T et B matures des organes lymphatiques secondaires, ainsi que les phagocytes et les cellules présentatrices d’antigènes (APC) du système immunitaire inné. Au niveau de l’organisme dans son ensemble, ces changements liés à l’âge se traduisent principalement par une plus grande propension aux infections et une moindre réponse aux vaccins. Les tumeurs et les maladies auto-immunes sont également plus fréquentes. Nombre d’entre elles concernent la spécialité dermatologique comme les carcinomes épithéliaux, le mélanome malin, les lymphomes cutanés, les collagénoses, les dermatoses bulleuses, l’herpès zoster, les troubles de la cicatrisation et d’autres.
Vieillissement de l’immunité innée : les cellules du système immunitaire inné sont en première ligne dans la défense contre les agents pathogènes. Il s’agit notamment des cellules phagocytaires et/ou présentatrices d’antigènes telles que les neutrophiles, les macrophages et les cellules dendritiques (DC), mais aussi de celles qui sont à la frontière de l’immunité acquise, comme les cellules NK. Certaines des modifications du système immunitaire inné liées au vieillissement sont résumées dans le tableau 1 .
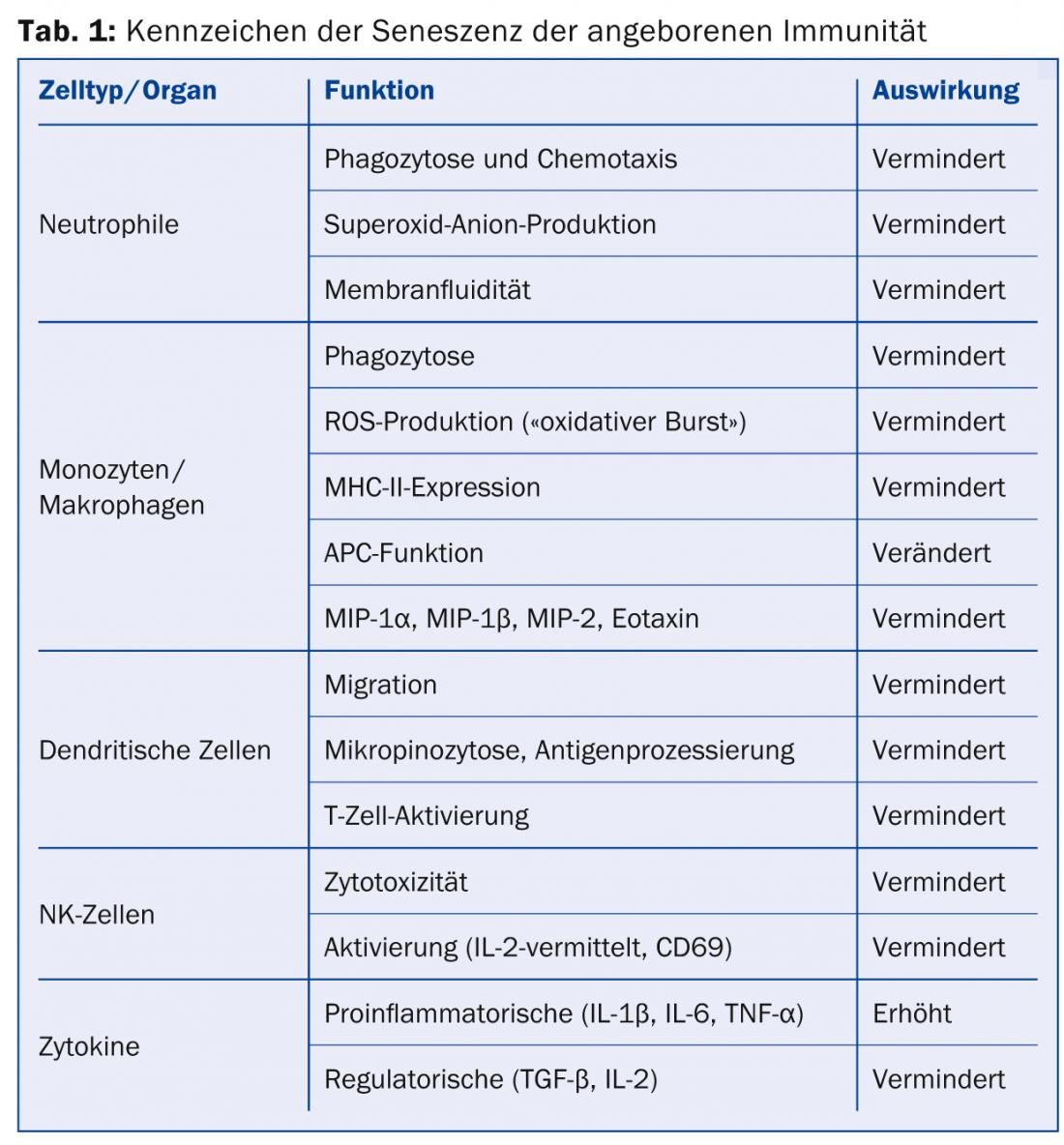
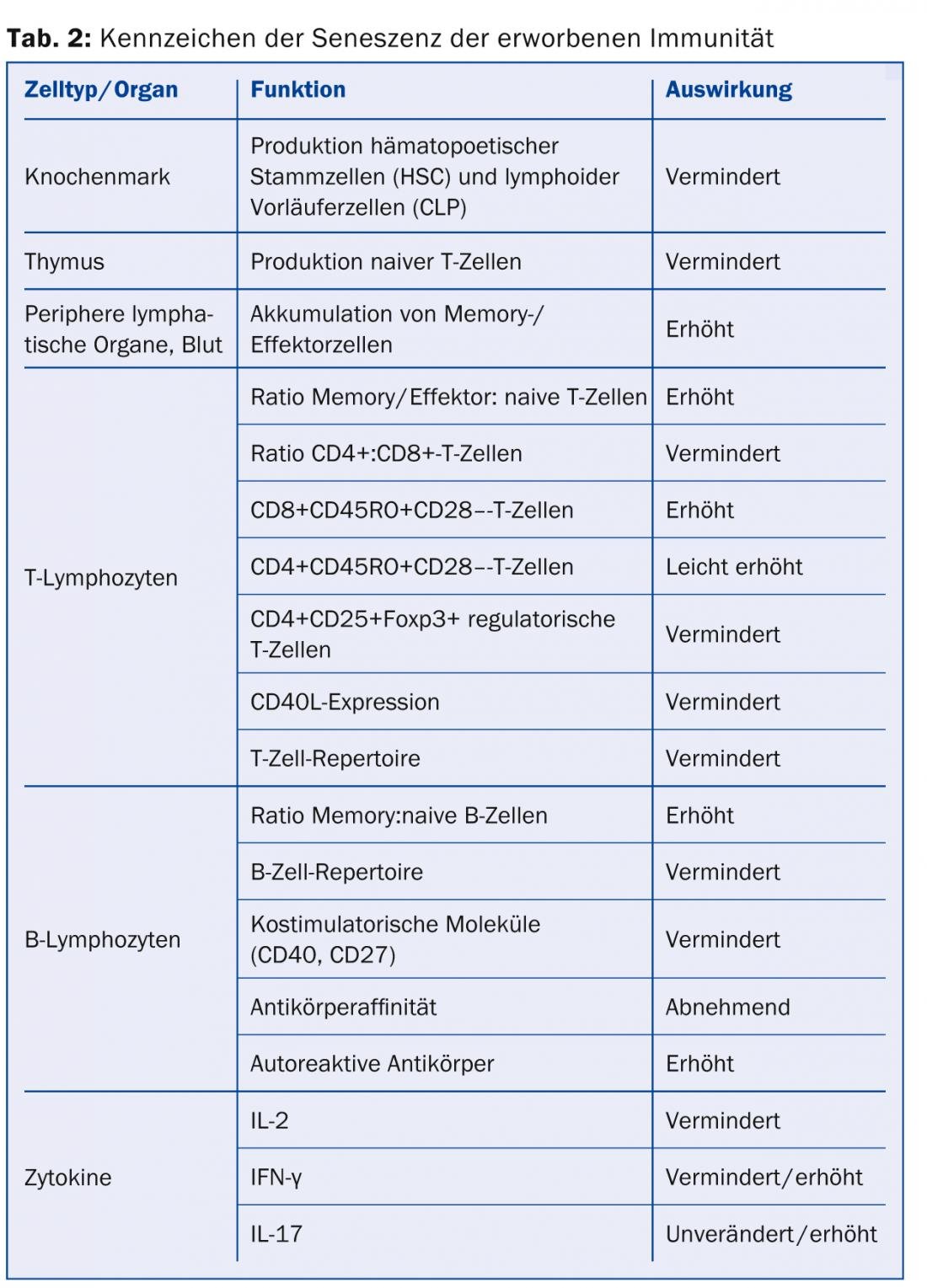
Vieillissement de l’immunité acquise : contrairement à l’immunité innée, l’immunité acquise est capable de fournir des réponses immunitaires spécifiques aux antigènes, principalement par le biais des lymphocytes T et des lymphocytes B. Les lymphocytes T et les lymphocytes B sont les principaux acteurs de la réponse immunitaire. Celles-ci subissent également des modifications liées au vieillissement qui, comme pour l’immunité innée, entraînent une diminution (ou un mauvais ciblage) de la force de frappe contre les agents pathogènes. En outre, l’immunité acquise présente une variabilité réduite et donc une capacité d’adaptation réduite aux antigènes (tableau 2).
Modifications de la peau liées à l’environnement
Les modifications de la peau dues à l’environnement sont aujourd’hui principalement causées par le tabagisme et les rayons ultraviolets (UV-S).
le tabagisme [17, 18] : L’altération des processus physiologiques de la peau par le tabagisme a été bien étudiée. Le tabagisme affecte généralement la circulation sanguine des tissus, y compris celle de la peau. La peau des fumeurs est souvent terne et grisâtre, elle est également plus sèche et plus flasque et se ride plus tôt et plus fortement. Ces phénomènes ont été documentés de manière impressionnante dans certains travaux portant sur des jumeaux monozygotes. Ces phénomènes se manifestent plus tôt et plus clairement chez les femmes que chez les hommes. Plusieurs processus physiologiques de la peau sont responsables de la formation accrue de rides chez les fumeurs, qui sont affectés par les nombreux radicaux libres présents dans la fumée de tabac. Ainsi, la fumée de tabac inhibe la formation de nouvelles fibres de collagène dans le derme tout en favorisant la dégradation des fibres de collagène et d’élastine. Le système finement coordonné de formation et de dégradation des fibres est alors déséquilibré. L’exposition aux UV affecte également ces processus. En outre, la nicotine contenue dans la fumée de tabac rétrécit les vaisseaux sanguins, de sorte que la peau est également insuffisamment irriguée, et le monoxyde de carbone réduit le transport de l’oxygène par les érythrocytes.
Exposition aux UV [19–22]: L’altération des processus physiologiques de la peau, notamment par une exposition extensive aux UV, a également été bien étudiée (fig. 1).

Cela a été particulièrement bien illustré l’an dernier dans un article de Jennifer Gordon publié dans le New England Journal of Medicine [20]. La présentation clinique montre un chauffeur de camion de 69 ans dont la peau du côté gauche du visage s’est épaissie et ridée de manière asymptomatique sur une période de 25 ans de travail et qui présentait des signes typiques de lésions cutanées associées aux UVA. On sait encore peu de choses sur le photovieillissement épidermique et les processus moléculaires qui conduisent aux troubles de la pigmentation – typiques des peaux endommagées par la lumière – ne sont pas encore bien compris. Le photovieillissement dermique est beaucoup mieux étudié. En raison d’une activité accrue de la métalloprotéinase matricielle, de la collagénase, de la gélatinase 92 kd et de la stromélysine, le collagène se dégrade davantage avec l’âge. Même des quantités faibles ou intermittentes de lumière UV activent la métalloprotéinase matricielle et entraînent une dégradation du collagène et une inhibition de la synthèse du collagène. C’est également à ce stade qu’intervient le traitement à l’acide rétinoïque, qui vise à empêcher l’activation de la métalloprotéinase matricielle induite par les UV. Des processus similaires sont également décrits pour l’élastine. L’interaction de ces processus conduit à la formation de rides typiques liées à la lumière.
Entre-temps, il existe également des travaux qui décrivent de manière impressionnante l’importance de la pollution dans le vieillissement de la peau. Mais le tabac et les UV-S ne sont pas les seuls facteurs environnementaux. La gravité, les expressions faciales et la position de sommeil sont également des facteurs extrinsèques qui contribuent de manière non négligeable aux changements visibles de la peau vieillissante : La pesanteur tire sans cesse sur notre corps et ses signes sont particulièrement visibles après 50 ans. Le nez, les oreilles, les paupières et les lèvres sont particulièrement touchés. Les rides nasogéniennes, les rides de la marionnette et les rides du cou sont considérées comme des rides de gravité et sont dues à un relâchement des tissus cutanés et sous-cutanés.
Les rides du visage se forment de plus en plus avec l’âge. Les rides d’expression peuvent apparaître très tôt dans le cadre d’une hyperactivité des muscles du visage. En gros, on peut les classer en rides de la patte d’oie, rides de colère, rides frontales, rides de la bouche, rides des lèvres ou rides du fumeur, ainsi qu’en rides du menton ou du nez.
Certaines positions de sommeil entraînent l’apparition de rides de sommeil typiques, généralement verticales, au niveau des joues et des tempes.
On constate de grandes différences ethniques dans la formation des rides liées à l’âge. Ainsi, les femmes japonaises et sud-coréennes restent pratiquement sans rides jusqu’à l’âge de 50 ans, tandis que les femmes françaises ont des rides d’expression visibles dès l’âge de 20 à 30 ans. Cependant, après 50 ans, la situation s’inverse à nouveau en faveur des Européennes.
Génie génétique et soins de la peau [23]
Ces dernières années, les progrès considérables réalisés dans le domaine du génie génétique et le développement des “puces génétiques” nous ont permis de mieux comprendre les événements moléculaires liés au vieillissement de la peau. Les analyses d’expression génique ont permis d’identifier des voies de signalisation impliquées dans le processus de vieillissement et ces connaissances peuvent sans aucun doute contribuer au développement de nouvelles stratégies de prévention et de traitement.
Cependant, les rapports souvent enthousiastes sur l’effet de nouveaux ingrédients (parfois connus de longue date) sur le processus de vieillissement ont été réalisés in vitro et une transposition à des situations “cliniques” quotidiennes reste à faire. Ces principes actifs candidats sont néanmoins souvent proposés à doses homéopathiques, à grand renfort de mots et de couleurs, dans des produits cosmétiques dits hautement efficaces et innovants. Les vantardises autour des cellules souches sont particulièrement impressionnantes depuis que Michelle Obama soigne son visage avec un sérum contenant des cellules souches de la variété de pomme suisse à longue durée de vie “Uttwiler Spätlauber”. Ainsi, on suggère au consommateur – avec l’appui de nombreuses célébrités – que ces produits rappellent aux cellules souches de la peau leur mission, à savoir se rendre utiles et rajeunir la peau.
Conclusion pour la pratique
- Dans le cas du vieillissement intrinsèque, on parle souvent de vieillissement chronologique ou génétique, et dans le cas du vieillissement extrinsèque, de vieillissement exogène ou prématuré.
- Les espèces réactives de l’oxygène (ROS) jouent un rôle central dans le vieillissement intrinsèque et extrinsèque de la peau.
- Les mutations de l’ADN mitochondrial s’accumulent au cours du processus de vieillissement normal. La fonction de la chaîne respiratoire diminue de manière inversement proportionnelle, ce qui entraîne une baisse de la fourniture d’énergie (théorie mitochondriale du vieillissement).
- Le tabagisme, les UV-S, la gravité, les expressions faciales et la position de sommeil sont considérés comme des facteurs environnementaux de vieillissement de la peau.
Prof. Dr. phil. nat. Christian Surber
Littérature :
- Harman D : J Gerontol 1956 ; 11 : 298-30000. PMID 13332224.
- Fortmann SP, et al. : Ann Intern Med 2013 ; 159(12) : 824-834. doi:10.7326/0003-4819-159-12-201312170-00729.
- Moyer MW : Sci Am 2013 Feb ; 308(2) : 62-67. PMID : 23367786.
- Berneburg M, et al : Photochem Photobiol Sci 2006 ; 5 : 190-198. PMID : 16465305.
- Kazachkova N, et al : Aging Dis 2013 ; 4(6) : 337-350. PMID : 24307967.
- Griffiths CE, et al : N Engl J Med 1993 ; 329(8) : 530-535. PMID : 8336752.
- Hernández-Pérez M, et al : Am J Dermatopathol 2012 ; 34(6) : 565-579. doi : 10.1097/DAD. 0b013e31821e8744.
- Muthusamy V, et al. : Arch Dermatol Res 2010 ; 302(1) : 5-17. doi : 10.1007/s00403-009-0994-y.
- Tanaka K, et al. : Curr Drug Metab 2010 ; 11(5) : 431-435. PMID : 20540695.
- Crisan M, et al. : PLoS One 2013 ; 8(10) : e75003. doi : 10.1371/journal.pone.0075003.
- Jariyapamornkoon et al. : BMC Complement and Altern Med 2013 ; 13 : 171. doi : 10.1186/1472-6882-13-171.
- Tang JY, et al : J Am Acad Dermatol 2012 ; 67(5) : 803.e1-12, quiz 815-6. doi : 10.1016/j.jaad.2012.05.044.
- Tang JY, et al : J Am Acad Dermatol 2012 ; 67 : 817.e1-11, quiz 827-8. doi : 10.1016/j.jaad.2012.07.022.
- Reid IR, et al : Lancet 2013 Oct 10. pii : S0140-6736(13)61647-5. doi : 10.1016/S0140-6736(13)61647-5.
- Autier P, et al : Vitamin D status and ill health : a systematic review. The Lancet Diabetes & Endocrinology, Disponible en ligne le 6 décembre 2013. http://dx.doi.org/10.1016/S2213-8587(13)70165-7.
- Peters T : Hautarzt 2011 ; 62(8) : 598-606, doi : 10.1007/s00105-011-2134-9.
- Morita A, et al. : J Invest Dermatol Symp Proc 2009 ; 14 : 53-55, doi:10.1038/jidsymp.2009.13.
- Okada HC, et al : Plast Reconstr Surg 2013 ; 132 : 1085-1092, doi : 10.1097/PRS.0b013e3182a4c20a.
- Gilchrest BA : J Invest Dermatol 2013 ; 133(E1) : E2–E6, doi:10.1038/skinbio.2013.176.
- Gordon JRS, et al : N Engl J Med 2012 ; 366 : e25, doi : 10.1056/NEJMicm1104059.
- Valacchi G, et al : Ann NY Acad Sci 2012 ; 1271 : 75-81, doi : 10.1111/j.1749-6632.2012.06724.x.
- Dennerstein L, et al : Menopause Int 2011 ; 17(3) : 96-101. doi : 10.1258/mi.2011.011028.
- Tiesman JP : J Drugs Dermatol 2009 ; 8(7 Suppl) : s12-14. PMID : 19623779.
Pratique de la dermatologie 2014 ; 24(1) : 4-8











