En prévention primaire et secondaire chez les patients atteints de fibrillation auriculaire (FAV), après une longue période de monopole des antagonistes de la vitamine K (AVK), de nouvelles substances comme le dabigatran, le rivaroxaban et l’apixaban ont apporté la preuve d’une efficacité égale. Les nouvelles substances semblent présenter des avantages évidents par rapport aux “anciens” AVK (dosage fixe, pas de contrôle de la coagulation, moins d’interactions avec les aliments et les autres médicaments). Cependant, les études actuelles ne permettent pas d’identifier un avantage clair pour chacune des nouvelles substances par rapport aux autres.
Quels sont les patients candidats aux nouveaux anticoagulants oraux en prévention primaire ou secondaire de l’HVF ? En l’état actuel des choses, il s’agit de patients atteints d’HVF dont l’ajustement à un INR thérapeutique s’avère difficile avec les AVK ou qui ne souhaitent pas subir de prises de sang régulières ou encore dont la réalisation est difficile (par exemple, éloignement du médecin le plus proche). Cela peut également s’appliquer aux patients ayant subi un accident vasculaire cérébral suite à une fibrillation auriculaire.
Quels patients reçoivent (ou continuent de recevoir) des AVK ? Il n’y a pas d’indication à passer à l’une des nouvelles substances chez les patients qui sont restés stables pendant des années sous AVK et qui présentent notamment des valeurs INR stables dans la plage thérapeutique. De même, un traitement par AVK restera nécessaire chez les patients souffrant d’insuffisance rénale sévère ou chez les patients nécessitant un traitement par un médicament qui interagit avec les nouveaux AVK (par ex. le kétoconazole) ou qui ont une autre indication pour les AVK (par ex. un remplacement mécanique de valve cardiaque).
La prévalence globale de la fibrillation auriculaire (FA) est le trouble du rythme cardiaque le plus fréquent chez l’adulte, avec une prévalence de 0,4 à 1% dans la population, passant de <1% chez les moins de 60 ans à environ 8% chez les plus de 80 ans [1]. L’attaque cérébrale est une complication redoutable de la FHV. Le risque d’attaque cérébrale est multiplié par 5 par la fibrillation auriculaire, indépendamment des autres facteurs de risque [2].
Éviter la formation d’un thrombus est la stratégie thérapeutique centrale pour la prévention primaire et secondaire de l’AVC chez les patients atteints de FVH. Les anticoagulants oraux (ACO) du groupe des antagonistes de la vitamine K (AVK, par exemple la warfarine aux États-Unis et la phenprocoumone ou l’acénocoumarol en Europe) sont utilisés à cette fin depuis des décennies. Leur efficacité dans la prévention des accidents vasculaires cérébraux ischémiques est prouvée depuis le début des années 1990 [3, 4]. Ils font partie des traitements les plus efficaces dans la prévention des événements emboliques cérébraux, avec une réduction du risque relatif de 64% et une réduction du risque absolu de 2,7% par an par rapport au placebo. 37 patients doivent être traités par un AVK pour prévenir un accident vasculaire cérébral [5, 6]. Cela s’applique à la fois à la prévention primaire et à la prévention secondaire.
Sous ces aspects, cette forme de thérapie peut être considérée comme très efficace. Cependant, en pratique clinique quotidienne, seuls 60% environ des patients ayant une indication pour un AVK sont traités en conséquence [7].
Le traitement par antagonistes de la vitamine K est associé à divers obstacles et défis pharmacologiques. Il est nécessaire de contrôler en permanence la posologie et de mesurer l’effet anticoagulant (International normalized ratio, INR). L’effet est souvent imprévisible au niveau individuel et dépend de différents polymorphismes [8, 9]. Les interactions avec d’autres médicaments et avec les aliments sont problématiques et nécessitent un ajustement de la dose. Les maladies concomitantes entraînent également une altération du métabolisme.
Le développement de nouvelles substances appartenant au groupe des inhibiteurs oraux du facteur Xa et de la thrombine a apporté de nouvelles options dans le domaine de l’anticoagulation orale. Certaines substances ont prouvé leur effet dans des études d’efficacité correspondantes et sont depuis peu autorisées en Suisse pour la prophylaxie des thromboembolies en cas de fibrillation auriculaire Une nouvelle ère semble s’être ouverte dans l’histoire des anticoagulants oraux [10]. Le roi (VKA) est-il mort [11]? N’avons-nous plus besoin de l’ACC [12]? Quelles sont les propriétés des nouvelles substances ? Nous allons tenter de répondre à ces questions dans ce qui suit. Nous résumons brièvement les études actuelles et abordons les aspects pratiques.
Apixaban
L’apixaban (Eliquis®) est un inhibiteur direct du facteur Xa. Il est en grande partie éliminé par voie hépatobiliaire, environ 25% étant également éliminé par voie rénale [13]. L’effet de l’apixaban dans la prévention de l’attaque cérébrale a été testé dans deux grandes études cliniques.
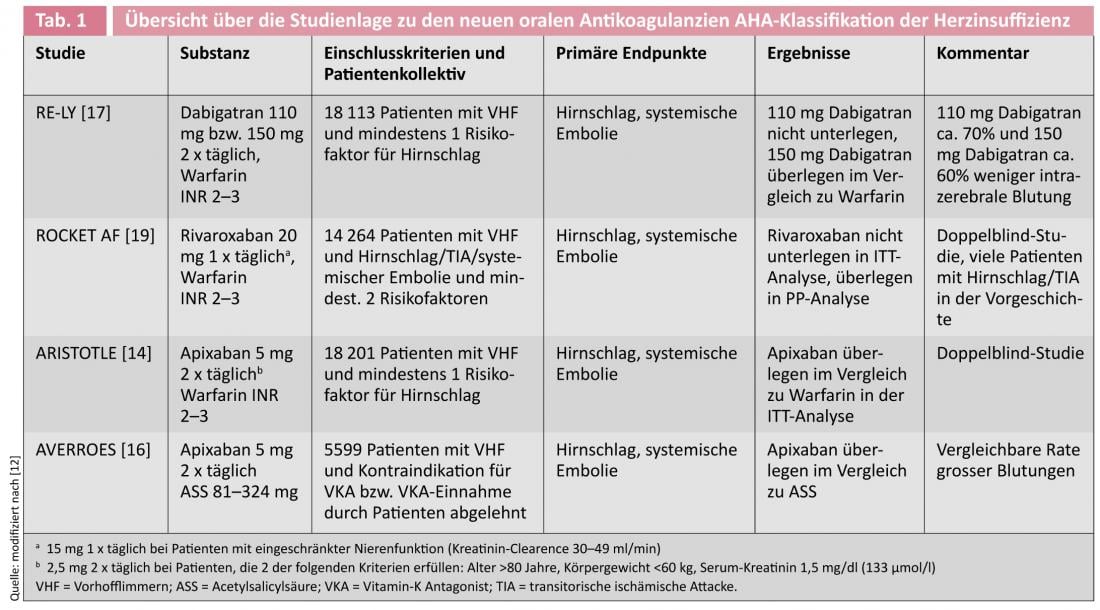
Dans l’étude ARISTOTLE (Apixaban for Reduction in Stroke and Other Thromboembolic Events in Atrial Fibrillation), 18 201 patients atteints de FHV ont été traités par une dose de 5 mg d’apixaban deux fois par jour ou par la warfarine [14, 15]. Le taux d’événements principaux (accident vasculaire cérébral ou embolie systémique) après une période d’observation moyenne de 1,8 an était de 1,37% dans le groupe apixaban et de 1,60% dans le groupe warfarine (HR 0,79, IC à 95% 0,66-0,95 ; p=0,01 pour la supériorité). Les hémorragies majeures ont été statistiquement moins fréquentes dans le groupe apixaban (2,13% par an) que dans le groupe warfarine (3,09% par an) (HR 0,69, IC à 95% 0-60-0-80 ; p<0,001). La mortalité a été réduite de 11% (HR 0,89, 95%CI 0,80-0,99 ; p=0,047).
Une deuxième étude, l’étude AVERROES (Apixaban versus Acetylsalicylic Acid to Prevent Stroke in Atrial Fibrillation Patients Who Have Failed or Are Unsuitable for Vitamin K Antagonist Treatment), a évalué l’effet de l’apixaban (posologie de 5 mg deux fois par jour) par rapport à l’acide acétylsalicylique (ASA) (posologie de 81-324 mg par jour) chez 5599 patients, qui présentaient une FHV et qui étaient soit contre-indiqués pour un traitement par warfarine, soit peu enclins à suivre un tel traitement. [16]. Le critère d’évaluation primaire (accident vasculaire cérébral ou embolie systémique) était identique à celui de l’étude ARISTOTLE.
L’étude a été interrompue prématurément par le comité de données et de sécurité, car il a été possible de calculer une nette supériorité de l’apixaban. La durée moyenne d’observation était de 1,1 an. Au total, 51 événements terminaux ont été observés dans le groupe apixaban (1,6% par an) et 113 dans le groupe ASA (3,7% par an) (HR 0,45, IC à 95% 0-32-0-62 ; p<0,001). Le taux de saignement n’a pas montré de différence statistiquement significative avec 44 cas (11 hémorragies intracérébrales, ICB) dans le groupe apixaban (1,4% et 0,4% ICB par an respectivement) contre 39 (13 ICB) dans le groupe ASA (1,2% et 0,4% ICB par an respectivement) (HR pour l’apixaban, 1,13, IC à 95% 0-74-1,75 ; p=0,57).
Dabigatran
Le dabigatran etexilate (Prodrug) ou dabigatran (Pradaxa®) est un inhibiteur direct de la thrombine, disponible sur le marché européen depuis 2008 et également autorisé en Suisse depuis mai 2012 pour la prophylaxie des embolies en cas de FHV. Le dabigatran est éliminé à environ 80% par voie rénale et n’est pas métabolisé par le CYP3A4. Dans l’UE, le dabigatran est contre-indiqué en cas d’insuffisance rénale sévère (clairance de la créatinine <30 ml/min).
L’efficacité du dabigatran a été testée dans l’étude RE-LY (Randomized Evaluation of Long-Term Anticoagulation Therapy) portant sur 18 113 patients atteints de FHV et présentant au moins un facteur de risque supplémentaire d’accident vasculaire cérébral [17]. Les patients ont été randomisés en trois bras d’étude 1:1:1 avec deux doses de dabigatran en aveugle (110 mg ou 150 mg deux fois par jour) et un groupe ouvert de warfarine (INR cible 2,0-3,0). La période de suivi moyenne était de deux ans. Les critères d’évaluation primaires étaient l’accident vasculaire cérébral et l’embolie systémique, l’évaluation étant réalisée en aveugle selon la procédure PROBE (prospective randomized open with blind endpoint evaluation). Le taux d’événements du point final primaire était de 1,71% par an dans le groupe warfarine, de 1,54% par an dans le groupe dabigatran 2 x 110 mg (RR 0,90, IC à 95% 0,74-1,10 ; p<0,001 pour la non-infériorité) et 1,11% par an dans le groupe dabigatran 2 x 150 mg (RR 0,65, IC à 95% 0,52-0,81 ; p<0,001 pour la supériorité). Les hémorragies majeures ont été significativement moins nombreuses dans le groupe dabigatran 110 mg (2,87% par an) que dans le groupe warfarine (3,57% par an) (RR 0,80, IC à 95% 0,70-0,93 ; p=0,003), mais comparables dans le groupe dabigatran 150 mg (RR 0,93, IC à 95% 0,81-1,07 ; p=0,31). Le taux d’AVC hémorragique était plus élevé avec la warfarine, soit 0,38% par an, qu’avec le dabigatran 110 mg (0,12% par an, RR 0,31, IC à 95% 0,17-0,56 ; p<0,001) et également avec le dabigatran 150 mg (0,10% par an, RR 0,26, IC à 95% 0,14-0,49 ; p<0,001). Une analyse de sous-groupe sur la prévention secondaire chez les patients ayant des antécédents d’AIT ou d’accident vasculaire cérébral a montré un résultat comparable à celui de l’étude principale [18].
Rivaroxaban
Rivaroxaban (Xarelto
®
) est un inhibiteur direct du facteur Xa, approuvé en Europe par l’Agence européenne des médicaments (EMA) depuis 2008 pour la prophylaxie de la thromboembolie veineuse chez les patients adultes ayant subi une chirurgie élective de remplacement du genou ou de la hanche. Depuis avril 2012, il est également autorisé en Suisse pour la prévention de l’attaque cérébrale en cas de fibrillation auriculaire non valvulaire. Le rivaroxaban a une pharmacocinétique dose-dépendante. Un tiers est excrété dans l’urine sans être métabolisé et deux tiers sont métabolisés par le foie, dont la moitié est excrétée par voie hépatobiliaire et la moitié par voie rénale. Malgré une part importante d’élimination rénale, il n’y a pas de contre-indication en cas d’insuffisance rénale légère à modérée (clairance de la créatinine 30-79 ml/min).
L’effet du rivaroxaban (dose quotidienne de 20 mg ou 15 mg pour une clairance de la créatinine de 30-49 ml/min) a été testé dans l’étude ROCKET-AF (Rivaroxaban Once Daily Oral Factor Xa Inhibitor Compared with Vitamin K Antagonism for Prevention of Stroke and Embolism Trial in Atrial Fibrillation) en double aveugle et en double muet contre la warfarine chez 14 264 patients. [19]Les patients ont reçu une combinaison de l’OAK et du placebo complémentaire. des tests INR réguliers dans un laboratoire central avec des valeurs réelles ou “factices” et l’adaptation correspondante de la médication. Le critère d’évaluation de l’étude était également la survenue d’un accident vasculaire cérébral ou d’une embolie systémique. Dans l’analyse per protocole (PP), ce critère a été observé chez 1,7% par an dans le groupe rivaroxaban et 2,2% par an dans le groupe warfarine (HR 0,79, IC à 95% 0-66-0,96 ; p<0,001 pour la non-infériorité). De même, dans l’analyse en intention de traiter (ITT), le rivaroxaban n’a pas été inférieur à la warfarine avec 2,1% d’événements terminaux par an, contre 2,4% par an (HR 0,88, IC à 95% 0,75-1,03 ; p<0,001 pour la non-infériorité et p = 0,12 pour la supériorité). Les hémorragies intracrâniennes (0,5 vs. 0,7% par an, HR 0,67, IC à 95% 0,47-0,93 ; p=0,02) et fatales (0,2 vs. 0,5% par an, HR 0,50, IC à 95% 0,31-0,79 ; p=0,003) ont été moins fréquentes sous rivaroxaban. Une analyse de sous-groupe chez les patients ayant déjà subi un AVC ou un AIT n’a pas montré de différence d’efficacité par rapport aux patients sans antécédents de ce type, montrant ainsi une efficacité comparable à la fois dans la prévention primaire et secondaire de l’AVC [20].
Comparaison des nouveaux anticoagulants
Les trois nouvelles substances ont montré leur non-infériorité par rapport à la warfarine dans de grandes études randomisées. Il n’existe malheureusement pas d’étude comparant directement les nouvelles substances entre elles. Ainsi, chaque étude présente des avantages et des inconvénients différents en raison d’une conception légèrement différente et d’une population d’étude différente, sans que les chiffres absolus soient comparables.
Actuellement, il est impossible de déterminer quelle substance est la plus efficace ou présente le meilleur rapport bénéfice/risque. Une indication pourrait être fournie par le nombre de patients à traiter (NNT = nombre de patients à traiter pour éviter 1 événement), qui est de 625 pour le dabigatran 2 x 110 mg, 172 pour le dabigatran 2 x 150 mg, 303 pour l’apixaban et 200 pour le rivaroxaban. Ainsi, la dose élevée de dabigatran présente la plus grande efficacité dans la prophylaxie de l’attaque cérébrale, tandis que l’apixaban présente le taux de saignement le plus faible. Ce qui est intéressant pour le neurologue, c’est que dans l’étude ROCKET-AF (rivaroxaban), les patients avaient tendance à être plus malades et à avoir un score CHADS2 plus élevé (moyenne : 3,5) que dans les études avec l’apixaban et le dabigatran (moyenne d’environ 2,0 chacune).
Toutes les substances ont montré certains avantages substantiels communs par rapport aux AVK : a) Doses fixes, indépendamment de l’âge, du sexe et du poids ; b) aucune interaction avec l’alimentation et peu d’interactions avec d’autres médicaments ; c) pas de nécessité de surveillance de l’INR ; d) des risques hémorragiques moindres ou comparables, et notamment un risque réduit d’hémorragie intracérébrale.
Questions en suspens
Contrôle de la coagulation et thrombolyse sous les nouveaux OAK
Un grand défi se pose en ce qui concerne les nouvelles substances dans la situation de l’attaque cérébrale aiguë et la question d’un traitement aigu. Alors qu’avec les AVK, la situation actuelle en matière de coagulation peut être déterminée rapidement et facilement, même avec des appareils de mesure manuels, via l’INR, cette possibilité n’existe pas actuellement pour les nouvelles substances. Cependant, des tests urinaires permettant de détecter les métabolites du dabigatran et du rivaroxaban dans l’urine sont actuellement en cours de développement [21]. Pour le dabigatran, il est indiqué que des valeurs normales du temps de thrombine (TT), du temps de thrombine partielle activée (aPTT) ou du “escarin clotting time” permettent de conclure à une situation de coagulation normale [22]. Pour le rivaroxaban et l’apixaban, l’activité du facteur Xa spécifique à la substance peut être mesurée. Il semble y avoir un consensus général sur le fait que la prise d’une des nouvelles substances dans les dernières 48 heures constitue une contre-indication absolue à la thrombolyse.
Hémorragie intracérébrale
Un autre problème se pose en situation d’hémorragie, notamment dans le cadre d’une redoutable hémorragie intracérébrale. Il n’existe aucun antidote spécifique pour aucune des nouvelles substances. Ils ont cependant tous en commun, d’une part, leur courte demi-vie plasmatique et, d’autre part, le fait qu’ils n’inhibent qu’un facteur spécifique de la cascade de la coagulation et non la production à grande échelle de divers facteurs de coagulation comme les AVK. Dans les différentes études cliniques, l’administration de facteurs de coagulation a été le plus souvent recommandée, ce qui repose en partie sur les résultats des modèles précliniques de saignement.
Conformité
Jusqu’à présent, les patients atteints de FHV étaient étroitement liés à leur médecin généraliste ou à leur médecin traitant en raison de la nécessité de contrôler fréquemment leur INR. Ce lien est supprimé par le dosage fixe des nouvelles substances. Seul l’avenir nous dira quelles en seront les conséquences pour les patients en général et pour l’observance de leurs médicaments en particulier, en l’absence de preuve en laboratoire d’une prise régulière de ces derniers.
Conclusion
Après 60 ans de monopole des antagonistes de la vitamine K en prévention primaire et secondaire chez les patients atteints de fibrillation auriculaire, de nouvelles substances ont apporté la preuve de leur efficacité. Même si les nouvelles substances présentent des avantages évidents par rapport aux AVK (dosage fixe, pas de contrôle de la coagulation, moins d’interactions avec les aliments et les autres médicaments), aucune d’entre elles ne présente actuellement d’avantage évident par rapport à ses concurrentes.
Quels patients reçoivent (ou continuent de recevoir) des AVK ?
Il n’y a pas d’indication à passer à l’une des nouvelles substances chez les patients qui ont été stables pendant des années sous traitement AVK et qui présentent notamment des valeurs INR stables dans la plage thérapeutique. De tels patients n’ont pas non plus été inclus dans les études. De même, un traitement par AVK restera nécessaire chez les patients souffrant d’une insuffisance rénale sévère ou chez les patients nécessitant un traitement par un médicament interagissant avec les nouveaux AVK (par exemple le kétoconazole) ou présentant une autre indication pour les AVK (par exemple un remplacement mécanique de valve cardiaque).
Quels sont les patients candidats pour les nouveaux OAK ?
Les données des études présentées ici concernent uniquement la prévention primaire et secondaire de la FHV. Pour certaines substances, il existe des indications supplémentaires strictement définies. Les candidats idéaux pour les nouvelles substances sont actuellement les patients atteints d’HVF dont le réglage sur un INR thérapeutique s’avère difficile avec les AVK, ou qui ne souhaitent pas de prises de sang régulières, ou encore dont la réalisation est difficile (par ex. grande distance jusqu’au médecin le plus proche). Les études actuelles ne permettent pas de déterminer clairement si les patients bénéficient d’une plus grande efficacité dans la prévention secondaire après un AVC ou un AIT. Les patients présentant un risque accru d’hémorragie intracérébrale pourraient également être des candidats pour les nouvelles substances, bien que là encore, aucune réponse claire ne puisse être donnée sur la base des études actuelles.
David Seiffge
Littérature :
- Fuster V, et al : 2011 ACCF/AHA/HRS focused updates incorporated into the ACC/AHA/ESC 2006 Guidelines for the management of patients with atrial fibrillation : a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines developed in partnership with the European Society of Cardiology and in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society. J Am Coll Cardiol 2011;57:101-198.
- Wolf PA, et al : La fibrillation auriculaire comme facteur de risque indépendant de l’AVC : l’étude de Framingham. Accident vasculaire cérébral 1991;22:983-988.
- The Boston Area Anticoagulation Trial for Atrial Fibrillation Investigators.The effect of low-dose warfarin on the risk of stroke in patients with non-rheumatic atrial fibrillation. N Engl J Med 1990;323:1505-1511.
- Ezekowitz MD, et al : Warfarin in the prevention of stroke associated with nonrheumatic atrial fibrillation. Veterans Affairs Stroke Prevention in Nonrheumatic Atrial Fibrillation Investigators. N Engl J Med 1992;327:1406-1412.
- Hart RG, et al : Meta-analysis : antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med 2007;146:857-867.
- Aguilar MI, et al. : Oral anticoagulants versus antiplatelet therapy for preventing stroke in patients with non-valvular atrial fibrillation and no history of stroke or transient ischemic attacks. Cochrane Database Syst Re 2007;CD006186.
- Ogilvie IM, et al : Underuse of oral anticoagulants in atrial fibrillation : a systematic review. Am J Med 2010;123:638-645 e4.
- Limdi NA et Veenstra D L. : Warfarin pharmacogenetics. Pharmacotherapy 2008;28:1084–1097.
- Mahajan P, et al : Applications cliniques du dosage de la warfarine guidé par la pharmacogénomique. Int J Clin Pharm 2011;33:10-19.
- Mega JL : Une nouvelle ère pour l’anticoagulation dans la fibrillation auriculaire. N Engl J Med 2011;365 1052-1054.
- Diener HC, et al. : The king is dead (warfarin) : direct thrombin and factor Xa inhibitors : the next Diadochian War ? Int J Stroke 2012;7:139-141.
- Diener HC, et al : Stroke prevention in atrial fibrillation : do we still need warfarin ? Curr Opin Neurol 2012;25:27-35.
- Shantsila E et Lip GY : Apixaban, un inhibiteur oral direct du facteur Xa activé. Curr Opin Investig Drugs 2008;9:1020-1033.
- Granger CB, et al : Apixaban versus warfarine chez les patients atteints de fibrillation auriculaire. N Engl J Med 2011;365:981-992.
- Lopes RD, et al : Apixaban for reduction in stroke and other thromboemboLic events in atrial fibrillation (ARISTOTLE) trial : design and rationale. Am Heart J 2010;159:331-339.
- Connolly SJ, et al : Apixaban chez les patients atteints de fibrillation auriculaire. N Engl J Med 2011;364:806-817.
- Connolly SJ, et al : Dabigatran versus warfarine chez les patients atteints de fibrillation auriculaire. N Engl J Med 2009;361:1139-1151.
- Diener HC, et al : Dabigatran comparé à la warfarine chez les patients atteints de fibrillation auriculaire et ayant déjà subi une attaque ischémique transitoire ou un accident vasculaire cérébral : une analyse de sous-groupe de l’essai RE-LY. Lancet Neurol 2010;9:1157-1163.
- Patel MR, et al : Rivaroxaban versus warfarine dans la fibrillation auriculaire non valvulaire. N Engl J Med 2011;36:883-891.
- Hankey GJ, et al : Rivaroxaban comparé à la warfarine chez les patients atteints de fibrillation auriculaire et ayant déjà subi un accident vasculaire cérébral ou une attaque ischémique transitoire : une analyse de sous-groupe de ROCKET AF. Lancet Neurol 2012;11:315-322.
- Harenberg J et Kraemer R : Mesure des nouveaux anticoagulants. Thromb Res, 2012;129 Suppl 1:S106-S113.
- Van Ryn J, et al. : Dabigatran etexilate – un nouvel inhibiteur direct de la thrombine réversible par voie orale : interprétation des tests de coagulation et inversion de l’activité anticoagulante. Thromb Haemost 2010;103:1116-1127.
CARDIOVASC 2013 ; No. 1 : 22-26