La recherche de nouveaux produits biologiques contribue à offrir des alternatives de traitement pour le psoriasis en plaques modéré à sévère en cas d’absence de réponse ou de perte d’efficacité [1]. Les données publiées en 2019 par le Swiss Dermatology Network of Targeted Therapies (SDTT) montrent qu’une amélioration rapide des symptômes cutanés et l’absence de lésions comptent parmi les critères les plus importants pour les patients, selon le Dr Julia-Tatjana Maul, de l’Hôpital universitaire de Zurich [2,3].
Retour à “Actualités de la dermatite atopique et du psoriasis”.
Le risankizumab (SKYRIZITM), un inhibiteur de l’interleukine 23, est autorisé en Suisse depuis avril 2019 pour le psoriasis en plaques modéré à sévère après l’échec d’un traitement systémique conventionnel [4]. De plus, depuis le 1er août 2019, l’anticorps monoclonal humanisé peut être pris en charge par l’assurance maladie [5]. Le risankizumab est injecté par voie sous-cutanée (150 mg ; 2× 75 mg), à quatre semaines d’intervalle après la première administration et à douze semaines d’intervalle par la suite [4]. L’efficacité élevée et durable avec une réponse rapide ainsi qu’une bonne tolérance ont été confirmées cliniquement [6–8].
données à long terme : Conclusion positive
La grande efficacité, la praticabilité et la tolérance contribuent à une amélioration de la qualité de vie, ce qui est également un objectif thérapeutique important, selon le professeur Peter Häusermann, de l’Hôpital universitaire de Bâle. Grâce au taux de réponse rapide – un soulagement significatif des symptômes en l’espace de 4 à 8 semaines – la phase d’incapacité à gérer le quotidien due au psoriasis peut être réduite. L’expert a souligné que l’efficacité du risankizumab ne diminue pas, même après une utilisation prolongée [9]. Les données de plusieurs études de phase III le prouvent également [6–8].
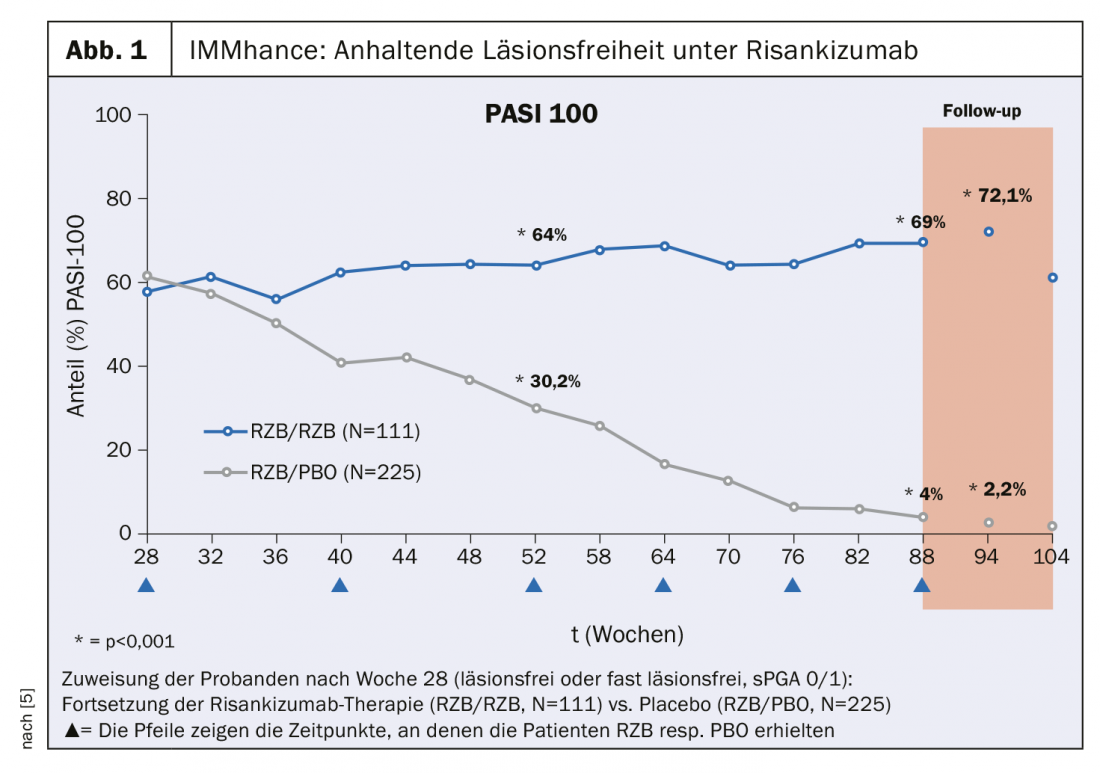
L’étude IMMhance a évalué l’impact à long terme de l’interruption du traitement par risankizumab chez des patients atteints de psoriasis en plaques modéré à sévère. Ceux qui ont atteint un état sans lésion ou presque sans lésion (Static Physician Global Assessment, sPGA 0/1) à la semaine 28 après le début du traitement ont été randomisés dans les conditions de poursuite du traitement par risankizumab (n=111) vs placebo (n=225). Dans le groupe des participants à l’étude qui ont continué à recevoir le risankizumab, plus de 70% ont obtenu une cicatrisation complète de la peau selon le Psoriasis Area Severity Index (PASI) 100 à la semaine 94 (figure 1). En revanche, dans le groupe passé au placebo, la réponse PASI 100 s’est détériorée, passant de 61,3% à 2,2% [6]. Dans les études UltIMMa-1 et UltIMMa-2, 75,1% et 81,3% des patients traités par risankizumab (n=598) ont obtenu un PASI de 90 après 16 et 52 semaines de traitement, respectivement, selon une analyse intégrée des deux études, ce qui est significativement plus élevé que dans le groupe ustekinumab, où moins de 50% des 199 sujets ont obtenu un PASI de 90 aux deux dates [8].
Controverse sur l’économie de la santé
Le risankizumab est indiqué dans le traitement du psoriasis en plaques modéré à sévère chez les adultes qui n’ont pas suffisamment répondu aux autres traitements systémiques [4]. Concrètement, au moins un traitement systémique conventionnel (ciclosporine, méthotrexate, acitrétine ou UVB et PUVA) doit avoir échoué après 16 semaines de traitement [5]. Il n’y a pas de consensus sur le nombre d’essais thérapeutiques systémiques avec des médicaments non biologiques à essayer au préalable. Mais, de manière générale, on prône une stratégie thérapeutique personnalisée. Les avis divergent sur la question de savoir s’il faut arrêter le traitement lorsqu’un PASI de 100 est atteint et sur le critère à prendre en compte pour passer à un autre médicament biologique. Le professeur Häusermann a pour vision que d’ici cinq ans environ, la classe de substances innovantes que sont les inhibiteurs de l’IL-23 sera utilisée de manière routinière. D’ici là, il sera peut-être possible de réduire l’écart de prix avec les médicaments systémiques conventionnels, ce qui constitue actuellement un dilemme en termes d’économie de la santé pour ces médicaments très efficaces [9].
Retour à “Actualités de la dermatite atopique et du psoriasis”.
Littérature :
- Birchler T : Risankizumab comme option de traitement du psoriasis. Présentation de diapositives. Thomas Birchler, AbbVie AG, Medical Advisor, Media-Roundtable, Iaculis GmbH & AbbVie AG, 29.10.2019, Zurich.
- Maul JT : Risankizumab comme option de traitement du psoriasis. Présentation de diapositives. Dr. med. Julia-Tatjana Maul, table ronde des médias, Iaculis GmbH & AbbVie AG, 29.10.2019, Zurich.
- Maul JT et al. Le genre et l’âge déterminent de manière significative les besoins des patients et les objectifs de traitement dans le psoriasis – une leçon pour la pratique. J Eur Acad Dermatol Venereol, 2019. 33(4) : p. 700-708.
- Informations professionnelles SKYRIZITM actualisées sur www.swissmedicinfo.ch.
- Liste des spécialités 2019 de l’Office fédéral de la santé publique OFSP. www.spezialitaetenliste.ch, état en août 2019.
- Blauvelt A, Leonardi, C., Gooderham, M., Papp, K. Efficacité et sécurité du risankizumab Q12W continu versus retrait du traitement : résultats en double aveugle sur 2 ans de la phase 3 de l’essai IMMhance. présenté au 24e Congrès mondial de dermatologie. Milan, Italie, 10-15 juin 2019.
- Gordon KB et al. Efficacité et sécurité du risankizumab dans le psoriasis en plaques modéré à sévère (UltIMMa-1 et UltIMMa-2) : résultats de deux essais de phase 3 en double aveugle, randomisés, contrôlés par placebo et contrôlés par ustekinumab. Lancet, 2018. 392(10148) : p. 650-661.
- Lebwohl M et al. Efficacité et sécurité du risankizumab dans le psoriasis en plaques modéré à sévère : une analyse intégrée d’UltIMMa-1 et UltIMMa-2. P8108, présenté à la réunion annuelle de l’American Academy of Dermatology, Washington DC, March 1-5, 2019.
- Häusermann P : Risankizumab comme option de traitement du psoriasis. Présentation de diapositives. Peter Häusermann, table ronde des médias, Iaculis GmbH & AbbVie AG, 29.10.2019, Zurich.
Adapté de : DERMATOLOGIE PRAXIS 2019 ; 29(6) : 26











