La toxine botulique (BTX), qui était autrefois un produit ophtalmologique au spectre thérapeutique limité, est devenue un médicament utilisé dans le monde entier. Il exerce un effet inhibiteur présynaptique sur la libération d’ACh au niveau de la plaque terminale neuromusculaire et neurovégétative. Dans l’application thérapeutique médicale chez l’homme, on utilise pratiquement exclusivement le BTX A. Il existe trois préparations qui ont fait l’objet d’un grand nombre d’études scientifiques : Onabotulinum, Abobotulinum, Incobotulinum. Comment les utiliser et quel matériel faut-il pour le traitement au Botulinum ?
Le premier cas documenté d’intoxication à la toxine botulique par la bactérie Clostridium botulinum, productrice de neurotoxines, remonte à 1735, lorsque la fanfare jouant à un mariage a été nourrie avec du jambon avarié et des saucisses fumées. Quatre des dix musiciens sont décédés de botulisme [1]. Dr Justinus Christian Kerner (1786-1862), poète et médecin officiel du Bade-Wurtemberg (Fig. 1), publiait méticuleusement dans les “Tübinger Blätter für Naturwissenschaften und Arzneykunde” les symptômes des patients atteints de botulisme et notait déjà à l’époque que “cette toxine pourrait être plus tard un médicament formidable pour le traitement des crampes, ainsi que pour la réduction de la salivation, des larmes ou de la transpiration excessives” [2]. Comme la bactérie n’avait pas encore été découverte à l’époque, Kerner a cru à la théorie dite des acides gras, après que de nombreux autres mécanismes aient été longuement discutés (nourriture malsaine pour les porcs, énergie électrique due à la foudre, châtiments divins dus à un mode de vie malhonnête, etc.) A cette époque, le botulisme était également appelé maladie de Kerner.

C’est en 1840 que Friedrich Gustav Jakob Henle (1809-1885), un professeur d’anatomie de Göttingen (“boucle de Henle”), a décrit pour la première fois des organismes parasites (Contagium vivum) et les a qualifiés de potentiellement pathogènes. Vingt ans plus tard, le chimiste Louis Pasteur (1822-1895) a démontré la fermentation microbienne du vin. En 1882, Robert Koch (1843-1910), un élève de Henle, a découvert le bacille de la tuberculose, ce qui lui a valu le prix Nobel en 1905. Les conséquences de la découverte des bactéries ont été énormes. En effet, pour la première fois dans l’histoire de la médecine, les causes de nombreuses maladies ont été connues, ce qui a permis pour la première fois de mettre en place une thérapie causale, du moins dans un premier temps. En 1897, Pierre Marie van Ermengem (1851-1932), un élève de Robert Koch, a pu isoler l’agent pathogène responsable du botulisme, réfutant ainsi la théorie des acides gras de Kerner. Il a appelé cette bactérie Bacillus botulinus, qui est aujourd’hui connue sous le nom de Clostridium botulinum [3]. En 1905, Tchitchikane identifie la neurotoxine. A la demande de l’armée américaine, Eduard J. Schantz s’est penché sur la structure de la protéine dès la Seconde Guerre mondiale, lorsqu’il est apparu que plusieurs pays possédaient des capacités et des projets d’utilisation d’armes chimiques et biologiques. Ses recherches sur la structure des protéines et leur mécanisme d’action ont jeté les bases de l’utilisation actuelle de la toxine comme médicament. En 1949, les recherches de Burgen devaient montrer que l’effet de la toxine était dû à une inhibition présynaptique de l’acétylcholine (chimiodénervation) et non, comme on le pensait jusqu’alors, à un blocage nerveux postsynaptique [4]. Cette découverte a ouvert la voie à des bases théoriques ultérieures pour l’application clinique de la toxine (voir ci-dessous).
En 1973, le Dr Alan Scott a été le pionnier de l’utilisation clinique de la toxine botulique (BTX) en utilisant pour la première fois la BTX chez des primates pour traiter le strabisme. Il a travaillé en étroite collaboration avec E. J. Schantz, qui était responsable de la production de la toxine. Cependant, si l’on voulait utiliser le venin comme médicament thérapeutique, y compris chez l’homme, il fallait d’abord le purifier d’autres protéines pour empêcher le plus efficacement possible la formation d’anticorps et garantir sa stabilité en cas de dilution importante. Les problèmes ont pu être résolus et c’est ainsi que huit ans après la première expérience animale sur des singes, Scott a pu publier pour la première fois l’utilisation du BTX chez l’homme sous le titre “Botulinum toxin injection of eyes muscles to correct strabismus” [5].
Vingt ans après le développement clinique du médicament, le BTX a été approuvé par la FDA américaine pour le traitement du strabisme, du blépharospasme et du spasme hémifacial. Un peu par hasard, Jean Carruthers, interne chez le Dr Scott, a découvert que les rides du côté traité des patients souffrant de blépharospasme hémifacial étaient nettement plus lisses [6]. A peu près au même moment, Bushara a découvert une réduction significative de la transpiration dans la partie du visage traitée et a publié pour la première fois un traitement possible de l’hyperhidrose axillaire par BTX [7]. Ces deux découvertes ont marqué le début de la success story d’un ancien médicament ophtalmologique aux applications thérapeutiques limitées, qui est devenu un médicament à diffusion mondiale. En Suisse, le BTX a été utilisé pour la première fois en 1997 pour traiter l’hyperhidrose focale. La première consultation d’hyperhidrose de Suisse a été créée à l’hôpital universitaire de Zurich [8]. Au fil des années, les indications de traitement esthétique ont pris de l’importance. Selon les statistiques de l’American Society for Aesthetic Plastic Surgery, 3 766 148 traitements esthétiques à base de botuline ont été effectués rien qu’aux États-Unis en 2013, sans compter le traitement de l’hyperhidrose. Cela représente une augmentation de 5680% par rapport à 1997 !
Tout le Botox® ou quoi ?
Les toxines A, B, E et F sont efficaces chez l’homme, tandis que les toxines C et D ne sont pathogènes que chez l’animal et que la toxine G n’a jamais été décrite chez l’homme ou l’animal [9]. Le BTX A est pratiquement le seul à être utilisé dans le cadre de la thérapie médicale. Le complexe de toxine botulique B, commercialisé sous le nom de marque Myobloc® en Europe et Neurobloc® aux États-Unis (Elan Pharmaceuticals, États-Unis), ne joue qu’un rôle marginal en dermatologie, en raison de sa durée d’action limitée et de la sensation de brûlure lors de l’injection.
Il existe trois produits principaux du BTX A, qui ont été testés dans le cadre d’un grand nombre d’études scientifiques précliniques et cliniques :
- Onabotulinum Toxin A : Botox®/Vistabel® (Actavis/Allergan, USA)
- Abobotulinum Toxin A : Dysport®/Azzalure® (Ipsen, UK resp. Galderma, CH)
- Incobotulinum Toxin A : Xeomin®/Bocouture® (Merz Aesthetics, D)
Botox®, Dysport® et Xeomin® sont utilisés pour les indications médicales (maladies neurologiques/hyperhidrose), Vistabel® (ou Botox aesthetics® aux États-Unis), Azzalure® et Bocouture® sont disponibles pour les indications esthétiques, les produits frères respectifs étant absolument identiques sur le plan pharmacologique et ne se distinguant que par le nom de la marque pour une meilleure identification (édition FDA). Tous les produits mentionnés ne disposent pas d’une autorisation de mise sur le marché pour chaque indication. Toutefois, cette situation est spécifique à chaque pays et ne sera donc pas abordée ici.
Les différentes toxines (onabotulinum, abobotulinum, incobotulinum) se distinguent par leur forme pharmaceutique (unités/emballage), leurs conditions de transport et leur activité biologique, comme le montre le tableau 1.
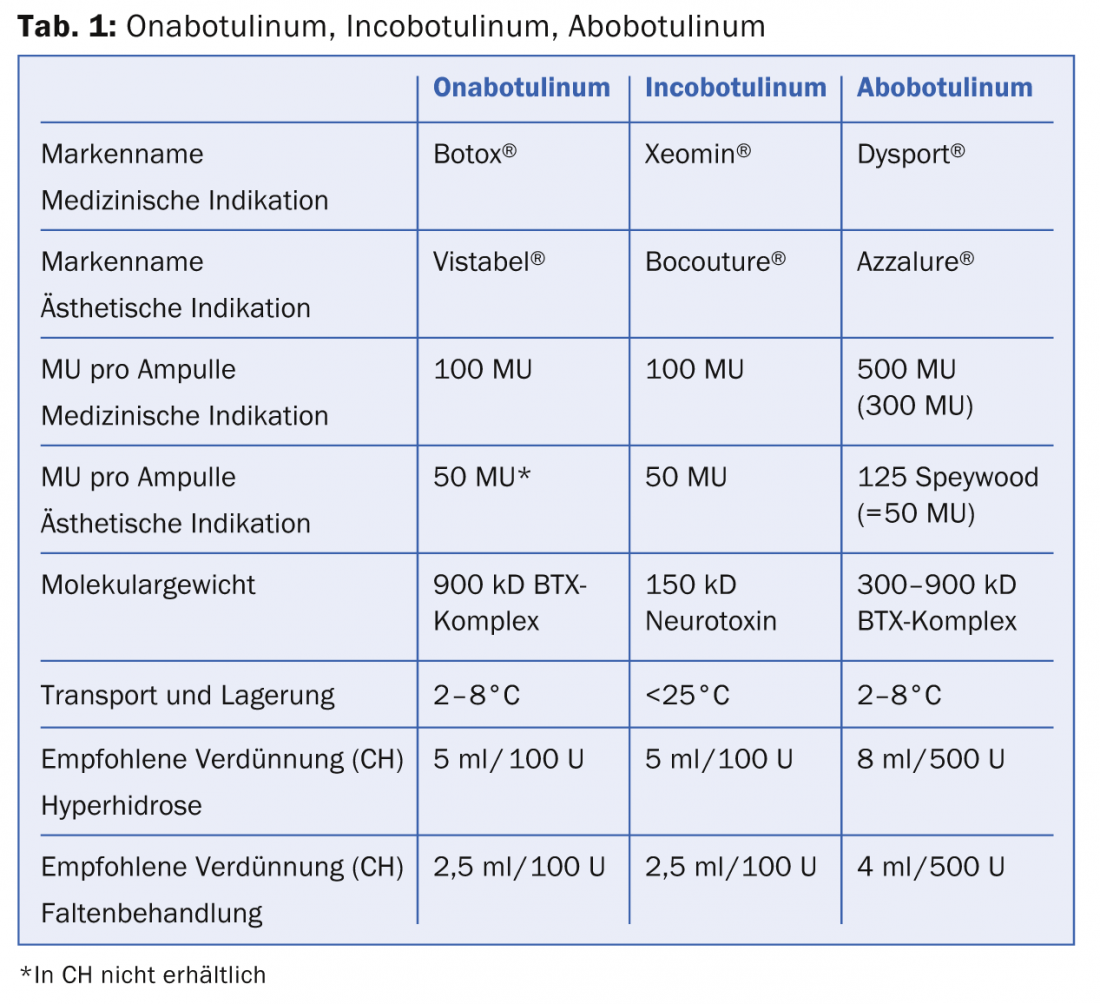
Les trois produits se présentent sous la forme d’une substance sèche cristalline et doivent être reconstitués avec du NaCl à 0,9%. Alors que l’ona- et l’abobotulinum doivent être transportés et stockés au froid, cette chaîne du froid n’est pas nécessaire pour l’incobotulinum. Toutefois, après reconstitution, tous les produits doivent être conservés au frais. L’activité biologique des trois produits est exprimée en unités de souris (MU). 1 MU correspond à 0,2X10-12 mol (picomole) de toxine et est définie comme la quantité de toxine qui se termine de manière létale pour la moitié de la population de Swiss Webster Mice femelles (18-22 g) après injection intrapéritonéale (dose létale LD50). Depuis juin 2011, Allergan est le seul concurrent à réaliser un test in vitro basé sur les cellules (CBPA, “cell based potency assay”) pour déterminer la stabilité et l’efficacité du médicament. L’onabotulinum et l’incobotulinum sont comparables en termes d’efficacité, de durée d’action et de début d’action. Incobotulinum est la seule préparation sans protéines complexes, ce qui devrait se traduire par une réduction de la réponse des anticorps neutralisants (prévention de l’échec secondaire du traitement). Il est important de noter que la dose équivalente pour l’abobotulinum (Dysport® resp. Azzalure®) n’est pas équivalente à la dose des deux autres BTX (tableau 1). Cela s’explique par le fait que différentes souches bactériennes sont utilisées pour produire le médicament et que les processus de fabrication sont différents. Le facteur de conversion de dose entre l’onabotulinum/incobotulinum et l’abobotulinum est de 1:3 (ou 1:2,5 selon les publications). Ceci est d’une importance capitale lors de la reconstitution de la toxine dans l’application clinique afin d’éviter un surdosage ou un sous-dosage. Par souci d’exhaustivité, il convient de mentionner qu’un grand nombre de produits BTX d’origine incertaine sont proposés sur le World Wide Web sous différents noms de marque. Il va sans dire que ces produits sont à proscrire.
Comment fonctionne le Botulinum ?
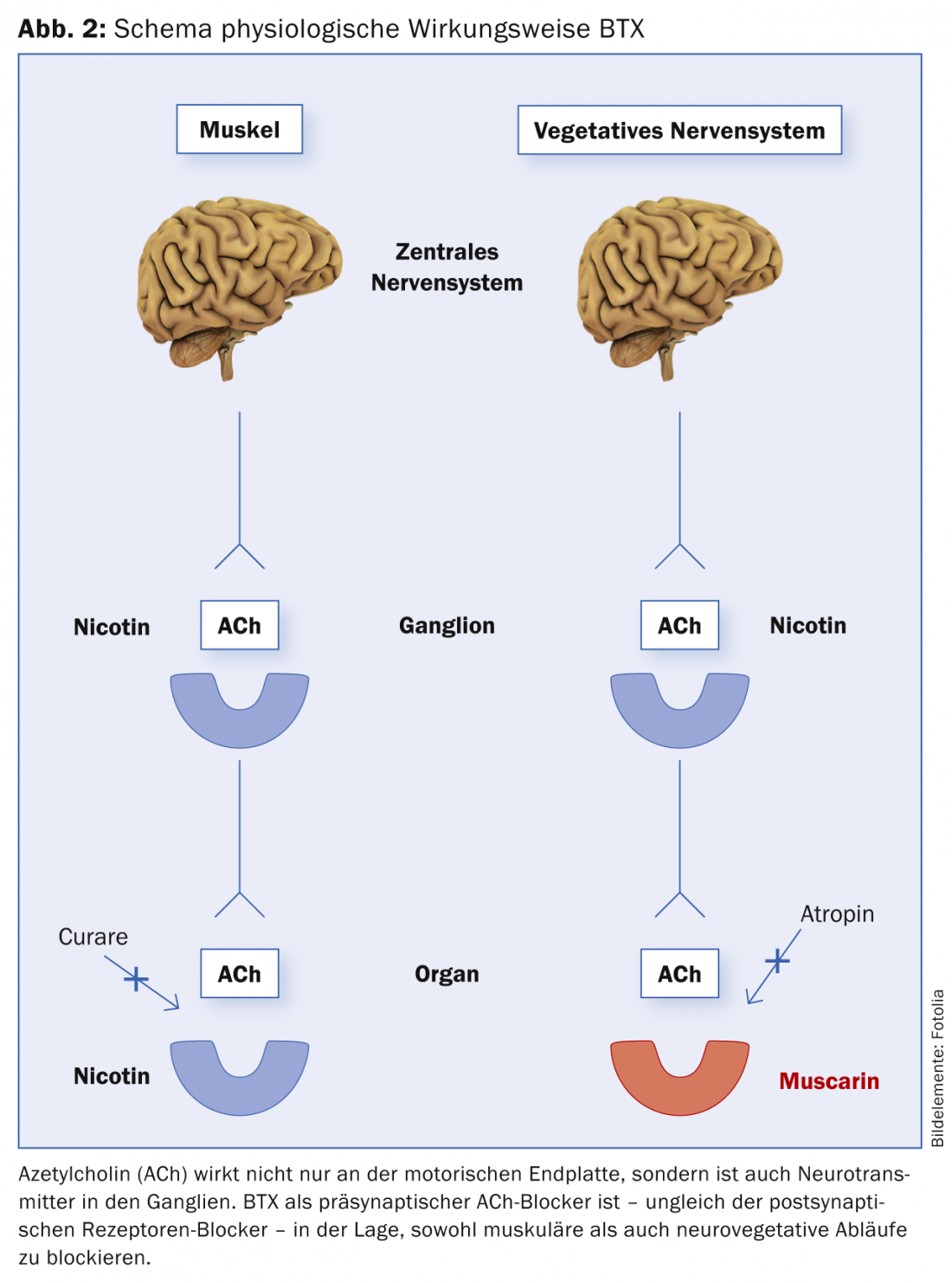
Comme mentionné précédemment, le BTX exerce un effet inhibiteur présynaptique sur la libération d’ACh au niveau de la plaque terminale neuromusculaire et neurovégétative. En d’autres termes, le muscle et le système nerveux végétatif (SNV) sont tous deux servis par le même agent de transmission (ACh). C’est pourquoi le BTX est efficace à la fois sur le muscle et sur d’autres processus contrôlés par le système végétatif (hyperhidrose, hypersalivation, indications urologiques, etc.) (Fig. 2). Et ce mécanisme d’action extrêmement spécifique du BTX est aussi la raison pour laquelle le BTX n’a pas d’effet secondaire dans l’application clinique. L’ACh est utilisé comme transmetteur uniquement dans les systèmes mentionnés.
La molécule de toxine est constituée d’une chaîne légère (chaîne L) d’un poids moléculaire de 50 kD (kilo Dalton) et d’une chaîne lourde (chaîne H) d’un poids moléculaire de 100 kD. Les chaînes sont reliées entre elles par un pont disulfure. La chaîne H est responsable de ce que l’on appelle l’internalisation : l’absorption de la toxine dans la terminaison nerveuse au niveau de la plaque terminale présynaptique. Une fois l’endocytose réalisée, la chaîne L se sépare de la chaîne H. La chaîne H est alors séparée de la chaîne L. La chaîne L clive la protéine SNAP-25, un composant de ce que l’on appelle le complexe de fusion SNARE (Soluble N-ethylmaleimide-sensitive-factor Attachment Receptor, SNARE) à différents endroits. Ainsi, la fusion de la vésicule contenant l’ACh avec la membrane n’est plus possible et, par conséquent, l’ACh n’est plus libéré de la terminaison nerveuse cholinergique [10,11]. Ainsi, l’élimination du transmetteur ACh est empêchée et il n’y a pas d’effet postsynaptique. L’effet thérapeutique est toutefois limité dans le temps, car de nouveaux nerfs se développent ultérieurement et de nouvelles connexions synaptiques sont établies.
La préparation de la solution botulique pour le traitement
Il existe plusieurs façons de dissoudre la substance sèche BTX. De nombreux auteurs choisissent une dilution de 1 ml pour 100 U Ona- et Incobotulinum resp. 500 U d’abobotulinum pour le traitement des rides d’expression dans le but d’obtenir un résultat d’injection de la toxine aussi précis que possible avec une diffusion minimale dans les muscles indésirables. Ce schéma de dissolution à faible volume et à forte concentration présente toutefois un inconvénient majeur : il est difficile de procéder à de fines gradations dans le dosage et donc de “modeler” dans une certaine mesure la dose de BTX. Si 100 U de BTX sont dissoutes dans 1 ml, 0,1 ml correspond à 10 U de BTX. La dose d’un point d’injection pour le traitement des rides d’expression se situe généralement entre 2 U et 6 U. Il faut donc une grande expérience et une main sûre pour injecter de petites doses. C’est pourquoi une dilution du BTX pour les différentes indications s’est établie comme indiqué dans les tableaux 2 et 3.
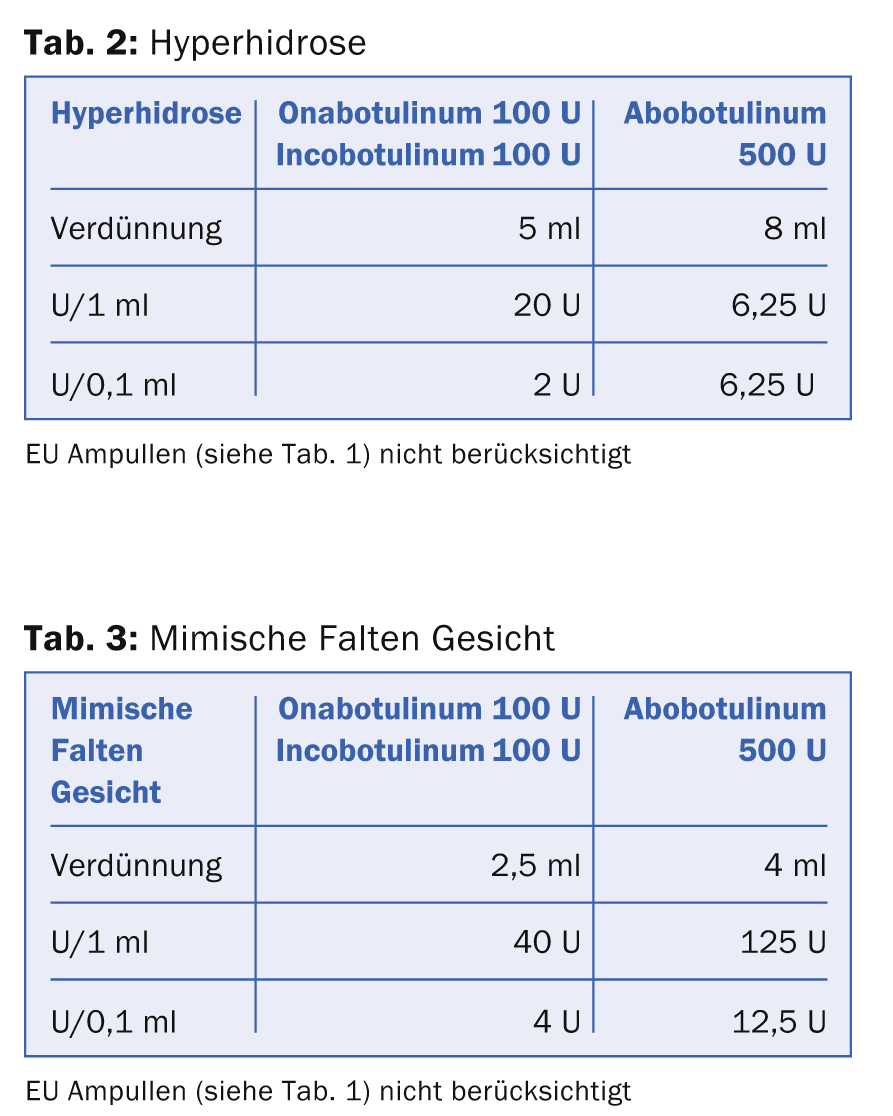
Les tableaux montrent que la dose équivalente d’ona- et de ona- est plus faible que celle d’ona- et de ona-. Incobotulinum et Abobotulinum est calculé à 1:3. La particularité de la reconstitution d’Incobotulinum est que la société recommande vivement d’incliner le flacon à plusieurs reprises après le déclenchement afin d’obtenir un effet maximal de la solution médicamenteuse.
De quel matériel ai-je besoin pour un traitement BTX ?
Le matériel nécessaire au traitement par BTX est relativement simple. Une préparation correcte et bien planifiée permet de gagner en sécurité et d’améliorer la qualité. Ou, à l’inverse, si le médecin doit rassembler tel ou tel élément avant l’intervention prévue, voire interrompre le traitement en raison d’un manque de préparation, il y a en soi des risques de traitements incorrects. Il ne faut pas oublier que nous avons affaire à un médicament très puissant. L’instruction des assistants est de la plus haute importance.
Pour un traitement BTX correct, il faut :
- 1 boîte originale de BTX (Ona-, Inco ou Abobotulinum) 100 U
- NaCl 0,9% 5 ml (hyperhidrose) resp. 2,5 ml (indication esthétique) Ona- et Incobotulinum, 8 ml resp. 4 ml d’Abobotulinum (Cave : dans l’UE, 50 U resp. 125 U Flacon disponible, donc le volume est divisé par deux)
- Seringue de 5 ml avec aiguille 18 G (rose) pour reconstitution
- Seringues à insuline (1 ml) sans aiguille rapportée avec graduation en ml
- Aiguille de 32G pour injection
- Désinfection en spray, par exemple Kodan® pour le traitement de l’hyperhidrose, ou liquide, par exemple Octenisept® pour le traitement du visage.
- Bandeau au niveau du visage
- Ustensiles pour le test de la sueur de Minor pour le traitement de l’hyperhidrose axillaire :
- Solution de Lugol (pharmacie)
- Fécule de pomme de terre (pharmacie)
- Double tamis pour une application aussi fine que possible de la fécule de pomme de terre (grand magasin)
- Crayon kajal (doux !) pour dessiner les points d’injection
- Emulsion démaquillante et possibilité de se laver après le traitement (surtout après une hyperhidrose axillaire).
Cette liste peut bien sûr être adaptée aux préférences personnelles. Les seringues usagées, les aiguilles et les flacons vides doivent être éliminés séparément ! Il s’agit d’un point à ne pas négliger ! Le BTX et ses résidus ne doivent pas être éliminés avec les déchets généraux.
A suivre…

Littérature :
- Dickson EC : Botulisme : une étude clinique et expérimentale. Rockefeller Institute for Medical Research 1918 ; 1-117.
- Kerner JC : Intoxication par des saucisses avariées. Tübinger Blätter für Naturwissenschaften und Arzneykunde 1817 ; 3 : 1-45.
- Kreyden OP, Geiges ML, Burg G : Toxine botulique : du poison au médicament. Une rétrospective historique. Dermatologue 2000 ; 51 : 733-737.
- Burgen A, Dickens F, Zatman LJ : The action of botulinum toxin on the neuromuscular junction. J Physiol 1949 ; 109 : 10-24.
- Scott AB : Injection de toxine botulique dans les muscles oculaires pour corriger le strabisme. Trans Am Ophthalmol Soc 1981 ; 79 : 734-770.
- Carruthers JD, Carruthers JA : Traitement des lignes glabellaires frown avec l’exotoxine C. botulinum-A. J Dermatol Surg Oncol 1992 Jan ; 18(1) : 17-21.
- Bushara KO, et al : Botulinum toxin–a possible new treatment for axillary hyperhidrosis. Clin Exp Dermatol 1996 Jul ; 21(4) : 276-278.
- Kreyden OP, Böni R, Burg G : Hyperhidrose et toxine botulique en dermatologie. Current Problems in Dermatology Karger 2002. ISBN 0070-2064.
- Barker WH : Botulisme. L’histoire mondiale des maladies humaines de Cambridge. Kiple, KF et Graham 1993 ; 623-625.
- Kao I, Drachman DB, Price DL : Toxine botulique : mécanisme de blocage présynaptique. Science 1976 ; 193 : 1256-1258.
- Philipp-Dormston WG : La toxine botulique en dermatologie. Le dermatologue 2014 ; 65 : 133-145.
DERMATOLOGIE PRATIQUE 2015 ; 25(1) : 29-34