Les inhibiteurs de points de contrôle se sont désormais imposés comme le nouveau standard thérapeutique dans le traitement de deuxième ligne des cancers urothéliaux métastatiques. Mais son utilisation pourrait également être utile dans le cadre d’un traitement de première ligne.
L’utilisation d’inhibiteurs de points de contrôle représente une avancée majeure dans le traitement du carcinome urothélial métastatique et constitue le nouveau standard thérapeutique après l’échec d’une chimiothérapie à base de platine. L’utilisation des inhibiteurs de points de contrôle dans le traitement de première ligne des carcinomes urothéliaux métastasés, dans le traitement périopératoire des carcinomes urothéliaux localisés et envahissant les muscles ou chez les patients atteints de carcinomes urothéliaux superficiels non envahissant les muscles n’est pas encore établie et fait l’objet d’études thérapeutiques actuelles. La cystectomie radicale reste le traitement de référence du cancer urothélial localisé de la vessie (MIBC), invasif sur le plan musculaire, surtout chez les patients jeunes en bon état général et sans comorbidité importante. Lorsqu’elle est correctement indiquée, la thérapie trimodale peut donner de très bons résultats, comparables à ceux d’une cystectomie radicale, chez les patients âgés présentant des comorbidités ou souhaitant conserver leur vessie.
Carcinomes urothéliaux superficiels “à haut risque
Lors du congrès ASCO-GU 2019 qui s’est tenu cette année à San Francisco, les premiers résultats de l’étude KEYNOTE 057, qui évalue l’utilisation d’une administration intraveineuse de pembrolizumab chez des patients atteints de carcinomes urothéliaux superficiels non invasifs dans le cadre d’une étude de phase II chez des patients réfractaires à un traitement intravésical par BCG ou qui ont récidivé après un traitement intravésical par BCG, ont été présentés [1]. Chez les 102 patients atteints de carcinome in situ ou de carcinome superficiel de haut grade Ta ou T1, une réponse complète a été obtenue chez 41/102 patients (40%), qui s’est maintenue chez 58% de ces patients pendant une période de suivi médiane de 16,7 mois. Aucun des patients n’a connu de progression avec une maladie invasive au niveau musculaire ou métastatique. Ces résultats encourageants seront examinés dans l’étude prospective randomisée de phase III KEYNOTE 676 (NCT0371032).
Traitement néoadjuvant du carcinome urothélial localisé envahissant les muscles
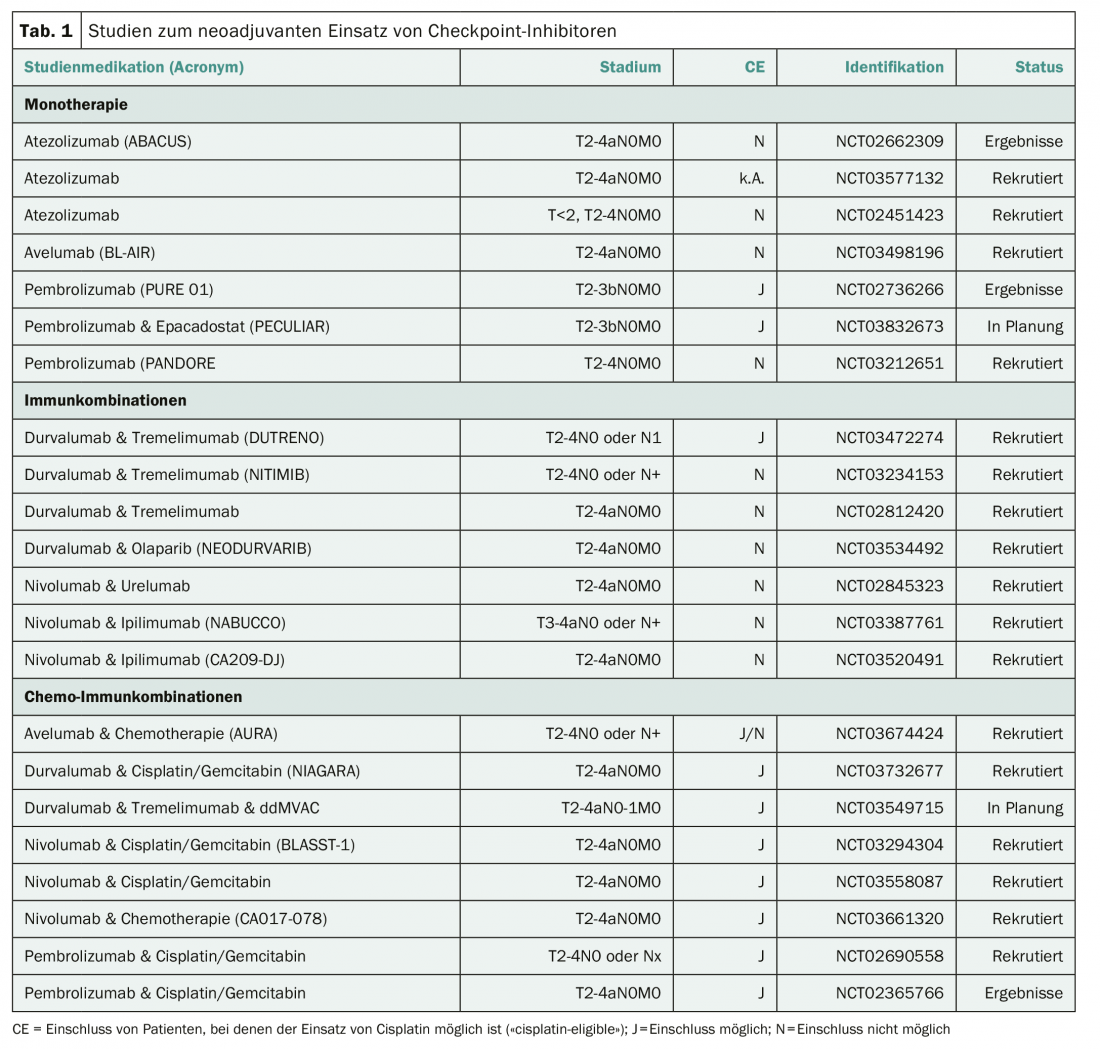
La chimiothérapie néoadjuvante à base de cisplatine est le traitement standard actuel des patients atteints de MIBC localisée. Cela permet d’obtenir un avantage de survie d’environ 5% par rapport à la cystectomie radicale seule. Cependant, comme on pouvait s’y attendre, environ 45% des patients récidiveront malgré une chimiothérapie néoadjuvante. De nombreuses études sont donc en cours pour déterminer si l’utilisation d’inhibiteurs de points de contrôle peut améliorer les résultats du traitement néoadjuvant du MIBC localisé. (tableau 1). Une première étude de phase II sur l’utilisation du pembrolizumab a déjà été publiée avec un taux de 21/52 (42%) de rémissions pathologiques complètes et un “downstaging” à un stade pathologique inférieur à T2 chez 27/52 (54%) des patients [2]. Deux études néoadjuvantes en cours sur la MIBC localisée recrutent en Suisse. A l’Hôpital de l’Île à Berne, une combinaison néoadjuvante de durvalumab et de tremelimumab est actuellement étudiée dans le cadre d’une étude prospective de phase II chez des patients pour lesquels l’utilisation du cisplatine n’est pas possible (NCT03234153). L’étude SAKK 06/17 évalue l’utilisation néoadjuvante et adjuvante de durvalumab en combinaison avec quatre cycles néoadjuvants de cisplatine plus gemcitabine en plus de la cystectomie radicale (NCT NCT03406650).
Traitement adjuvant de la MIBC après une cystectomie radicale
L’utilité d’une chimiothérapie adjuvante après une cystectomie radicale d’une MIBC est controversée. La plus grande étude prospective randomisée n’a pas montré d’avantage de survie par rapport à une cystectomie radicale seule, que ce soit chez les patients nodaux positifs ou nodaux négatifs [3]. C’est pourquoi la motivation est grande pour étudier les inhibiteurs de point de contrôle également en situation adjuvante après une kystectomie radicale (tab. 2). Les résultats de ces études ne sont pas encore disponibles. Deux centres en Suisse (Bâle et Zurich) recrutent dans l’étude Checkmate 274 (NCT02632409).

Alternatives à la cystectomie radicale
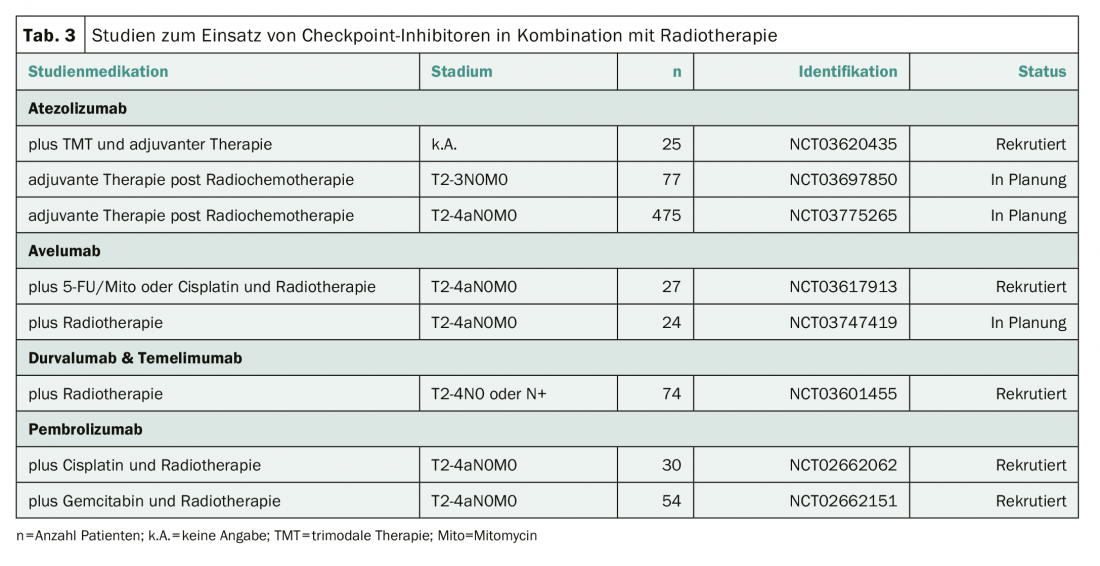
Le traitement trimodal constitue une alternative thérapeutique valide pour les patients chez qui une cystectomie radicale ne peut être réalisée ou qui souhaitent conserver leur vessie [4]. Il est possible que les inhibiteurs de points de contrôle puissent également aider à améliorer les résultats thérapeutiques dans cette situation. Plusieurs études examinent donc l’utilisation d’inhibiteurs de points de contrôle en combinaison avec une radiothérapie, ou comme extension d’un traitement trimodal (tableau 3). Aucune de ces études ne recrute actuellement en Suisse.
Traitement de première ligne des cancers urothéliaux métastatiques
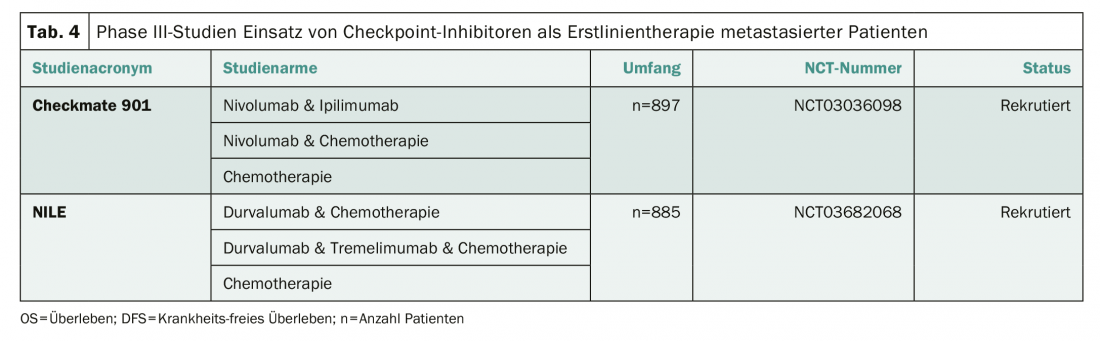
Le traitement standard des cancers urothéliaux métastatiques reste un traitement combiné à base de cisplatine, même si les études KEYNOTE 361 (NCT02853305) et IMvigor 130 (NCT02807636) rendent probable le bénéfice d’une inhibition des points de contrôle, en particulier chez les patients présentant une expression élevée de PD-L1 [5,6]. L’Agence européenne des médicaments le rappelle expressément dans un éditorial [7]. Deux études de phase III étudient actuellement l’utilisation d’inhibiteurs de points de contrôle en complément ou en alternative à la chimiothérapie à base de cisplatine (tableau 4). Deux centres en Suisse (Baden et Coire) recrutent dans l’étude Checkmate 901 (NCT03036098).
Traitement de deuxième ligne des cancers urothéliaux métastatiques
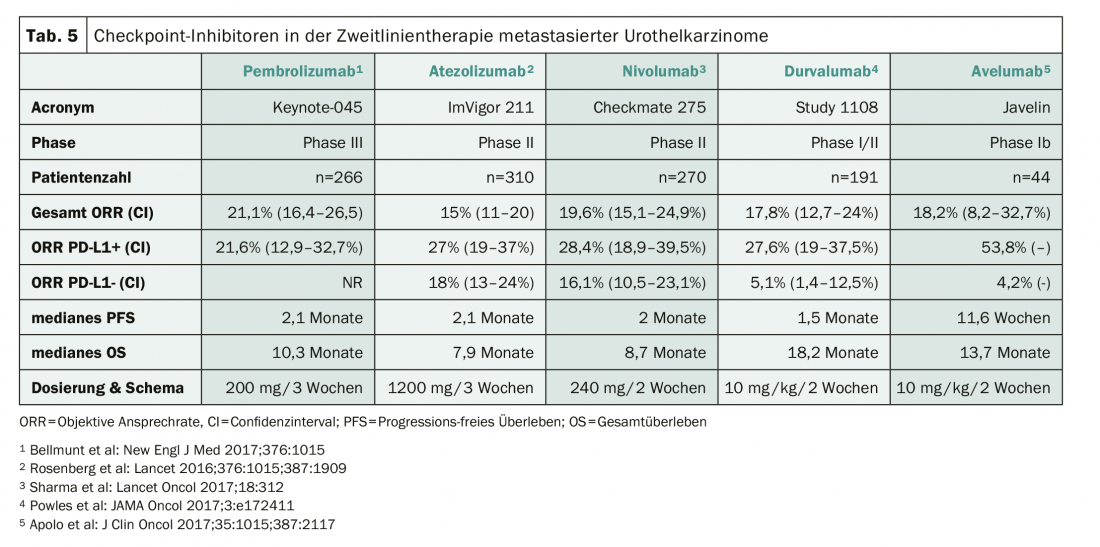
Les inhibiteurs de points de contrôle représentent le nouveau standard dans le traitement de deuxième ligne du carcinome urothélial après l’échec d’un traitement préalable à base de platine. Cinq substances ont été étudiées dans des essais cliniques avancés (tableau 5). Après l’échec des inhibiteurs de points de contrôle, une combinaison de docétaxel et de ramucirumab peut être utilisée et conduire à un contrôle temporaire de la tumeur [8].
Littérature :
- Balar VA, et al. : Keynote 057 : Phase II trial of pembrolizumab (pembro) for patients (pts) with high-risk (HR) nonmuscle invasive bladder cancer (NMIBC) unresponsive to bacillus calmette-guérin (BCG).J Clin Oncol 2019 ; 37 : (suppl 7S ; abstr 350) .
- Necchi A, et al : Pembrolizumab as Neoadjuvant Therapy Before Radical Cystectomy in Patients With Muscle-Invasive Urothelial Bladder Carcinoma (PURE-01) : An Open-Label, Single-Arm, Phase II Study. J Clin Oncol 2018 ; 36:3353-3360.
- Sternberg C, et al : Immediate versus deferred chemotherapy after radicalcystectomy in patients with pT3-pT4 or N+ M0 urothelial carcinoma of the bladder (EORTC 30994) : an intergroup, open-label, randomised phase 3 trial. Lancet Oncol 2015 ; 16 : 76-86.
- James N, et al : Radiothérapie avec ou sans chimiothérapie dans le cancer musculo-invasif de la vessie. N Engl J Med 2012 ; 366:1477-88.
- Powles T, et al : KEYNOTE-361 : Essai de phase 3 de pembrolizumab ± chimiothérapie versus chimiothérapie seule dans le cancer urothélial avancé. Eur Urol Suppl 2018 ; 17 (2) : e1147.
- Galsky, et al. : IMvigor130 : Une étude randomisée de phase III évaluant l’atezolizumab (atezo) de première ligne (1L) en monothérapie et en association avec une chimiothérapie à base de platine (chimio) chez des patients (pts) atteints de carcinome urothélial localement avancé ou métastatique (mUC). J Clin Oncol 36, 2018 (suppl ; abstr TPS4589).
- Gourd E : EMA restreint l’utilisation des médicaments anti-PD-1 pour le cancer de la vessie. Lancet Oncol 2018 ; 19 : e341.
- Petrylak DP, et al. : Ramucirumab plus docetaxel versus placebo plus docetaxel chez les patients atteints de carcinome urothélial localement avancé ou métastatique après un traitement à base de platine (RANGE) : un essai randomisé en double aveugle de phase 3. Lancet 2017 ; 390 : 2266-2277.
InFo ONKOLOGIE & HÉMATOLOGIE 2019 ; 7(2-3) : 26-29