La coloscopie est l’étalon-or du dépistage du cancer colorectal (CCR), elle permet de prévenir 70 à 80% des CCR. La coloscopie de dépistage est prise en charge par l’assurance maladie pour les personnes à risque moyen à partir de 50 ans et tous les dix ans. Les personnes présentant un risque élevé ont besoin d’un programme de dépistage plus strict et adapté à leurs besoins. Actuellement, il n’existe pas de programme de dépistage du CCR organisé au niveau national ou cantonal, mais c’est un objectif à atteindre.
Le cancer colorectal (CCR) est la troisième maladie cancéreuse la plus fréquente dans le monde et la deuxième cause de décès par cancer dans les pays occidentaux. En Suisse, environ 4000 nouveaux cas de CCR sont diagnostiqués chaque année et près de la moitié des patients en meurent [1]. Le risque de développer un CCR en tant qu’Européen est d’environ 5%. La plupart des cas sont sporadiques, mais certains facteurs augmentent le risque de développer la maladie, par exemple une prédisposition familiale, un syndrome héréditaire (syndrome de Lynch [HNPCC], polypose adénomateuse familiale [FAP]) ou des maladies inflammatoires de l’intestin comme la maladie de Crohn ou la colite ulcéreuse ; environ 15% de tous les patients atteints de CCR font partie du groupe à risque accru. L’âge, l’obésité, le diabète et le tabagisme sont également considérés comme des facteurs de risque avérés, mais l’alimentation et l’activité physique jouent également un rôle.
Le CCR peut être guéri à un coût relativement faible à un stade précoce, d’où l’importance du dépistage précoce et du traitement des lésions précancéreuses. En cas de CCR métastasé, des chimiothérapies plus coûteuses sont souvent utilisées et les chances de guérison sont faibles. La plupart des CCR se développent à partir d’adénomes qui subissent une transformation maligne sur une période de latence d’une dizaine d’années en raison de nombreuses mutations, la séquence adénome-carcinome (Fig. 1) [2].
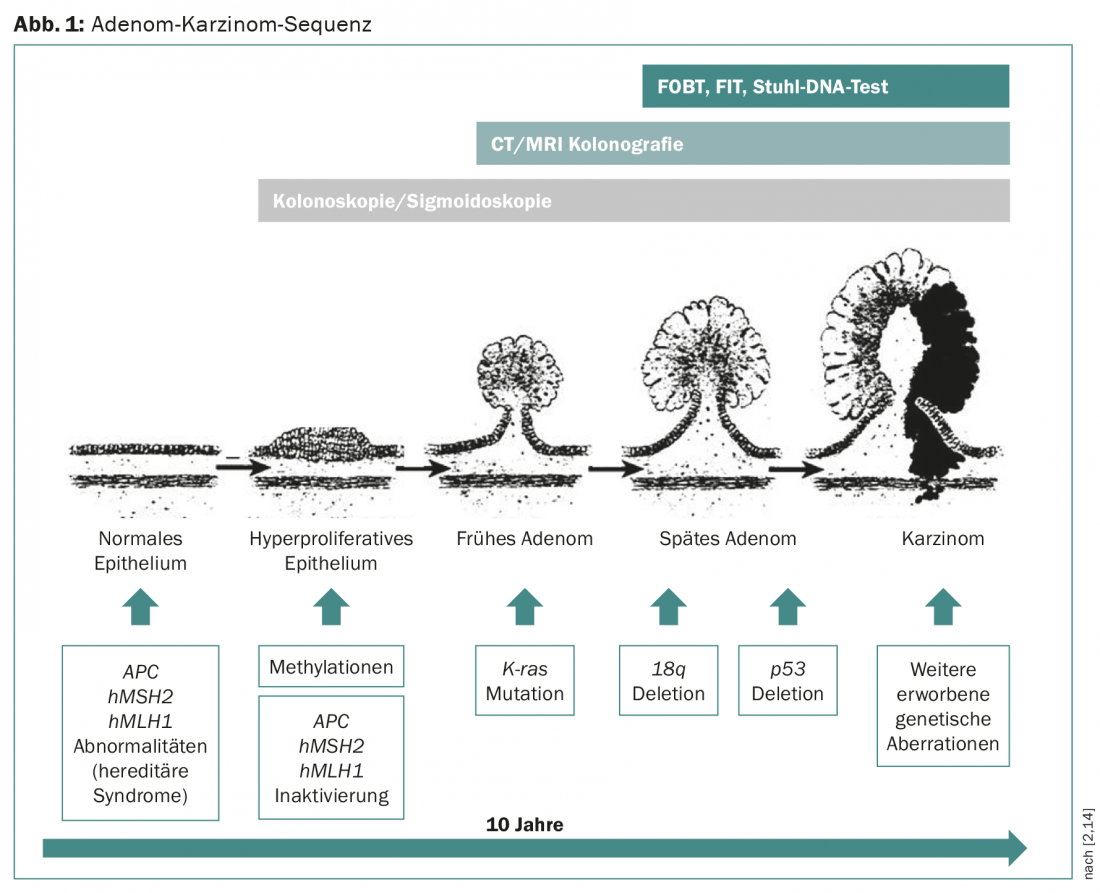
Ces lésions précancéreuses pouvant être traitées, la prévalence élevée du CCR et le bon pronostic des tumeurs détectées à un stade précoce constituent des conditions idéales pour les examens de dépistage. Deux méthodes de dépistage ont montré dans des études randomisées qu’elles étaient efficaces pour réduire le risque de mortalité par CCR dans la population à risque moyen : le test de détection de sang occulte dans les selles [3] et la sigmoïdoscopie flexible [5–7]. Les tests de dépistage utiles doivent être acceptables pour les personnes en bonne santé, présenter une sensibilité et une spécificité aussi élevées que possible et être rentables. Les différents tests de dépistage du CCR sont décrits ci-dessous (tableau 1).

Détection de sang occulte dans les selles (FOBT/FIT)
Le FOBT/FIT est le test de dépistage du CCR le plus couramment utilisé. Il est peu coûteux, non invasif et facile à réaliser. On distingue le test de la guaïa (FOBT), qui détecte l’activité de la peroxydase avec l’hémoglobine, et les méthodes immunochimiques (FIT), qui utilisent des anticorps spécifiques pour détecter l’hémoglobine humaine dans les selles. Plusieurs études randomisées utilisant le test au gaïac ainsi qu’une méta-analyse Cochrane ont démontré une réduction de 16% du risque relatif de mortalité [3]. Un inconvénient majeur de cette méthode est sa faible sensibilité pour les carcinomes (25-38%) et les adénomes avancés (16-31%) [4]. Cela signifie que le test est faux-négatif dans plus de 60% des cas. En outre, le test n’est efficace que s’il est effectué régulièrement (1-2×/an avec trois échantillons à chaque fois). Si le résultat du test est positif, une investigation endoscopique est nécessaire. Les méthodes immunochimiques, plus coûteuses, présentent une meilleure sensibilité que le test au gaïac, mais au prix d’une spécificité légèrement inférieure.
Sigmoïdoscopie
Plusieurs études randomisées [5–6] ainsi qu’une méta-analyse [7] ont montré que le dépistage par sigmoïdoscopie flexible (FS) réduit la mortalité du CCR de 22-31% et l’incidence de 18-23%. L’un des principaux problèmes de cette méthode de détection précoce est le fait que les carcinomes et les adénomes avancés situés à proximité du sigmoïde ne sont pas détectés. Une méta-analyse récemment publiée a démontré que chez 58% des patients présentant des adénomes proximaux, on ne trouve pas de lésion distale supplémentaire qui aurait pu inciter à une colonoscopie [8]. De même, la combinaison de la FS et du test de sang occulte dans les selles (dans le but de mieux détecter les lésions proximales manquées) n’est pas supérieure à la sigmoïdoscopie seule. Le risque de complications de la FS est faible et la compliance de l’examen est meilleure que celle de la coloscopie, car la préparation de l’intestin est moins rigoureuse.
Coloscopie
La colonoscopie présente l’avantage de pouvoir visualiser l’ensemble de la muqueuse colorectale et de permettre également des biopsies et l’ablation de polypes en une seule procédure. Lorsqu’elle est réalisée par des examinateurs expérimentés, la coloscopie de dépistage atteint une sensibilité et une sensibilité proches de 100% [9]. Il est donc considéré comme l’étalon-or de tous les examens de détection précoce du CCR. Toutefois, contrairement au test de la guaïac et à la sigmoïdoscopie, il n’existe pas à ce jour d’études randomisées ayant démontré une réduction de la mortalité et de l’incidence du CCR comme critère d’évaluation principal. Une étude de cohorte américaine de 1993 a montré une réduction de 76-90% de l’incidence du CCR par la colonoscopie avec polypectomie [10]. Trois études randomisées sur le dépistage par coloscopie sont actuellement en cours et portent sur l’impact sur l’incidence et la mortalité du CCR (COLONPREV Study, NordICC Study, CONFIRM Trial). Les résultats ne sont toutefois pas attendus avant cinq à sept ans. La colonoscopie est recommandée comme examen de dépistage par la plupart des organisations européennes et américaines, à partir de 50 ans en cas de risque moyen, avec un intervalle de dix ans maximum. Comme l’examen est invasif et nécessite une préparation intestinale rigoureuse, le taux de conformité de la population est faible.
Colonoscopie virtuelle (colonographie par scanner ou IRM)
La colonoscopie virtuelle a été développée pour contourner la technique invasive de l’endoscopie et améliorer ainsi l’observance du dépistage du CCR. Toutefois, en cas de résultats positifs, une endoscopie doit être réalisée afin de vérifier et de traiter les résultats pathologiques. En outre, cette méthode nécessite également une préparation intestinale et une dilatation colique avec un liquide ou de l’air pendant l’examen. Si l’endoscopie ne peut pas être imposée au patient, la coloscopie virtuelle constitue une alternative.
Test d’ADN dans les selles/tests génétiques
Le test ADN dans les selles repose sur le fait que certaines modifications de l’ADN (méthylations, mutations) qui se produisent dans les cellules tumorales lors de la carcinogenèse peuvent être détectées dans les selles. Ces tests ADN multicibles ont une assez bonne spécificité, mais une faible sensibilité. Il n’existe aucune étude montrant une réduction de la mortalité avec cette procédure. Actuellement, le test d’ADN fécal n’est pas utilisé en routine.
Depuis peu, le test Colox®, développé en Suisse, est disponible en tant que test de dépistage sanguin non invasif du CCR. Il s’agit d’analyser la signature génétique de 29 gènes dans les cellules mononucléaires du sang périphérique (PBMC). Grâce à l’interaction tumeur-hôte, les PBMC stockent des informations sous forme d’acides nucléiques qui apparaissent dans les premières phases du développement tumoral dans le cadre de la réponse de l’hôte. Le test présente une bonne spécificité pour la détection des adénomes et des carcinomes, mais sa sensibilité est faible, en particulier pour les lésions précancéreuses. Là encore, il n’existe pas encore d’études montrant une réduction du risque de mortalité.
Dépistage chez les personnes à risque moyen
On considère que les personnes âgées de 50 ans et plus sans antécédents de polypes ou de CCR et ayant des antécédents familiaux négatifs présentent un risque moyen de CCR. Selon les directives de plusieurs organisations internationales [11] et de la Ligue suisse contre le cancer [12], le dépistage est recommandé à partir de 50 ans et jusqu’à 75 ans. Il est recommandé d’effectuer une colonoscopie tous les dix ans, une colonoscopie virtuelle tous les cinq ans ou une sigmoïdoscopie tous les cinq ans. Pour les personnes chez qui ces méthodes ne sont pas envisageables, le test Guajaktest est proposé à un intervalle d’un à deux ans, suivi d’une colonoscopie en cas de résultat positif.
Dépistage chez les personnes présentant un risque accru
Il n’existe pas de données d’études randomisées et contrôlées sur le dépistage des personnes à risque. Les recommandations sont basées sur les opinions de groupes d’experts [11]. En raison du risque accru, le dépistage devrait être effectué par coloscopie, plus tôt et à des intervalles plus fréquents.
Maladies inflammatoires de l’intestin : Une coloscopie est recommandée tous les un à deux ans à partir de huit à dix ans environ après le diagnostic.
Antécédents personnels de polypes (risque accru de développement d’un CCR) : Pour les polypes à faible risque, une colonoscopie est recommandée cinq ans après la polypectomie initiale, puis tous les dix ans si les résultats sont négatifs. Pour les adénomes à haut risque (>1 cm, 3-10 polypes, dysplasie de haut grade), une coloscopie est recommandée trois ans après la polypectomie, puis tous les cinq ans.
Risque élevé de CCR en raison d’antécédents familiaux : les examens suivants sont recommandés en cas de risque élevé (adénome/carcinome chez un parent au premier degré avant l’âge de 60 ans ou adénome/carcinome chez deux parents au premier degré) :
- Coloscopie tous les dix ans à partir de 50 ans si un adénome avancé ou un carcinome a été diagnostiqué chez un parent au premier degré à l’âge de >60 ans.
- Coloscopie tous les cinq ans à partir de l’âge de 40 ans ou de l’âge inférieur de dix ans à celui du parent malade au moment du diagnostic, si un adénome avancé ou un carcinome a été diagnostiqué chez un parent au premier degré à l’âge de <60 ans.
Statut après CCR : une première coloscopie dans les douze premiers mois suivant la fin du traitement définitif (chirurgie avec/sans chimiothérapie adjuvante), puis tous les cinq ans.
Syndromes héréditaires (HNPCC, PAF) : selon les données des études d’observation, les colonoscopies annuelles sont recommandées à partir de l’âge de 20 à 25 ans. Il est recommandé d’utiliser le test de dépistage avant l’âge de 50 ans en cas de syndrome de Lynch. Pour les patients présentant une polypose dans le cadre d’une PAF avérée, une colectomie précoce doit être effectuée dans la mesure du possible, avant quoi il est recommandé de procéder à une coloscopie annuelle.
Prise en charge des coûts
En Suisse, depuis juillet 2013, les frais de dépistage du CCR pour les personnes âgées de 50 à 69 ans présentant un risque moyen sont pris en charge par l’assurance maladie obligatoire (sans exonération de la franchise et de la quote-part). Cela inclut le coût d’une recherche de sang occulte dans les selles tous les deux ans ou d’une coloscopie tous les dix ans.
Conclusions
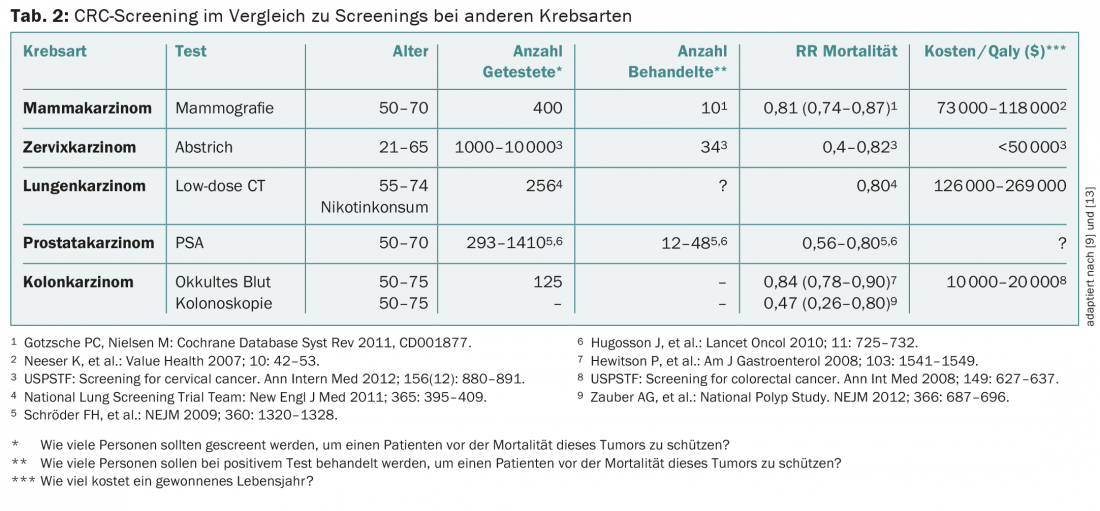
Le dépistage du CCR est une méthode efficace et importante de détection précoce de l’un des cancers les plus fréquents, qui peut être bien traité grâce à un dépistage précoce et qui a donc un bon pronostic. En tant que gold standard, la coloscopie présente la meilleure spécificité et sensibilité de toutes les méthodes de dépistage, mais la compliance de la population est encore trop faible. Or, la coloscopie permettrait de prévenir 70 à 80% des cancers du côlon. Comparé à d’autres méthodes de dépistage, le dépistage du CCR est efficace et d’un coût raisonnable (tableau 2). Un programme de dépistage organisé au niveau cantonal ou national, comme pour le cancer du sein, devrait être envisagé.
Littérature :
- Office fédéral de la statistique
- Vogelstein B, et al : Altérations génétiques au cours du développement des tumeurs colorectales. NEJM 1988 ; 319 : 525-532.
- Hewitson P, et al. : Dépistage du cancer colorectal à l’aide du test sanguin occulte fécal, Hemoccult. Cochrane Database Syst Rev 2007 ; 1 : CD001216.
- Whitlock EP, et al : Screening for colorectal cancer. A targeted, updated systemic review fort he U.S. Preventive Services Task Force. Ann Intern Med 2008 ; 149 : 638-658.
- Atkin WS, et al : Dépistage par sigmoïdoscopie flexible en une seule fois dans la prévention du cancer colorectal : un essai contrôlé randomisé multicentrique. Lancet 2010 ; 375 : 1624-1633.
- Schoen RE, et al : incidence du cancer colorectal et mortalité avec la sigmoïdoscopie flexible de dépistage. NEJM 2012 ; 366 : 2345-2357.
- Elmunzer BJ, et al : Effect of Flexible Sigmoidoscopy-Based Screening on Incidence and Mortality of Colorectal Cancer : A Systemic Review and Meta-Analysis of Randomized Controlled Trials ; PLoS Med 9(12) : e1001352.
- Dodou D, de Winter JC : The relationship between distal and proximal colonic neoplasia : a meta-analysis. J Gen Intern Med 2012 ; 27 : 361-370.
- Levin B, et al : Screening and surveillance for the early detection of colorectal cancer and adenomatous polyps, 2008 : a joint guideline from the American Cancer Society, the US Multi-Society Task Force on Colorectal Cancer and the American College of Radiology. Gastroenterology 2008 ; 134 : 1570-1595.
- Winawer SJ, et al : Prevention of colorectal cancer by colonoscopic polypectomy. Le groupe de travail national d’étude des polypes. NEJM 1993 ; 329 : 1977-1981.
- NCCN guidelines for colorectal cancer screening, version 1.2014 ; American College of Gastroenterology 2009 guidelines. Am J Gastroenterol 2009 ; 104 : 739 ; American Cancer Society (recommandations pour la détection précoce du cancer colorectal) ; ESMO, ASCO.
- www.krebsliga.ch/de/praevention/pravention_krebsarten/darmkrebs/fruherkennung
- Misselwitz B, et al : Méthylation de l’ADN et dépistage du cancer du côlon. Forum Med Suisse 2011 ; 11(6) : 103-107.
- Walther A, et al : Marqueurs génétiques pronostiques et prédictifs dans le cancer colorectal. Nature Reviews Cancer 2009 ; 9(7) : 489-499.
InFo ONKOLOGIE & HÄMATOLOGIE 2015 ; 3(8) : 7-10











