Tous les patients atteints de thromboembolie veineuse ne présentent pas un risque accru de récidive. Ceux qui présentent un risque élevé bénéficient de la poursuite de l’anticoagulation. Pour calculer le risque de deuxième thrombose, il convient de recenser les facteurs de risque et de calculer le risque absolu de récidive. Celui-ci doit être comparé à l’hémorragie grave due à l’anticoagulant et, si le risque de récidive prévaut, l’anticoagulation doit être poursuivie.
La thromboembolie veineuse (TEV) comprend la thrombose veineuse profonde (TVP) et l’embolie pulmonaire. Le risque absolu de survenue d’une première thrombose veineuse dans la population générale est de 0,1 à 0,2% par an et dépend de l’âge. Le risque de récidive après une thrombose est de 5 à 7% par an, ce qui est 50 à 70 fois plus élevé que le risque de thrombose veineuse initiale [1]. Il est donc important de pouvoir évaluer le risque de récidive chez un patient individuel, car la poursuite de l’anticoagulation (AC) peut prévenir efficacement les récidives. La durée de l’AK après le traitement initial fait depuis longtemps l’objet de controverses. En se basant sur de nombreuses études et méta-analyses, la 9e conférence de consensus ACCP de 2012 a abouti aux recommandations présentées dans le tableau 1 pour la durée de la CA [2].

Le risque de récidive de thrombose après la fin de l’AC dépend principalement de deux facteurs :
- L’épisode aigu de TEV a-t-il été traité efficacement, avec une durée minimale d’AC ?
- Existe-t-il des facteurs intrinsèques entraînant un taux de récidive plus élevé ?
AC à long terme – qu’est-ce que c’est ?
En cas de TVP proximale spontanée avec ou sans maladie tumorale et en cas de thromboses récidivantes, une AC à long terme est recommandée. L’AC à long terme est un terme vague. Quelle est la durée du traitement ? A long terme ne signifie pas à vie. La 9e conférence de consensus de l’ACCP recommande que la durée de l’AC soit déterminée en fonction d’une évaluation individuelle du rapport bénéfice/risque. Il n’est pas possible de donner ici une valeur de référence qui serait valable de la même manière pour tous les patients. Le médecin traitant et le patient concerné sont donc en grande partie laissés seuls pour décider de la durée de l’AC.
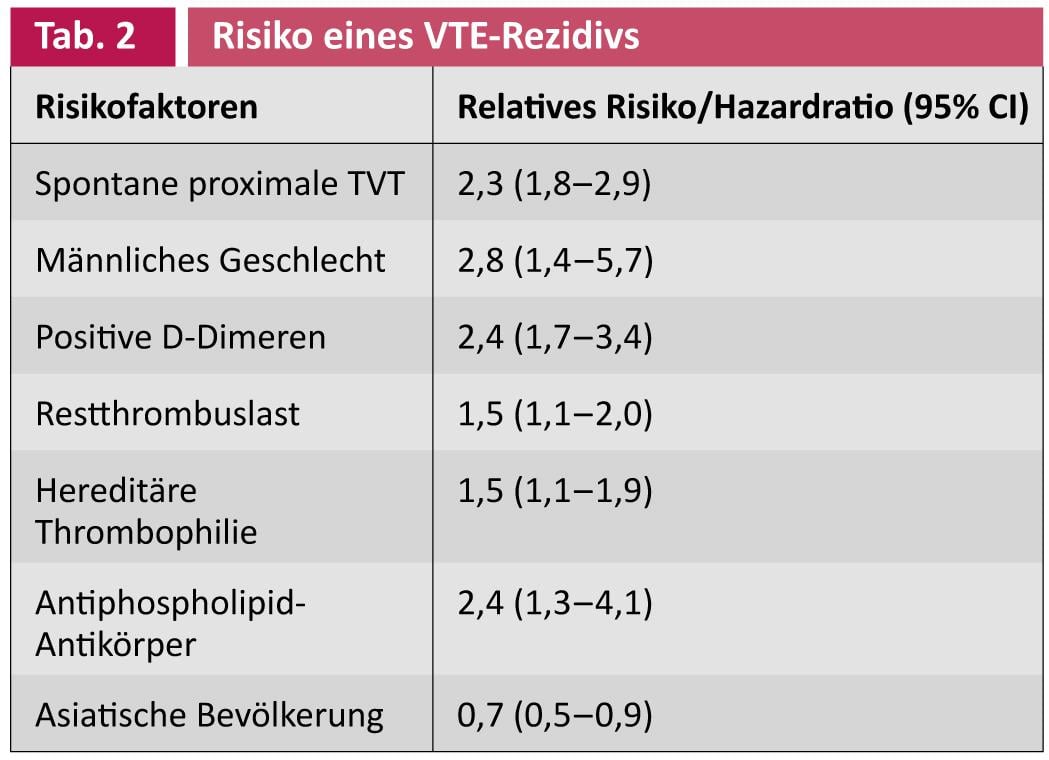
L’incidence d’une hémorragie grave sous anticoagulant est de l’ordre de 1-4%/an avec une hémorragie intracérébrale de 0,4-1,5% selon la littérature et la population à risque. Les facteurs de risque suivants ont été associés à une augmentation des saignements : Âge >65 ans, antécédents de saignement, maladie tumorale avec ou sans métastases, insuffisance rénale, insuffisance hépatique, thrombocytopénie, accident vasculaire cérébral récent, diabète sucré, anémie, sous co-médication avec des antiagrégants plaquettaires, contrôle difficile des AC, abus d’alcool, chutes fréquentes, chirurgie récente, comorbidité et capacité fonctionnelle réduite [3]. Le tableau 2 présente les facteurs de risque pertinents pour la thrombose récidivante et est expliqué plus en détail ci-dessous.
TVP proximale spontanée
Il est connu depuis de nombreuses années que les patients présentant une TVP proximale spontanée et/ou une embolie pulmonaire après l’arrêt de l’AC par voie orale ont un risque beaucoup plus élevé de récidive de thrombose que les patients présentant une thrombose initiale provoquée. Dans une étude de cohorte, Prandoni et al. chez 1 626 patients ayant présenté une TVP proximale ou une embolie pulmonaire spontanée ou provoquée après l’arrêt de l’AC, a montré qu’après un suivi médian de 50 mois, 22,3% des patients avaient présenté une thrombose récidivante après cette période. Les patients ayant subi une thrombose initiale spontanée présentaient le risque le plus élevé de récidive de thrombose, avec un hazard ratio de 2,3 (IC 95%, 1,8-2,9) par rapport aux patients ayant subi une thrombose provoquée [4].
Sexe masculin
Plusieurs études ont montré que le risque de récidive de TEV est plus élevé chez les hommes que chez les femmes. Dans une étude prospective portant sur 474 patients présentant une première TVP proximale spontanée ou provoquée avec un suivi de 3477 personnes-années (7,3 ans en moyenne), le risque de récidive était de 4,1% personnes-années chez les hommes et de 1,6% personnes-années chez les femmes. Les hommes présentant une première thrombose proximale spontanée avaient un risque de récidive 2,8 fois plus élevé (IC 95%, 1,4-5,7) que les femmes [5].
D-dimères
Plusieurs études ont montré que les patients qui développent des D-dimères positifs un mois après l’arrêt de l’AC par voie orale présentent un risque accru de récidive. L’étude d’intervention randomisée et contrôlée PROLONG a montré que les patients présentant une TVP proximale spontanée et un test de D-dimères positif un mois après l’arrêt de l’AC bénéficiaient d’un redémarrage de l’AC [6]. Dans PROLONG, les AC ont été arrêtés chez 608 patients après au moins trois mois et les D-dimères ont été mesurés après un mois. Dans 36,8% des cas, les D-dimères étaient élevés. La CA n’a pas été reprise chez les patients dont les D-dimères étaient négatifs. Les patients présentant des D-dimères élevés ont été randomisés en deux groupes : Le premier groupe a reçu l’AC pendant 18 mois supplémentaires, tandis que l’AC n’a pas été repris dans l’autre groupe présentant des D-dimères positifs. Après un suivi moyen de 1,4 an, 6,2% des patients qui présentaient des D-dimères négatifs au départ ont récidivé. Les patients présentant des D-dimères élevés sans poursuite de l’AC ont présenté une récidive de thrombose dans 15,0% des cas. Les patients dont le test des D-dimères était positif et qui ont repris la CA ont présenté une récidive de thrombose dans 2,9% des cas. L’hazard ratio pour les patients avec un test de D-dimères positif sans AK était 4,3 fois (IC 95%, 1,2-14,6) significativement plus élevé que pour les patients avec un test de D-dimères positif avec AK. Les patients présentant des D-dimères élevés sans AC ont montré un risque de thrombose multiplié par 2,3 (IC 95%, 1,2-4,5) par rapport aux patients ayant un test de D-dimères négatif sans AC [6].
Une méta-analyse de quatre études sur la mesure des D-dimères après l’arrêt de l’AC, portant sur 1539 patients atteints de TEV spontanée, a confirmé les résultats de l’étude PROLONG : 16,6% des patients présentant des D-dimères élevés après l’arrêt de l’AC par voie orale ont présenté une thrombose récidivante au cours du suivi, contre 7,3% seulement des patients présentant des D-dimères normaux. La détection de D-dimères élevés était associée à un risque de récidive de TEV multiplié par 2,4 (IC 95%, 1,7-3,4) [7].
Charge thrombotique résiduelle
Après une TVP, il faut un certain temps pour que la veine soit recanalisée. Siragusa et al. ont pu montrer dans l’étude d’intervention contrôlée randomisée DACUS portant sur 258 patients présentant une TVP proximale spontanée ou provoquée qu’après trois mois d’AC, 69,8% des patients présentaient un thrombus résiduel de >40% du diamètre de la veine [8]. L’AC n’a pas été poursuivie chez les patients sans thrombus résiduel.
Les patients présentant une charge thrombotique résiduelle élevée ont été randomisés en deux groupes : Le premier groupe a reçu l’AC pendant neuf mois supplémentaires, tandis que l’autre groupe a cessé l’AC. Après deux ans de suivi, les patients qui ne présentaient pas de thrombus résiduel au départ n’ont récidivé que dans 1,3% des cas. En revanche, les patients présentant une charge thrombotique résiduelle élevée sans poursuite de l’AC ont présenté une récidive de thrombose dans 27,2% des cas. Les patients présentant des thrombus résiduels et poursuivant l’AC pendant neuf mois supplémentaires ont présenté une récidive de thrombose dans 19% des cas après deux ans. L’hazardratio pour les patients avec une charge thrombotique élevée sans AK était significativement 24,9 fois (IC 95%, 3,4-183,6) plus élevé que pour les patients sans charge thrombotique. Il convient de noter que l’intervalle de confiance est très large, ce qui indique un certain flou/imprécision des données [8]. Une méta-analyse de 14 études avec mesure du thrombus résiduel n’a pu démontrer qu’une faible augmentation du risque de récidive (HR : 1,5, IC 95%, 1,1-2,0) [9].
Thrombophilie héréditaire
Pour les formes légères et fréquentes de thrombophilie, une méta-analyse a montré que le risque relatif de récidive est faible pour la mutation hétérozygote du facteur V Leiden, soit 1,5 (IC à 95%, 1,1-1,9), et pour la mutation hétérozygote de la prothrombine, soit 1,4 (IC à 95%, 1,0-1,8). En raison de la faible augmentation du risque de récidive, une AK prolongée n’est pas justifiée en soi [10]. Dans l’analyse Cochrane de 2009, il n’existe pas d’études randomisées et contrôlées évaluant l’utilité du dépistage de la thrombophilie pour évaluer le risque de récidive [11]. Une mise à jour en 2012 n’a toujours pas révélé d’études contrôlées, de sorte qu’aucune recommandation claire ne peut être faite à ce sujet pour le moment [12].
Anticorps antiphospholipides
Les patients atteints du syndrome des antiphospholipides présentent un risque de thrombose récidivante nettement plus élevé. Pengo et al. ont montré, dans une étude rétrospective de 160 patients atteints du syndrome des antiphospholipides, que le risque de récidive de thrombose était significativement augmenté de 2,4 fois (IC 95%, 1,3-4,1) chez les patients dont l’AC avait été arrêtée, par rapport à ceux qui avaient été anticoagulés au long cours [13].
Malignome
Les patients atteints d’une tumeur maligne active ont un risque environ quatre fois plus élevé de TEV et un risque six fois plus élevé s’ils sont sous chimiothérapie [14]. Parallèlement, le risque de saignement est environ trois fois plus élevé. Le risque de récidive de TEV peut être supérieur à 27% par an malgré un traitement par antagonistes de la vitamine K, de sorte qu’une AC à long terme est recommandée en cas de tumeur active [15, 16].
Ethnicité
Une étude épidémiologique californienne portant sur plus de 23 000 patients atteints de TVP spontanée ou provoquée a examiné l’incidence des thromboses récidivantes dans différents groupes de population. Chez les Asiatiques, le risque de récidive était 0,7 fois plus faible que dans la population blanche (IC 95%, 0,5-0,9) [17].
Conclusion
Tous les patients atteints de TEV ne présentent pas un risque accru de récidive. Chacun des facteurs de risque énumérés ci-dessus est important pour l’évaluation du risque de récidive, mais en tant que paramètre unique (sauf en cas de tumeur maligne active), il n’est pas suffisamment spécifique en soi pour émettre une recommandation générale. Une combinaison de ces facteurs de risque pourrait être importante [18]. Prenons l’exemple d’un patient qui a été anticoagulé pendant trois mois après une TVP proximale spontanée. La question qui se pose maintenant est de savoir combien de temps la CA doit continuer à être effectuée. Les 9e lignes directrices de l’ACCP ne sont pas d’une grande aide dans ce domaine. La prise de décision concernant la durée du traitement repose sur le risque absolu de récidive. Si l’on suppose que le risque absolu de récidive est estimé de manière conservatrice à 2-4% par an et que le patient est un homme, l’augmentation du risque relatif multiplie le risque absolu par 2,8, soit environ 6-11% par an. Si l’on dispose d’autres facteurs de risque (tableau 2), ceux-ci peuvent être combinés. L’augmentation du risque de récidive à environ 6-11% par an peut déjà suffire à justifier la poursuite d’une AC et doit être mise en balance avec le risque individuel de saignements graves.
Si le patient souhaite arrêter l’AC pour la TEV après trois à douze mois, il est urgent d’envisager 100 mg d’aspirine par jour pendant trois ans, car l’AAS a permis de réduire le risque de récidive de TEV de 32% et les événements vasculaires (artériels et veineux) de 34% dans l’étude combinée ASPIRE et WARFASA, et ce sans augmentation des saignements graves. [19].
Littérature :
- White RH : L’épidémiologie de la maladie thromboembolique veineuse. Circulation 2003 ; 107 : 14-18.
- Guyatt GH, et al : Résumé exécutif : Traitement antithrombotique et prévention de la thrombose, 9e éd : American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012 ; 141 : 7S-47S.
- Kearon C, et al. : Antithrombotic therapy for VTE disease : Antithrombotic Therapy and Prevention of Thrombosis, 9th ed : American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012 ; 141 : e419S-494S.
- Prandoni P, et al : Le risque de thromboembolie veineuse récurrente après l’arrêt de l’anticoagulation chez les patients atteints de thrombose veineuse profonde proximale aiguë ou d’embolie pulmonaire. Une étude de cohorte prospective chez 1 626 patients. Haematologica 2007 ; 92 : 199-205.
- Christiansen SC, et al : Différence sexuelle dans le risque de thrombose veineuse récurrente et le profil de risque d’un second événement. J Thromb Haemost 2010 ; 8 : 2159-2168.
- 6. Palareti G, et al : Test des D-dimères pour déterminer la durée du traitement anticoagulant. N Engl J Med 2006 ; 355 : 1780-1789.
- Siragusa S, et al : Thrombose veineuse résiduelle pour établir la durée de l’anticoagulation après un premier épisode de thrombose veineuse profonde : l’étude Duration of Anticoagulation based on Compression UltraSonography (DACUS). Blood 2008 ; 112 : 511-515.
- Carrier M, et al : Obstruction résiduelle de la veine pour prédire le risque de thromboembolie veineuse récurrente chez les patients atteints de thrombose veineuse profonde : une revue systématique et une méta-analyse. J Thromb Haemost 2011 ; 9 : 1119-11125.
- Marchiori A, et al : Le risque de thromboembolie veineuse récurrente chez les porteurs hétérozygotes du facteur V Leiden ou de la mutation de la prothrombine G20210A. A systematic review of prospective studies. Haematologica 2007 ; 92 : 1107-1114.
- Cohn D, et al : Test de thrombophilie pour la prévention des thromboembolies veineuses récurrentes. Cochrane Database Syst Rev 2009 : CD007069.
- Cohn DM, et al : Test de thrombophilie pour la prévention de la thromboembolie veineuse récurrente. Cochrane Database Syst Rev 2012 ; 12:CD007069.
- Pengo V, et al : Evolution clinique des patients à haut risque diagnostiqués avec le syndrome des antiphospholipides. J Thromb Haemost 2010 ; 8 : 237-242.
- Heit JA, et al : Risk factors for deep vein thrombosis and pulmonary embolism : a population-based case-control study. Arch Intern Med 2000 ; 27 (160) : 809-815.
- Lindhoff-Last E : Évaluation du risque de récidive de thromboembolie veineuse. Hémostase 2011 ; 31 : 7-12.
- Akl EA, et al : Anticoagulation for the long term treatment of veinous thromboembolism in patients with cancer. Cochrane Database Syst Rev 2008 : CD006650.
- White RH, et al : Incidence de la thrombose veineuse profonde idiopathique et de la thromboembolie secondaire parmi les groupes ethniques en Californie. Ann Intern Med 1998 ; 128 : 737-740.
- Eichinger S, et al : Risk assessment of recurrence in patients with unprovoked deep vein thrombosis or pulmonary embolism : the Vienna prediction model. Circulation 2010 ; 121 : 1630-1636.
- Brighton TA, et al ; ASPIRE Investigators : Low-dose aspirin for preventing recurrent venous thromboembolism. NEJM 2012 ; 367 : 1979-1987.
CARDIOVASC 2013 ; 12(1) : 4-7











