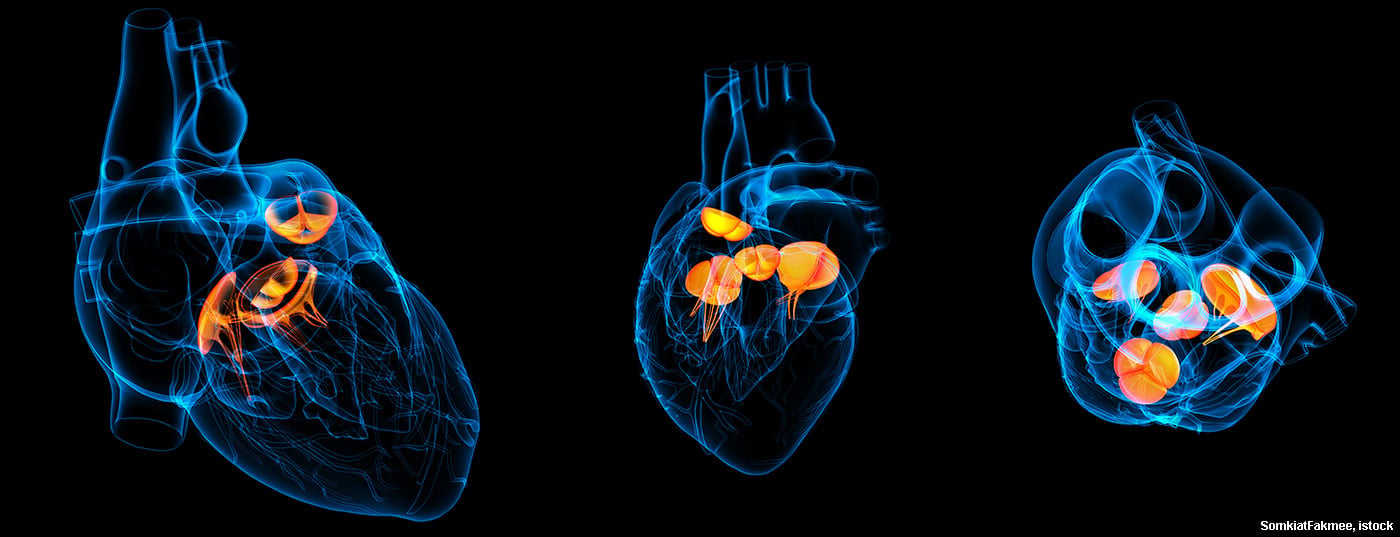
Les progrès de la médecine ont également un impact sur l’épidémiologie de l’endocardite infectieuse. Les implantations de valves par cathéter (TAVI), en particulier, représenteront un défi majeur à l’avenir.
L’endocardite infectieuse est une infection bactérienne de l’endocarde (principalement des valves cardiaques) ou des implants intracardiaques (par exemple les valves cardiaques artificielles, les prothèses aortiques et les sondes de stimulateurs et de défibrillateurs), qui survient dans plus de 90% des cas. En pratique clinique quotidienne, les valves aortiques et mitrales sont les plus touchées. Les valves cardiaques droites ne sont impliquées que dans environ 5 à 10% des cas, dans ce cas, il s’agit généralement de la valve tricuspide. Les facteurs de risque d’endocardite du côté droit sont principalement l’abus de drogues par voie intraveineuse, ainsi que les dispositifs intracardiaques tels que les câbles de stimulation et les cathéters intravasculaires (en particulier les cathéters veineux centraux). Certaines cardiopathies congénitales (notamment celles présentant une pathologie valvulaire et/ou un shunt) représentent également un risque de survenue d’endocardite [1,2]. L’endocardite liée aux prothèses valvulaires représente environ 5% de toutes les endocardites infectieuses [1–4].
Prophylaxie
L’endocardite infectieuse a été décrite pour la première fois en 1885 par William Osler [5]. Dans les années 1920, des bactéries circulant dans le sang après des interventions dentaires ont été suspectées pour la première fois d’être à l’origine d’une infection valvulaire et, en conséquence, les premières recommandations sur l’antibioprophylaxie ont été publiées par l’AHA (American Heart Association) en 1955 [6]. Depuis lors, les recommandations relatives à l’administration prophylactique d’antibiotiques ont été modifiées à plusieurs reprises. Il s’agit avant tout de mettre en balance les bénéfices de la prophylaxie et le risque de favoriser la résistance aux antibiotiques. Lors de la dernière révision en 2007, les recommandations concernant la prophylaxie antibiotique dans les situations à risque ont été appliquées de manière très restrictive (tab. 1) [7,8].

En particulier, le nombre et le type d’interventions et d’actes pour lesquels une prophylaxie doit être administrée ont été limités. L’antibioprophylaxie reste indiquée lors d’interventions dentaires impliquant des manipulations dans la région du sillon gingival ou en cas de perforation de la muqueuse, ainsi que lors d’interventions dans la région oropharyngée si la muqueuse est perforée. En revanche, la recommandation concernant la prophylaxie lors d’interventions et de manipulations sur le tractus urogénital, lors d’interventions gynécologiques et lors d’interventions gastro-intestinales telles que les endoscopies a été retirée, à condition qu’il n’y ait pas d’infection active dans ces systèmes d’organes. Dans le cas contraire, la prophylaxie et un traitement approprié sont bien entendu nécessaires.
Les groupes de patients à risque qui doivent continuer à recevoir une prophylaxie ont également été définis de manière beaucoup plus étroite. Actuellement, seuls les patients les plus à risque doivent recevoir une prophylaxie, et plus particulièrement ceux qui présentent un risque élevé d’évolution défavorable en cas de survenue d’une endocardite infectieuse. Cela inclut tous les patients ayant subi un remplacement valvulaire (qu’il s’agisse d’une intervention chirurgicale avec une prothèse mécanique ou biologique ou d’une intervention avec des valves transcathéter). Les groupes à risque comprennent également les patients ayant déjà subi une endocardite, les patients présentant des vices congénitaux (voir à ce sujet les listes séparées dans les Guidelines [7,8]) et les patients ayant subi une transplantation cardiaque et présentant une valvulopathie nouvellement apparue. Chez les patients présentant un état après reconstruction valvulaire, la prophylaxie est recommandée pendant 6 mois jusqu’à l’endothélialisation. En revanche, la prophylaxie antibiotique n’est plus indiquée aujourd’hui chez les patients présentant un défaut valvulaire, comme une sténose aortique ou une insuffisance mitrale.
Le risque d’une augmentation de la résistance aux antibiotiques des types de germes les plus courants a été invoqué pour justifier une attitude nettement plus restrictive en matière d’administration prophylactique d’antibiotiques. En effet, certains rapports montrent une diminution des germes résistants à environ 10% depuis l’introduction des nouvelles lignes directrices, bien que la causalité soit difficile à établir [10]. Il ne faut pas non plus sous-estimer le facteur économique et la sécurité des patients, car il est tout à fait possible que des réactions allergiques graves se produisent déjà lors de la prophylaxie antibiotique. Pour justifier encore plus une attitude plus restrictive, on met en avant des études montrant une bactériémie lors de l’hygiène dentaire, même lors d’un brossage normal des dents, dont l’ampleur est similaire à celle observée lors d’interventions dentaires n’impliquant pas l’appareil gingival. Par conséquent, la prophylaxie n’est pas justifiée dans les situations qui ne dépassent pas le niveau de risque du risque quotidien normal.
Incidence
L’incidence de l’endocardite infectieuse est de 3 à 10 pour 100 000 personnes par an. Aujourd’hui, près de 40% des infections de prothèses valvulaires sont associées à l’hôpital. Associé à l’hôpital signifie qu’une infection survient dans le cadre d’un séjour hospitalier (par exemple, cathéters posés par voie veineuse, infections de plaies, pneumonie, infections urinaires). De plus, de nombreuses publications font état d’une augmentation de l’incidence au cours des dernières années [1,2,9,10]. Nous pouvons tout à fait confirmer cette observation sur la base de notre propre expérience. L’interprétation de l’augmentation des cas d’endocardite sur prothèse est toutefois difficile, car de nombreux facteurs peuvent influencer ces chiffres. Dans une étude réalisée en Angleterre, le nombre d’infections et de prescriptions d’antibiotiques a été analysé à partir d’un registre national après la restriction de la prophylaxie de l’endocardite. Une diminution drastique des prescriptions d’antibiotiques a été démontrée, mais en même temps une augmentation rapide des cas d’endocardite [9].
D’autres études menées dans d’autres pays n’ont pas pu démontrer une augmentation aussi rapide des cas d’endocardite, ce qui explique pourquoi les auteurs de l’étude anglaise eux-mêmes relativisent le lien avec les directives modifiées en matière de prophylaxie [6].
L’âge croissant des patients, associé à des comorbidités plus nombreuses et plus complexes, est probablement l’un des principaux changements expliquant l’augmentation significative des cas d’endocardite infectieuse. Alors qu’auparavant, les jeunes patients atteints de valvulopathies rhumatismales étaient prédisposés à l’endocardite, ce sont aujourd’hui les patients âgés atteints de valvulopathies dégénératives qui sont les plus touchés dans les régions disposant d’une bonne couverture médicale. Cependant, en raison de la migration, on observe une nouvelle augmentation de la prévalence des viatiques rhumatismaux avec prédisposition correspondante dans nos hôpitaux. D’autres facteurs de risque importants sont les procédures de plus en plus utilisées, telles que la dialyse et l’immunosuppression, ainsi que l’augmentation du nombre de patients chez qui des cathéters intravasculaires (cathéters veineux centraux), des implants intracardiaques tels que des stimulateurs cardiaques, d’autres matériaux étrangers tels que des prothèses de hanche et de genou et, bien sûr, des prothèses valvulaires ont été installés [1,2,6,11,12]. Chez les patients plus jeunes, il s’agit principalement de personnes ayant reçu des drogues par voie intraveineuse.
Diagnostic
Pour établir le diagnostic, il faut rassembler les résultats cliniques, les résultats microbiologiques et les résultats de l’imagerie. Pour ce faire, il convient d’utiliser les critères de Dukes (tab. 2) [1,2,7,13], qui permettent d’interpréter différentes modalités et d’évaluer la probabilité d’endocardite. Un rôle de plus en plus important est attribué à l’imagerie, l’échocardiographie transoesophagienne étant devenue l’étalon-or ; avec les progrès techniques et l’augmentation de la résolution qualitative des images, on peut s’attendre à une augmentation du taux de détection et donc du nombre de cas. En cas de suspicion d’infection des prothèses vasculaires, le diagnostic TEP-TDM est de plus en plus utilisé, bien qu’il faille encore acquérir beaucoup d’expérience dans l’évaluation de ces résultats d’examen.

Pour les examens microbiologiques, il est important de prélever 3 jeux d’hémocultures, qui doivent être prélevés rapidement au moindre doute. Cette triple culture permet de détecter jusqu’à 98% des germes en cas de bactériémie [7,14].
Microbiologie
En ce qui concerne l’éventail des germes, on est passé ces dernières années des agents pathogènes les plus fréquents de la sphère oropharyngée à des agents pathogènes associés à l’hôpital. Le staphylocoque doré a dépassé le streptocoque en tant qu’agent pathogène le plus fréquent. Dans les années 60, la proportion de Staphylococcus aureus était de 18%, mais elle a depuis augmenté jusqu’à 38% (tableau 3) [1,2,4,15].
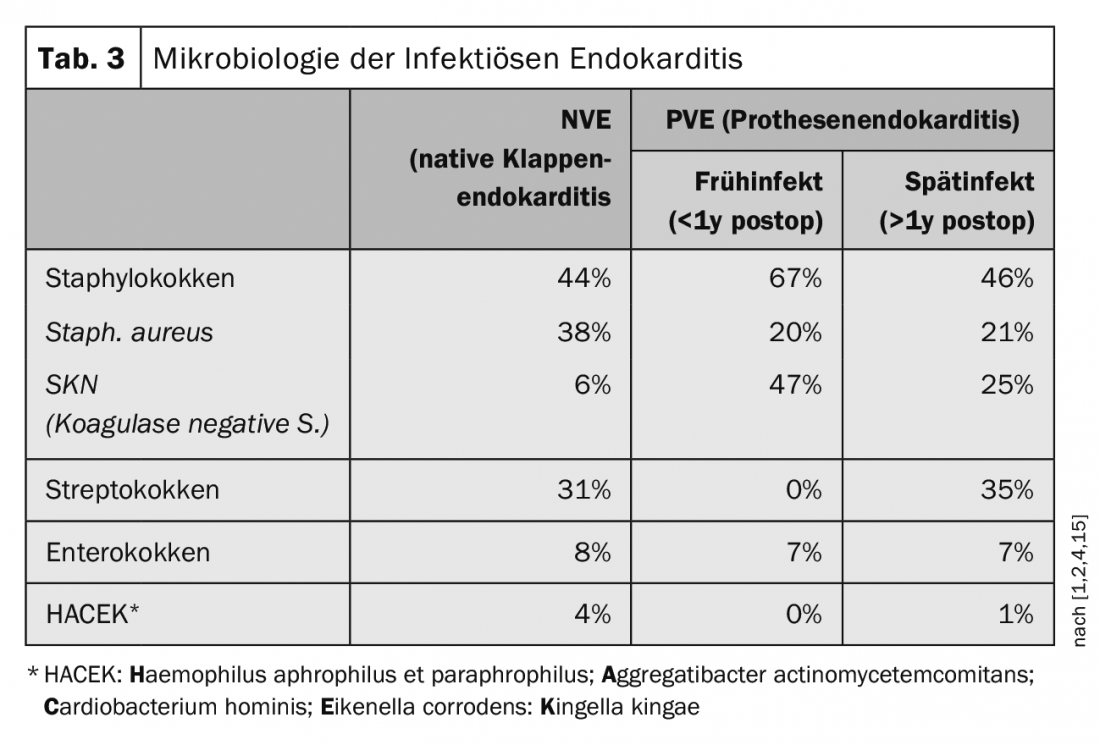
Dans le cas de l’endocardite infectieuse des prothèses valvulaires, appelée endocardite prothétique (EPV), on distingue l’infection précoce, qui survient dans l’année qui suit l’implantation, et l’infection tardive, qui survient un an après l’implantation [7,14]. Les défauts précoces surviennent dans jusqu’à 16% des infections de prothèses. Les infections précoces directement liées à la chirurgie apparaissent généralement dans les 2-3 mois et sont le plus souvent causées par un staphylocoque à coagulase négative (SKN) ou un staphylocoque doré. En revanche, dans le cas des implantations de valves cathéter transfémorales (TAVI), les entérocoques sont plus souvent isolés dans les cas d’infections précoces, bien que les données soient encore relativement rares dans ce domaine [1,2]. Les infections de prothèses qui surviennent après un an sont des infections d’origine hématogène et leur spectre bactérien correspond à celui des endocardites sur valve native [16]. Après l’implantation d’une prothèse valvulaire transfémorale (TAVI), il existe un risque d’endocardite de 5 à 6% dans les 5 ans. En comparaison, l’implantation d’un stimulateur cardiaque entraîne un risque de 2% de contracter une endocardite dans les 5 ans. Pour les prothèses valvulaires chirurgicales, qu’elles soient biologiques ou mécaniques, le risque est d’environ 3-4% sur 5 ans.
Malgré tous les progrès réalisés en chirurgie cardiaque, en infectiologie et en médecine intensive, la mortalité n’a pas beaucoup évolué au cours des dernières décennies : l’endocardite infectieuse reste une maladie systémique grave avec une morbidité et une mortalité élevées en conséquence. La mortalité en cas d’endocardite infectieuse est de 20% et augmente à plus de 50% en cas d’endocardite sur prothèse.
En cas d’atteinte d’une valve cardiaque native, on observe généralement en premier lieu des dépôts, appelés végétations, qui, selon leur taille, peuvent s’emboliser et, dans le pire des cas, entraîner un accident cérébrovasculaire septique. En outre, une insuffisance aiguë de la valve affectée – par destruction de la structure – peut se produire, ce qui peut entraîner une détérioration hémodynamique aiguë. Les sténoses sont beaucoup plus rarement observées, parfois en relation avec de grandes végétations.
Dans le cas de l’endocardite prothétique, les végétations peuvent provoquer à la fois une sténose et une insuffisance sur les valves mécaniques en bloquant un volet de la valve. Dans le cas des valves biologiques, il y a souvent une destruction des poches de la valve, ce qui entraîne des insuffisances graves. Une complication redoutable de l’endocardite prothétique est l’insuffisance paravalvulaire due à une abcédation autour de l’anneau valvulaire. Cela peut aller jusqu’à un relâchement complet de la valve avec le phénomène correspondant de “Rocking Valve”. L’abcédation est surtout observée en cas d’endocardite à Staphylococcus aureus.
Il n’est pas rare que l’abcédation au niveau des valves gauches se produise dans la jonction aortomitrale, avec une destruction correspondante de la continuité ventriculo-aortique et au niveau du septum membraneux, avec une perturbation correspondante de la conduction AV, voire un bloc AV de troisième degré.
Chirurgie
Un traitement chirurgical de l’endocardite des valves natives est nécessaire dans 40 à 50% des cas ; le traitement conservateur par antibiothérapie peut conduire à une guérison de la valve affectée jusqu’à 60%. Dans le cas des prothèses valvulaires, la situation est beaucoup plus dangereuse et une réhabilitation chirurgicale est nettement plus souvent nécessaire. Les systèmes de stimulation cardiaque doivent également être améliorés chez ces patients. La réimplantation d’un nouveau système de stimulation cardiaque dépend de l’indication spécifique et actuelle et peut être effectuée au cours de la même opération au moyen de sondes épicardiques. En raison de leur évolution extravasculaire, ces dernières sont moins sujettes aux réinfections.
Pour les patients nécessitant des soins intensifs, il est important de les transférer au centre avec un traitement et une évaluation interdisciplinaires appropriés. De plus, des études montrent qu’une indication posée le plus rapidement possible, avec une réalisation de l’opération en conséquence, apporte une bien meilleure survie en périopératoire, mais aussi à long terme [17,18].
Les directives européennes servent de référence pour poser l’indication d’un traitement chirurgical (tab. 4) [7]. Un traitement chirurgical est particulièrement indiqué dans les situations suivantes : [2,3,7]
- Dysfonctionnement de la valve avec instabilité hémodynamique,
- infection incontrôlable malgré un traitement antibiotique adéquat,
- abcédation croissante avec insuffisance paravalvulaire,
- Prévention de l’embolisation
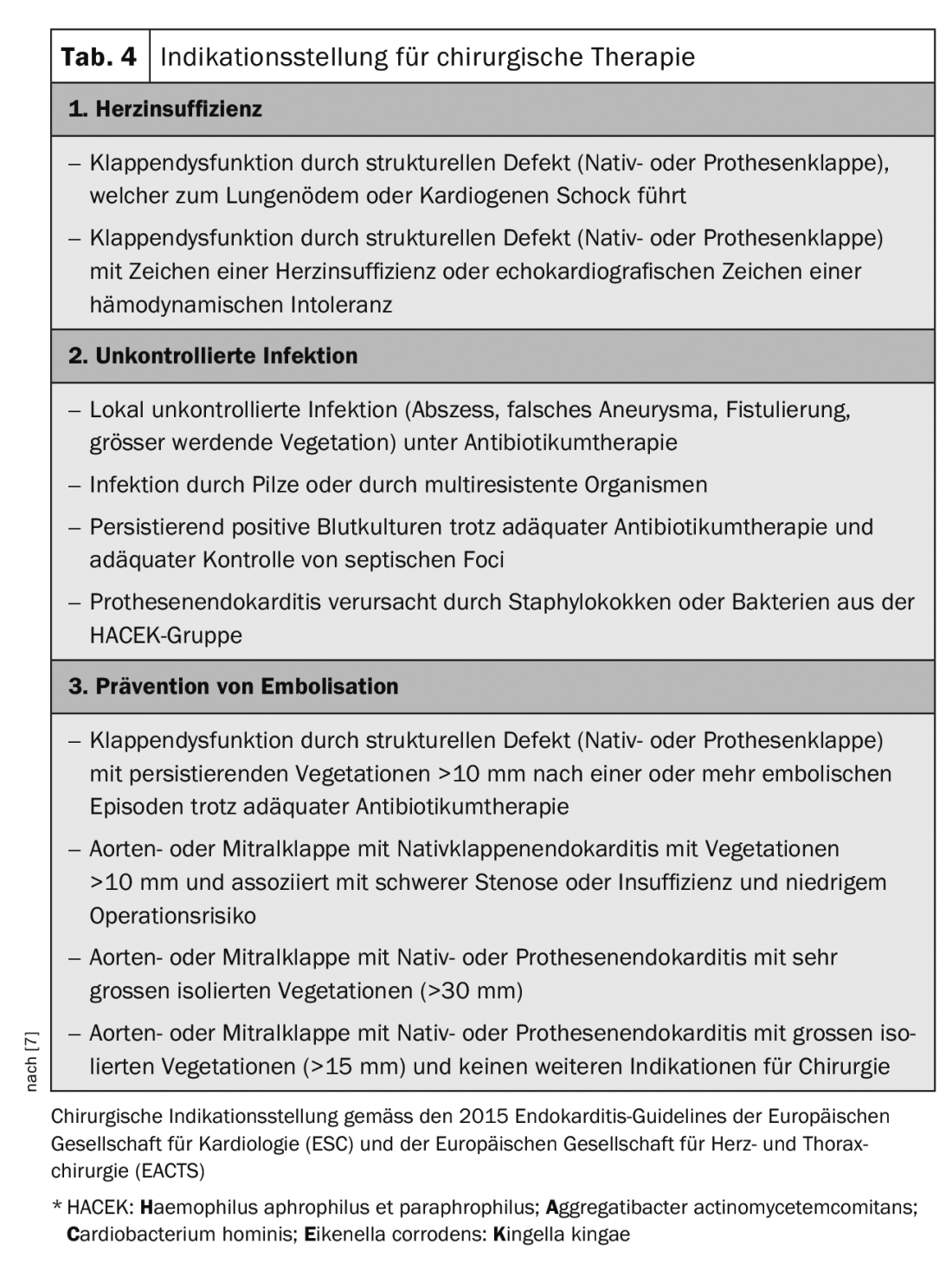
En ce qui concerne la prévention de l’embolisation, il existe également un potentiel d’amélioration dans les guidelines. Pour les végétations gauches de plus de 10 mm, l’indication d’une chirurgie précoce doit être posée plus généreusement [17]. Chez les patients ayant subi un accident vasculaire cérébral, l’opération est souvent trop longtemps retardée, ce qui entraîne une détérioration supplémentaire du patient et un risque accru d’embolie. Après un AVC sans hémorragie intracrânienne et sans limitation neurologique sévère, l’opération doit être réalisée sans délai. En cas d’ischémie cérébrale importante ou d’hémorragie, il convient d’évaluer s’il faut attendre au moins 3 à 4 semaines.
En cas d’endocardite de la valve aortique native, le remplacement de la valve est le traitement de choix. En cas d’atteinte de la valve mitrale native, une reconstruction peut être envisagée, à condition que les tissus ne soient pas complètement ramollis et/ou détruits. Les prothèses valvulaires infectées doivent être remplacées dans tous les cas. Les cavités d’abcès sont généralement fermées par des patchs péricardiques.
A l’avenir, l’endocardite des valves transcathéter devrait devenir un problème croissant. Jusqu’à récemment, ces valves étaient principalement implantées chez des patients âgés et inopérables, qui décédaient souvent avant de développer une endocardite. Et si une endocardite survenait, ces patients étaient traités de manière conservatrice. Avec un nombre attendu de patients plus jeunes qui seront équipés de valves à cathéter à l’avenir, le nombre d’endocardites sur prothèse après TAVI va également augmenter. On peut en effet supposer que l’incidence sera au moins aussi élevée que celle des prothèses chirurgicales conventionnelles.
D’un point de vue technique, les interventions après l’implantation d’une prothèse TAVI peuvent être exigeantes, car ces valves contiennent beaucoup plus de matériaux étrangers et notamment des treillis métalliques qui atteignent souvent la racine de l’aorte, voire la dépassent. Ces derniers peuvent parfois être extrêmement difficiles à éliminer. En revanche, après un remplacement chirurgical de la valve, l’anneau de la valve peut généralement être retiré et une nouvelle valve peut être implantée au même endroit. Avec les valves de cathéter, le risque de dommages au niveau de la racine aortique est plus important. De même, si un greffon composite doit finalement être implanté, l’effort est nettement plus important. Le taux de récidive après endocardite sur prothèse valvulaire est de 6 à 15% [2].
La principale leçon à tirer chez les patients présentant un état fébrile inexpliqué et une constellation de risques potentiels (porteurs de prothèses valvulaires, vitium valvulaire) est de penser à la possibilité d’une endocardite infectieuse, même si les symptômes ne sont pas tout à fait typiques. En particulier chez les patients porteurs de prothèses valvulaires, une endocardite doit être exclue dans tous les cas en cas d’état fébrile inexpliqué. En cas de signes d’infection ou de baisse de l’état général avec un nouveau souffle cardiaque, il est également impératif de rechercher une endocardite. A l’avenir, le nombre de patients à risque (ceux qui ont un TAVI, des prothèses vasculaires des grandes artères ou des endoprothèses endovasculaires dans l’aorte) devrait augmenter considérablement.
Il est également important de prendre en charge les patients porteurs d’implants cardiovasculaires, en vue de leur donner des instructions concernant la prophylaxie de l’endocardite – non seulement au moyen d’antibiotiques lorsqu’ils sont indiqués, mais aussi en ce qui concerne les mesures d’hygiène telles que les soins dentaires, mais aussi la prévention et le traitement des lésions cutanées récurrentes ou des plaies chroniques.
Messages Take-Home
- Les progrès de la médecine modifient l’épidémiologie de l’endocardite infectieuse.
- Globalement, nous prévoyons une augmentation des cas d’endocardite. L’établissement du diagnostic reste un défi.
- Les infections associées à l’hôpital sont également devenues un problème important pour l’endocardite infectieuse.
- Le traitement chirurgical de l’endocardite infectieuse devient de plus en plus complexe à mesure que la quantité de matériel étranger déjà présent chez le patient augmente.
- L’endocardite après l’implantation d’une valve à cathéter (TAVI) sera un grand défi à l’avenir.
- L’indication de l’administration d’antibiotiques doit toujours être bien justifiée.
- Par conséquent, l’administration d’une prophylaxie de l’endocardite n’est recommandée que de manière très restrictive.
Littérature :
- Cahill TJ, et al : Challenges in Infective Endocarditis. JACC 2017 ; 69 : 325-344.
- Cahill TJ, Prendergast BD : Endocardite infectieuse. Lancet 2016 ; 387 : 882-893.
- Wang A, et al : Profil clinique contemporain et résultats de l’endocardite valvulaire prothétique. JAMA 2007 ; 297 : 1354-1361.
- Moreillon P, Que YA. : Endocardite infectieuse. Lancet 2004 ; 363 : 139-149.
- Osler W. : Les conférences de Gulston, sur l’endocardite maligne. BMJ 1985 ; 1 : 577-579.
- Dayer M, Thornhill M : Antibiotic Prophylaxis Guidelines and Infective Endocarditis : Cause for Concern ? JACC 2015 ; 65 : 2077-2078.
- Habib G, et al. : 2015 ESC Guidelines for the management of infective endocarditis : The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by : European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J 2015 ; 36 : 3075-3128.
- Flückiger U, Jaussi A : Directives suisses révisées pour la prophylaxie de l’endocardite. Médecine cardiovasculaire 2008 ; 11 : 392-400.
- Dayer MJ, et al : Incidence de l’endocardite infectieuse en Angleterre, 2000-13 : a secular trend, interrupted time-series analysis. Lancet 2015 ; 385 : 1219-1228.
- Ostovar R, et al : Endocardite : un problème toujours croissant en chirurgie cardiaque. Thorac Cardiovasc Surg 2019 ; Epub ahead of print
- Slipczuk L, et al : Infective endocarditis epidemiology over five decades : a systematic review. PLoS One 2013 ; 8:e82665.
- Fefer P, et al : Changing epidemiology of infective endocarditis : a retrospective survey of 108 cas, 1990-1999. Eur J Microbiol Infect Dis 2002 ; 21 : 432-437.
- Li JS, et al : Proposed modifications to the Duke criteria for the diagnosis of infective endocarditis. Clin Infect Dis 2000 ; 30 : 633-638.
- Vongpatanasin W, et al : Valves cardiaques prothétiques. NEJM 1996 ; 335 : 407-416.
- Murdoch DR, et al : Présentation clinique, étiologie, et résultats de l’endocardite infectieuse au 21ème siècle : la Collaboration internationale sur l’endocardite – Étude de cohorte prospective. Arch Intern Med 2009 ; 169 : 463-473.
- Butt JH, et al : Risque à long terme d’endocardite infectieuse après un remplacement de valve aortique par transcathéter. JACC 2019 ; 73 : 1646-1655.
- Carrel T. : La réparation ou le remplacement précoce des valves n’est généralement pas contre-indiqué chez les patients atteints d’endocardite infectieuse et d’accident vasculaire cérébral avec ou sans hémorragie intracrânienne. Eur J Cardiothorac Surg 2016 ; 50 : 383-384.
- Carrel T, et al : Quelles sont les nouveautés dans le traitement chirurgical de l’endocardite infectieuse ? Intensive Care Med 2016 ; 42 : 2052-2054.
CARDIOVASC 2019 ; 18(4) : 9-13