Le cancer de l’œsophage survient en moyenne à l’âge de 60 ans. Il s’agit de la sixième cause de mortalité liée au cancer. La chirurgie robotique permet des interventions plus radicales sous une visibilité optimale – pour un meilleur pronostic.
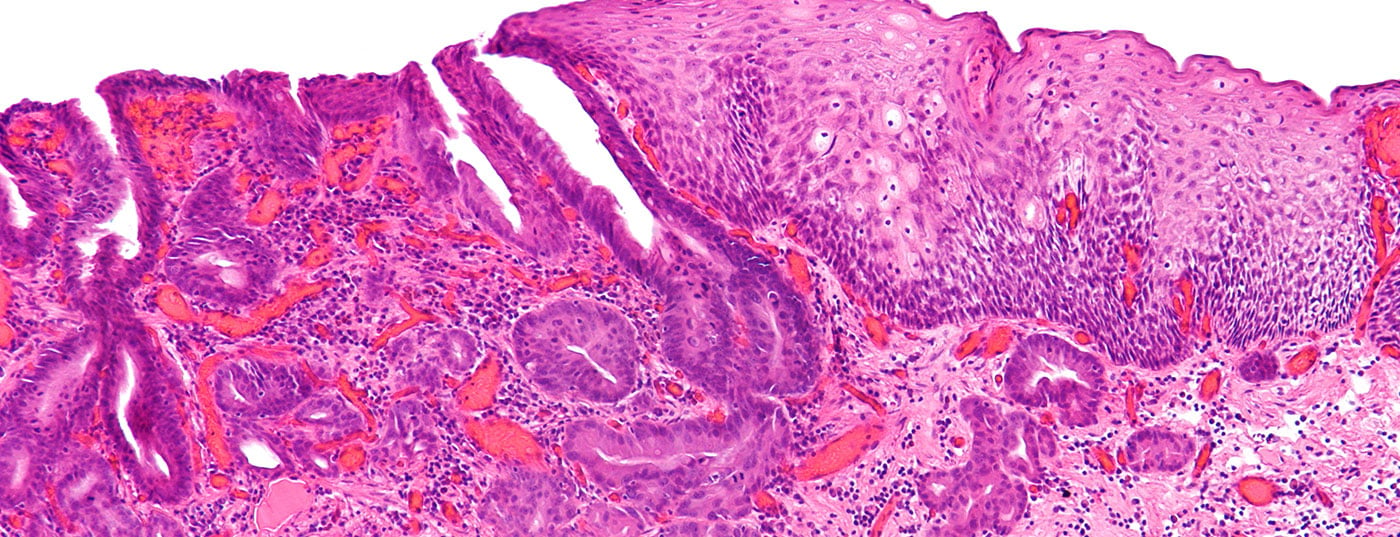
Le cancer de l’œsophage survient en moyenne à l’âge de 60 ans. Les trois quarts des personnes concernées sont des hommes, un quart des femmes. Il s’agit de la sixième cause de mortalité liée au cancer [1]. Le carcinome épidermoïde se trouve dans le tiers supérieur et moyen de l’œsophage. La consommation d’alcool et de nicotine sont les facteurs de risque les plus importants et l’incidence est stable. L’adénocarcinome se développe dans le tiers inférieur de l’œsophage et à la jonction avec l’estomac. Le reflux gastro-œsophagien et l’obésité sont des facteurs de risque importants. L’incidence de l’adénocarcinome est en forte augmentation et est plus fréquente que celle du carcinome épidermoïde dans les pays occidentaux. Les autres formes histologiques jouent un rôle secondaire.
Staging
Le cancer de l’œsophage présente des métastases précoces au niveau lymphatique et vasculaire. Malgré un traitement multimodal, le taux de survie à 5 ans n’est que de 15 à 25% [1]. Il est donc essentiel de poser un diagnostic le plus tôt possible. En tant que prestataire de soins primaires, le médecin généraliste est responsable de l’évaluation rapide des symptômes d’alerte au moyen de l’œsophagogastroduodénoscopie (OGD) (Vue d’ensemble 1). D’un point de vue diagnostique, l’OGD présente la plus grande sensibilité et spécificité pour les néoplasies du tractus gastro-intestinal supérieur.

Les centres tumoraux disposant de l’expertise nécessaire sont responsables de la stadification des patients atteints de cancer de l’œsophage. Le staging comprend une endosonographie pour les catégories T et N, ainsi qu’un scanner avec TEP pour détecter les métastases à distance (catégorie M) et comme examen index en cas d’approche néoadjuvante. Une bronchoscopie est effectuée pour les tumeurs suspectées d’invasion au niveau de la carène ou proximal. En cas de carcinome épidermoïde, il faut impérativement exclure une tumeur ORL synchrone. Une laparoscopie permet d’exclure une carcinose péritonéale ou des métastases hépatiques (cT3-4) [2,3].
Classification du cancer de l’œsophage
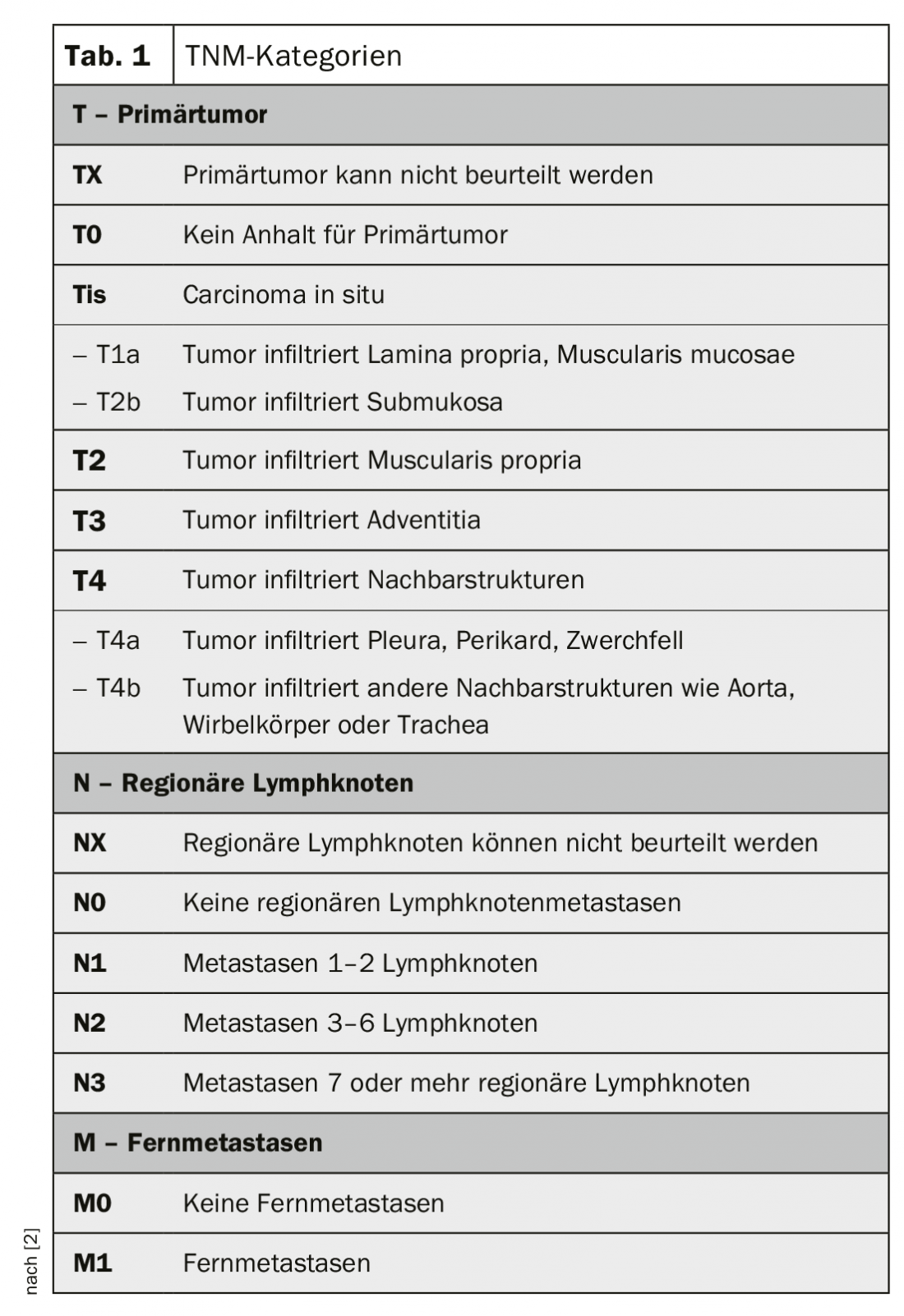
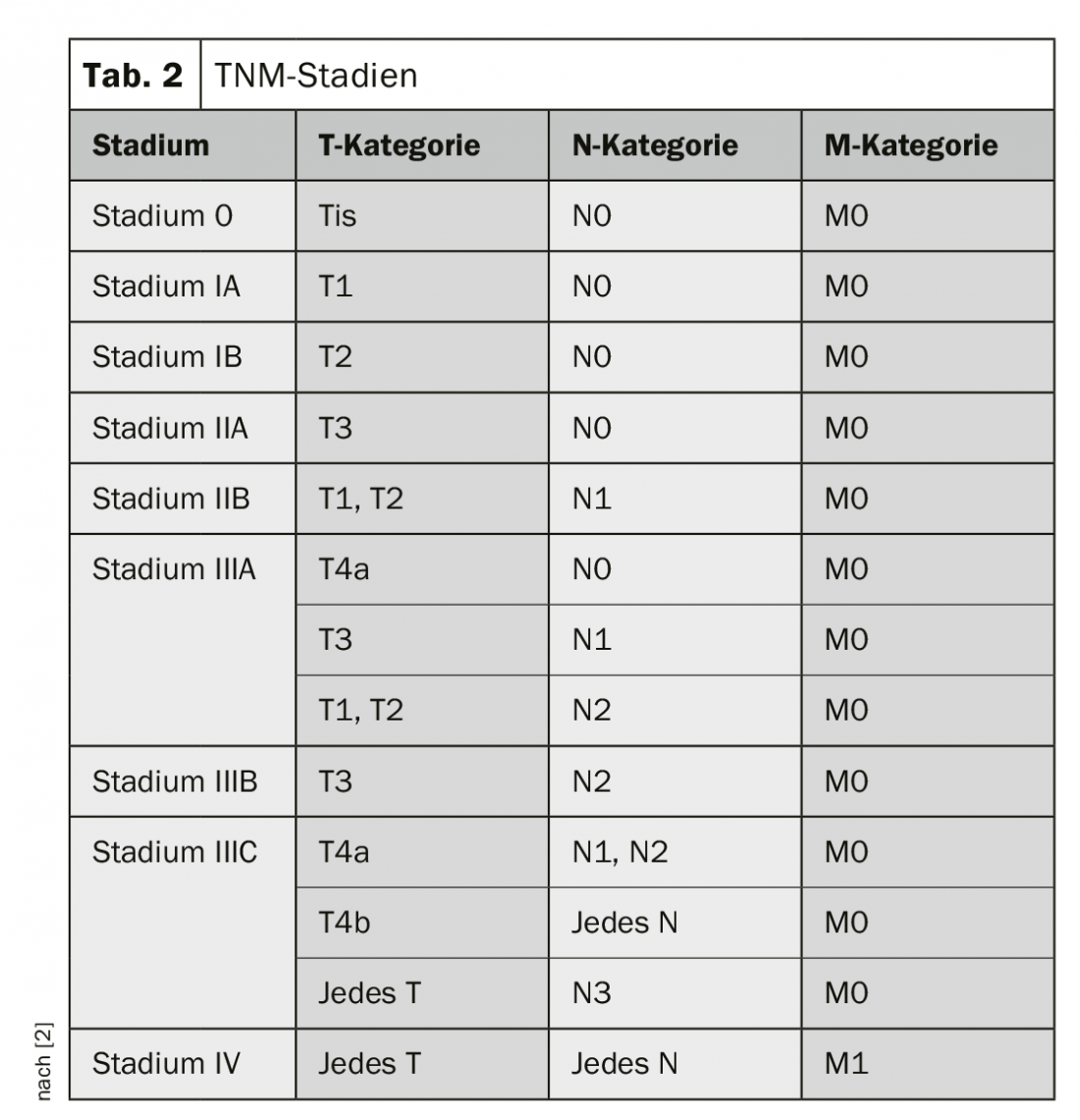
La classification et la répartition des stades du cancer de l’œsophage se font selon la classification TNM (tab. 1 et 2) [4]. Les carcinomes de la jonction œsophagienne sont considérés comme des carcinomes de l’œsophage tant que leur épicentre est situé au maximum à 2 cm distalement de la ligne Z (classification de Nishi [5]). La classification de Siewert [6] peut encore être déterminante pour le traitement chirurgical. De la même manière, les Siewert de type I et II sont traités comme des cancers de l’œsophage et ceux de type III comme des cancers de l’estomac.
Thérapie
Sur le plan thérapeutique, l’utilisation du robot joue un rôle d’avenir. Le concept de traitement est défini lors de la réunion de concertation postopératoire (tumor board) après le staging. L’approche multimodale est esquissée dans la figure 1. En principe, on distingue une approche curative et une approche palliative [2,3].
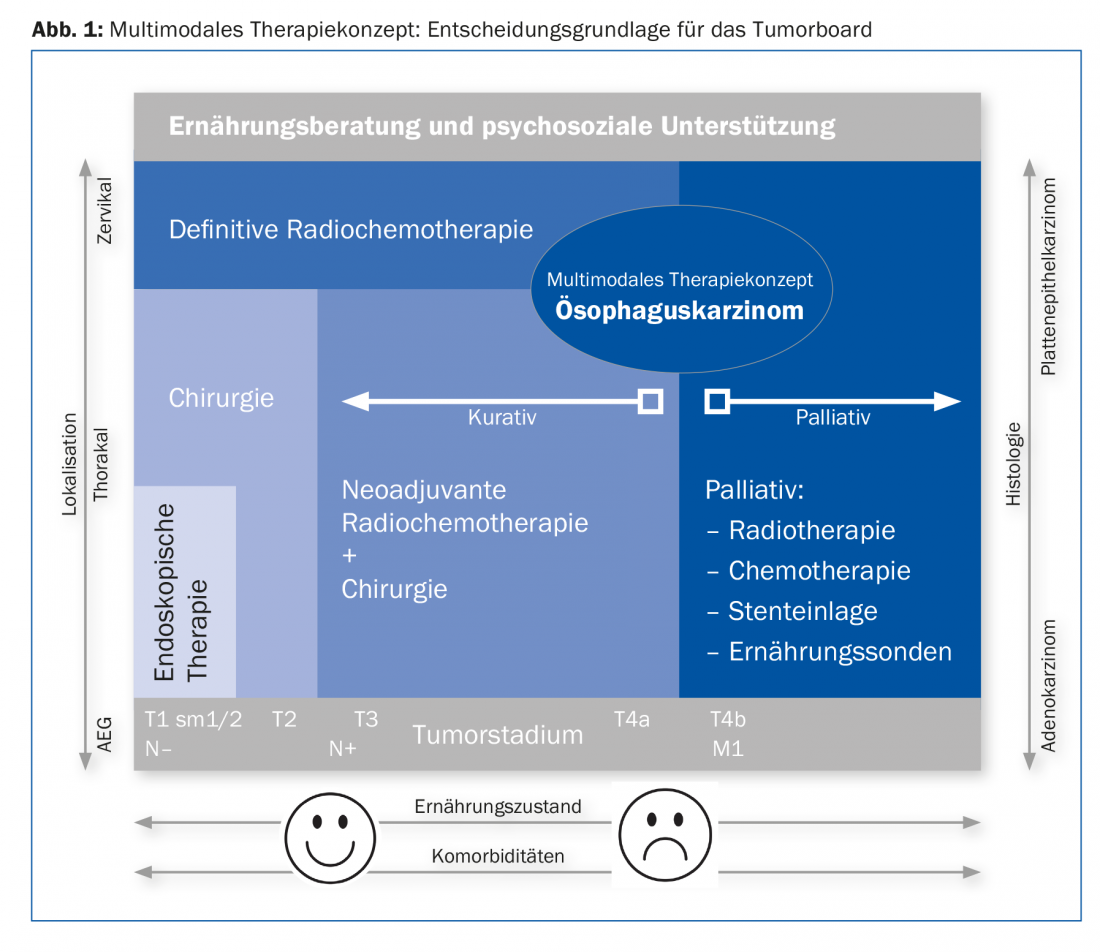
Curation
Si le stade tumoral local est au maximum T4a sans métastases à distance, nous traitons selon une approche curative. Les cancers précoces (T1, sm1/sm2) sans facteurs de risque (L0, V0, G2 maximum) peuvent être traités par endoscopie. Pour les carcinomes plus avancés, la chirurgie est le traitement de choix après évaluation des risques cardiaques, pulmonaires, hépatiques et métaboliques. Nous opérons les cancers T2 à T3 ou un stade ganglionnaire positif après un traitement néoadjuvant. Plusieurs grandes études ont démontré un avantage de survie sous prétraitement par radiochimiothérapie [7,8]. Après un traitement néoadjuvant, un restaging est effectué pour exclure les métastases à distance. Si des métastases à distance apparaissent pendant ou après le traitement, celui-ci est interrompu et on passe à une approche palliative. La fenêtre optimale pour l’intervention chirurgicale est de six à huit semaines après la fin de la radiochimiothérapie.
Dans le cas du cancer de l’œsophage non résécable et du cancer cervical, la radiochimiothérapie est le traitement de choix. La chirurgie présente ici un taux élevé de complications pour un pronostic identique.
Le statut nutritionnel a une grande influence sur l’évolution postopératoire. En préopératoire, la consultation nutritionnelle avec alimentation buvable (“immunonutrition”) [9] et, si nécessaire, avec sonde d’alimentation, optimise les conditions préalables.
Chirurgie robotique
La technique hybride assistée par robot permet de réaliser une œsophagectomie transthoracique subtotale avec résection de l’estomac proximal et reconstruction avec remontée gastrique et anastomose intrathoracique haute (opération de Lewis) pour les carcinomes du tiers moyen et du tiers distal [10]. Cette intervention à deux cavités présente moins de reflux postopératoire en raison de l’anastomose intrathoracique élevée et permet une plus grande marge de sécurité par rapport aux procédures transhiatales. En outre, une lymphadénectomie propre à deux champs (thoracique et abdominal) peut être réalisée. La survie augmente avec cette approche [11].
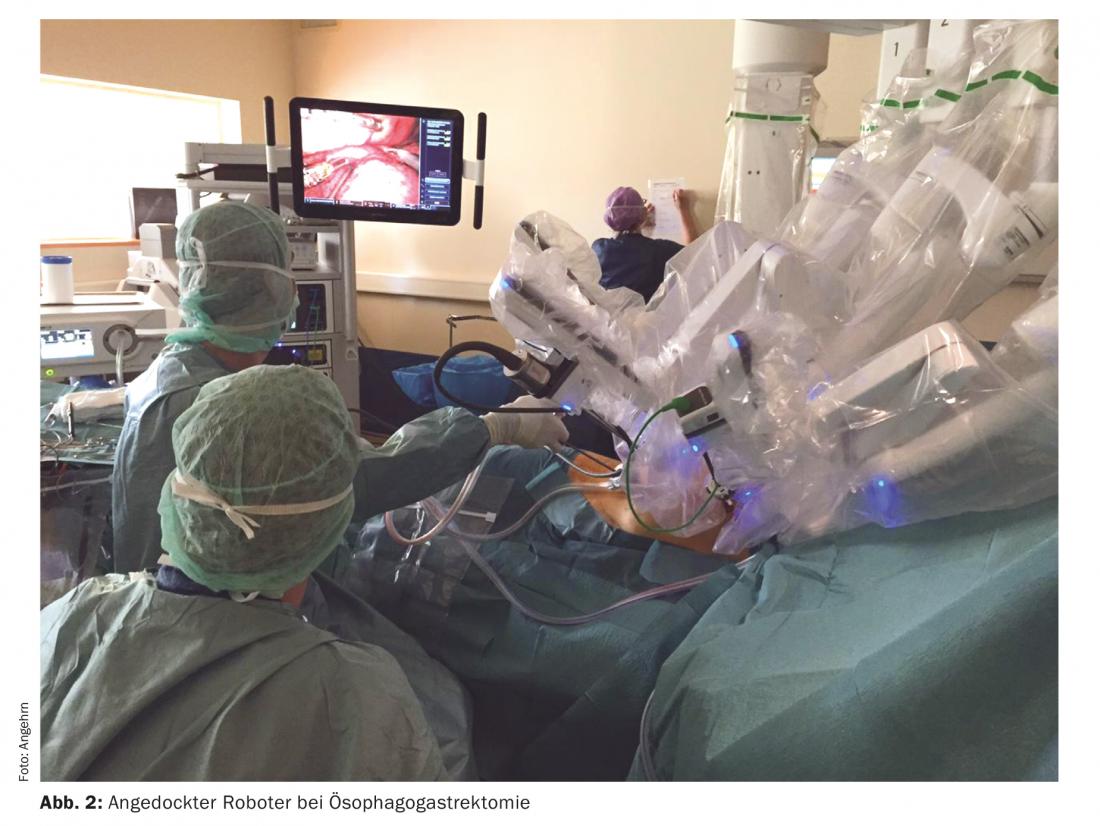
Pour la résection œsophagienne avec le robot chirurgical Da Vinci Xi®, la partie abdominale est opérée par laparotomie pour la résection gastrique proximale avec lymphadénectomie, le tube gastrique est formé à partir de l’estomac résiduel. La partie thoracique est entièrement réalisée par le robot chirurgical. Quatre trocarts de 8 mm pour le robot et une mini-thoracotomie de moins de 5 cm sont mis en place pour retirer la pièce de résection (fig. 2). Une thoracotomie douloureuse et associée à une morbidité postopératoire accrue est ainsi évitée. Le robot permet une vision tridimensionnelle optimale avec un grossissement jusqu’à dix fois et une excellente liberté de mouvement. Cela permet une lymphadénectomie propre ainsi qu’une suture manuelle assistée par robot de l’anastomose intrathoracique [12]. Une étude prospective randomisée a montré moins de complications pulmonaires, une durée d’hospitalisation plus courte et une meilleure qualité de vie en faveur de la chirurgie œsophagienne mini-invasive par rapport à la chirurgie ouverte [13]. Nous avons réalisé la première œsophagectomie assistée par robot en Europe avec le Da Vinci Xi®, nous supervisons actuellement 30 œsophagectomies assistées par robot et nous sommes convaincus de cette technique. Nous n’avons jamais eu à convertir, toutes les résections ont été réalisées en milieu sain (R0) et la morbidité était plus faible qu’en chirurgie ouverte. Aucun patient n’a été réopéré dans les 30 premiers jours ou n’est décédé pendant cette période.
Palliation
La chimiothérapie est discutée avec les patients en situation palliative. Celle-ci poursuit deux objectifs : Préserver la qualité de vie et prolonger la durée de survie. La chimiothérapie doit être commencée le plus tôt possible. Lors du choix du régime thérapeutique, l’oncologie se base sur l’état général, les souhaits, l’âge et les comorbidités du patient ainsi que sur la toxicité. Un traitement additif par anticorps est administré en cas de détermination positive de HER2 dans l’adénocarcinome. La mise en place d’un stent peut permettre d’améliorer les problèmes de déglutition.
Suivi des patients
On demande régulièrement, à juste titre, un schéma de suivi pour le cancer de l’œsophage traité, à l’instar des recommandations consensuelles sur le suivi après un cancer colorectal opéré à titre curatif [14]. De telles recommandations n’existent pas. Les options thérapeutiques limitées en cas de récidive et la présence fréquente d’une situation palliative rendent impossible une approche schématique standardisée. Dans la recherche clinique, des tentatives isolées sont faites pour élaborer un suivi structuré [15]. Il est donc d’autant plus important de discuter systématiquement de chaque patient au sein d’un tumorboard interdisciplinaire. Le médecin généraliste reçoit ainsi une recommandation individualisée pour le suivi. Le suivi est axé sur les symptômes et se concentre sur l’état nutritionnel et le soutien psychosocial. Les troubles fonctionnels peuvent indiquer une récidive. Les conseils nutritionnels déjà mis en place en périopératoire sont poursuivis afin de garantir un apport calorique et une hydratation suffisants. Le cas échéant, un contrôle endoscopique ou tomodensitométrique de suivi est recommandé individuellement lors du tumorboard après six à douze mois. Les patients ayant subi une résection endoscopique primaire font l’objet d’un suivi endoscopique.
Messages Take-Home
- L’adénocarcinome de l’œsophage est en augmentation.
- Le médecin généraliste peut améliorer de manière décisive le mauvais pronostic par un dépistage précoce (symptômes d’alerte).
- L’interdisciplinarité et les compétences de centre sont requises.
- La chirurgie robotique permet d’opérer de manière plus radicale avec une visibilité optimale.
Littérature :
- Pennathur A, et al : Carcinome de l’œsophage. Lancet 2013 ; 381 : 400-412.
- Porschen R, et al. : S3-Leitlinie Diagnostik und Therapie der Plattenepithelkarzinome und Adenokarzinome des Ösophagus. Z Gastroenterol 2015 ; 53 : 1288-1347.
- Lordick F, et al : Oesophageal cancer : ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2016 ; 27(S5) : v50-v57.
- Brierley JD, et al : TNM Classification of malignant Tumours. 8th ed. UICC – Contrôle mondial du cancer. Oxford, UK, Hoboken, NJ : John Wiley & Sons, Inc. 2016.
- Japan Esophageal Society : Classification japonaise des cancers de l’œsophage. 11th ed, part II and III. Esophagus 2017 ; 14 : 37-65.
- Siewert JR, et al : Cardia Cancer : attempt at a therapeutically relevant classification. Chirurgien 1987 ; 58 : 25-32.
- Al-Batran SE, et al : Histopathological regression after neoadjuvant docetaxel, oxaliplatin, fluorouracil, and leucovorin versus epirubicin, cisplatin, and fluorouracil or capecitabine in patients with resectable gastric or gastroesophageal junction adénocarcinoma (FLOT4-AIO) : results from the phase 2 part of a multicentre, open-label, randomised phase 2/3 trial. Lancet Oncol 2016 ; 17 : 1697-1708.
- Shapiro J, et al : Chimioradiothérapie néoadjuvante plus surgery versus surgery alone for oesophageal or junctional cancer (CROSS) : long-term results of a randomised controlled trial. Lancet Oncol 2015 ; 16 : 1090-1098.
- Mudge L, et al : Immunonutrition chez les patients subissant une résection du cancer de l’œsophage. Dis Esophagus 2011 Apr ; 24(3) : 160-165.
- Lewis I : The surgical treatment of carcinoma of the oesophagus ; with special reference to a new operation for growths of the middle third. Br J Surg 1946 Jul ; 34 : 18-31.
- Peyre CG, et al : Le nombre de ganglions lymphatiques enlevés prédit la survie dans le cancer de l’œsophage : une étude internationale sur l’impact de l’étendue de la résection chirurgicale. Ann Surg 2008 ; 248 : 549-556.
- Cerfolio RJ, et al : Aspects techniques et résultats précoces de l’ésophagectomie robotisée avec anastomose thoracique. J Thorac Cardiovasc Surg 2013 Jan ; 145(1) : 90-96.
- Biere SS, et al : Oesophagectomie mini-invasive versus ouverte pour les patients atteints de cancer de l’œsophage : un essai contrôlé randomisé, multicentrique et en ouvert. Lancet 2012 ; 379 : 1887-1892.
- Dorta G, Mottet C : Suivi après polypectomie coloscopique et cancer colorectal enlevé. SMF 2016 ; 16(7) : 164-167.
- Baiocchi GL, et al. : Suivi après gastrectomie pour cancer. La conférence de consensus Charter Scaligero. Gastric Cancer 2016 ; 19 : 15-20.
PRATIQUE DU MÉDECIN DE FAMILLE 2018 ; 13(9) : 29-33
InFo ONKOLOGIE & HÉMATOLOGIE 2019 ; 7(6) : 11-14