De nouveaux résultats sur le traitement du lymphome diffus à grandes cellules B ont notamment été présentés. L’étude de phase III FLYER a comparé le traitement standard (6xR-CHOP) à un traitement réduit de deux cycles de chimiothérapie. Une autre étude a permis de développer une nouvelle méthode de génétique moléculaire comme base d’une stratégie thérapeutique personnalisée.
Le lymphome diffus à grandes cellules B (DLBCL) est le lymphome non hodgkinien le plus fréquent au monde et fait partie des lymphomes non hodgkiniens dits agressifs. Le traitement standard est jusqu’à présent l’immunochimiothérapie 6xR-CHOP. 6xR-CHOP combine des anticorps monoclonaux (R) et des cytostatiques (CHOP) en six cycles [1]. La base empirique de ce schéma de traitement provient de l’essai MINT [3]. Chez les patients ayant un indice pronostique adapté à l’âge (aaIPI) de 0 et ne présentant pas de masse tumorale, un traitement de six cycles a permis d’obtenir une EFS à 3 ans de 89% et une PFS à 3 ans de 95%, ainsi qu’un OS à 3 ans de 98% [3].
L’essai FLYER a montré qu’il était possible de se passer de deux cycles de chimiothérapie sans que cela ait un impact négatif sur l’évolution de la maladie. Une durée plus courte de la chimiothérapie signifie que les patients peuvent revenir plus rapidement à une vie quotidienne normale et au travail, comme l’explique l’auteur principal de l’étude, le Dr Viola Poeschel, de la Saarland University Medical School à Homburg/Saar (Allemagne) [1].
Étude multicentrique FLYER : réduction de la chimiothérapie sans effets négatifs
L’étude internationale multicentrique et prospective FLYER (n=588) a examiné l’impact d’une réduction des cycles de traitement cytostatique du traitement standard sur les paramètres liés à la maladie. Pour ce faire, 6xR-CHOP (n=295) a été comparé à un traitement selon le schéma 4xR-CHOP+2xR (n=293) sur une période de onze ans (2005-2016) dans le cadre d’un plan de non-infériorité randomisé et équilibré. Les patients, âgés de 18 à 60 ans, avaient un DLBCL sans masse tumorale de stade I ou II et ont été randomisés dans l’un des deux bras de l’étude (six contre quatre cycles de CHOP et six administrations de rituximab chacun). Les cycles de R-CHOP ont été effectués à un intervalle de 21 jours. Le critère d’évaluation principal était la non-infériorité en termes de survie sans progression (PFS). Les critères d’évaluation secondaires étaient divers paramètres liés à la maladie. Il s’est avéré que 4xR-CHOP+2xR n’était pas inférieur au traitement standard 6xR-CHOP ; l’élimination des cellules cancéreuses et la prévention des récidives étaient aussi efficaces avec quatre cycles de chimiothérapie qu’avec six cycles. En ce qui concerne la tolérance, la réduction de la chimiothérapie de deux cycles a eu un effet favorable [1].
Le taux de PFS à 3 ans (critère d’évaluation principal) après une période de suivi moyenne de 66 mois était de 94% (IC à 95%, 91-97) dans la condition 6xR-CHOP (n=295) et de 96% (IC à 95%, 94-99) dans la condition 4xR-CHOP+2xR (n=293). De même, en ce qui concerne le taux de SG à 3 ans après un suivi moyen de 67 mois, les résultats ne différaient que légèrement 98% (IC 95%, 96-99) pour six cycles versus 99% (IC 95%, 98-100) pour quatre cycles [1].
En ce qui concerne la tolérance, les résultats ont été les suivants : Comparé à la condition 6xR-CHOP (1295 EI), le nombre total d’EI dans la condition 4xR-CHOP+2xR (835 EI) était inférieur d’environ un tiers [1]. Le nombre total d’événements indésirables non hématologiques de grade 3 et de grade 4 (EI) était plus élevé dans le bras de traitement 6xR-CHOP (70 EI) par rapport au bras de traitement 4-cycles (46 EI) [1,4]. En ce qui concerne les EI hématologiques, le nombre de personnes touchées était plus élevé dans la condition 6 R-CHOP par rapport à la condition 4xR-CHOP+2xR : leucopénie de grade 3 ou 4 (110 vs 80), anémie (8 vs. 2) et thromocytopénie (7 vs. 5). De même, dans la condition 6xR-CHOP, davantage de patients étaient affectés par une paresthésie de grade 3 et 4 (14 vs 12), des nausées (12 vs 6), une infection (23 vs 20), des vomissements (7 vs 1) et une mucosite (3 vs 1). Pour pouvoir déterminer si une réduction du nombre de cycles de R-CHOP a une influence sur les effets négatifs à long terme de la chimiothérapie, un suivi sur une période supplémentaire de cinq ans est nécessaire [1].
Personnalisation du traitement : nouvelle analyse génétique moléculaire
Les lymphomes diffus à grandes cellules B peuvent être classés selon des critères morphologiques (centroblastique, immunoblastique, anaplasique), selon l’expression des gènes (“germinal-center B-cell (GCB)-like”, “activated B-cell (ABC)-like”), selon les caractéristiques immunohistochimiques (notamment CD5, CD30, MYC, BCL2, BCL6, GCB-like, non-GCB-like) et selon les anomalies génétiques (notamment translocation de MYC, BCL2 et/ou BCL6). Dans la dernière édition de la classification de l’OMS, la définition des types de lymphomes a été révisée en tenant compte des connaissances acquises par les nouvelles méthodes d’analyse moléculaire telles que le “next generation sequencing” (tableau 1) [5].
L’identification de sous-groupes moléculaires est une base possible pour la personnalisation du traitement. Une étude présentée à l’ASH et publiée en parallèle dans le Journal of Oncology reprend cette approche [2]. Un sous-groupe a été identifié au sein de la variante de DLBCL “germinal-center B-cell (GCB)-like” (GCB-DLBCL), qui se distingue cliniquement et biologiquement par une signature de l’expression du gène HGBL-DH/TH-BCL2. Le contexte de cette étude était la constatation que les lymphomes à cellules B de haut grade avec MYC et BCL2 et/ou BCL6 (HGBL-DH/TH) répondaient mal au traitement standard (chimio-immunothérapie). Pour analyser les propriétés moléculaires de HGBL-DH/TH avec BCL2 (HGBL-DH/TH-BCL2), ainsi que la morphologie du DLBCL, une signature à 104 gènes double-hit (DHITsig) a été développée comme caractéristique distinctive entre HGBL-DH/TH-BCL2 et les autres GCB-DLBCL.
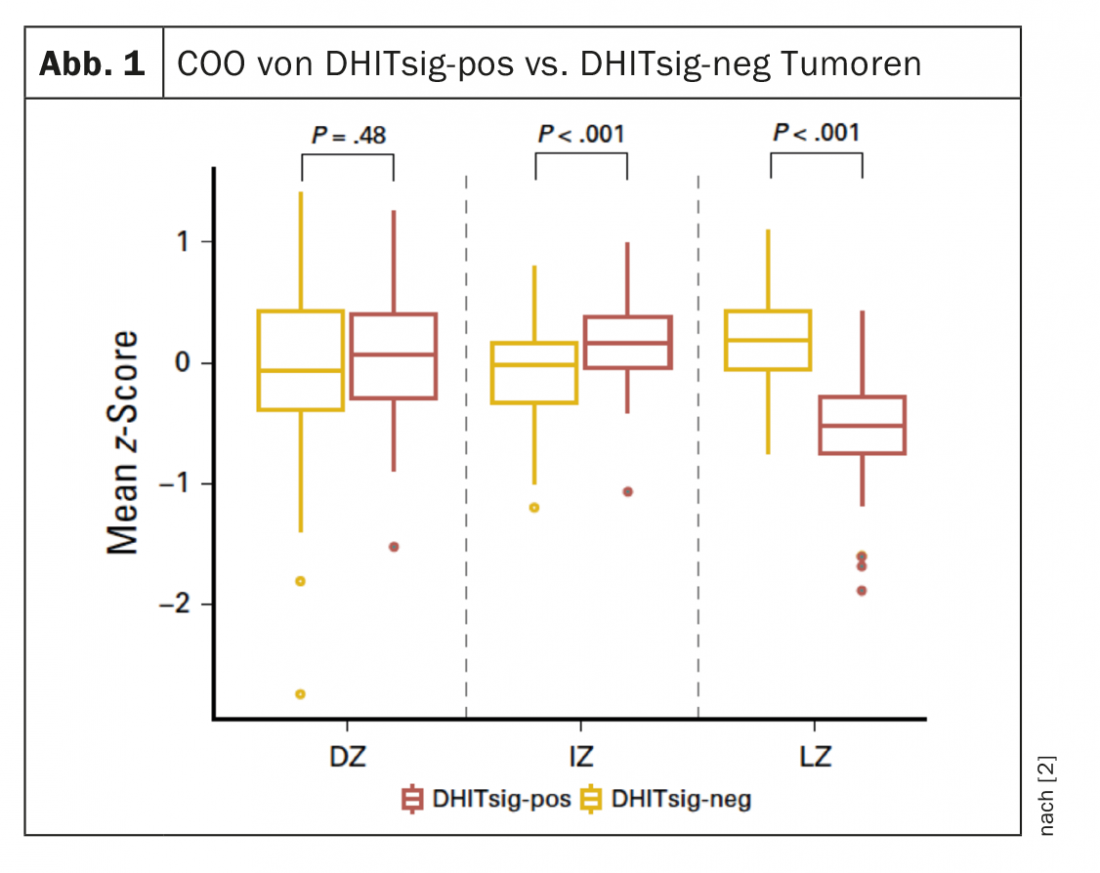
Le DHITsig permet d’identifier les tumeurs qui se distinguent par des caractéristiques biologiques susceptibles d’avoir une incidence sur l’évolution et le traitement. Les tumeurs DHITsig-pos sont caractérisées par un COO de la zone intermédiaire/obscure du type centre germinal (GC) et ont une expression significativement plus faible des gènes de la zone claire par rapport aux tumeurs DHITsig-neg (p<0,001) (Fig. 1). Il s’est avéré que les patients DHITsig positifs avaient un moins bon résultat après immunochimiothérapie R-CHOP par rapport aux patients DHITsig négatifs (taux de survie sans progression à 5 ans, 57% et 81% respectivement ; p<0,001), indépendamment du statut HGBL-DH/TH-BCL2.
L’expression de MYC dans les cellules normales du centre germinal est limitée aux cellules qui se trouvent à l’intérieur de la LZ pour la réentrée dans la DZ. Les auteurs de l’étude suggèrent que ces cellules de recyclage constituent l’antagoniste physiologique des cellules tumorales DHITsig-pos. Outre une incidence élevée de mutations au sein des gènes modifiant la chromatine, ils présentent une incidence élevée de faible expression du CMH-I et du CMH-II et un taux élevé d’expression de gènes associés à la phosphorylation oxydative.
Selon les auteurs, ces caractéristiques biologiques peuvent éventuellement servir de base au développement de substances actives ciblées, au-delà de l’accent mis actuellement sur les inhibiteurs de BCL2. Les approches thérapeutiques possibles qui en découlent concernent la différenciation cellulaire (“enhancer of zeste homolog 2 inhibitors”), la réduction de l’invasion immunitaire (“histone deacetylase inhibitors”), l’augmentation de l’activation des cellules T (anticorps anti-CD20 de nouvelle génération), ainsi que la phosphorylation oxydative et le protéasome. Le taux d’expression élevé de certains gènes indique également que des inhibiteurs spécifiques pourraient être bénéfiques (par exemple, les inhibiteurs de l’arachidonate 5-lipoxygénase).
L’analyse de sous-groupe par la signature d’expression génique DHITsig développée dans cette étude peut être utilisée pour examiner des échantillons de biopsie dans un contexte clinique.
Source : 60e réunion de l’ASH, du 1er au 4 décembre 2018, San Diego (États-Unis)
Littérature :
- Poeschel V, et al : Excellent outcome of young patients (18-60 years) with favourable-prognosis diffuse large B-cell lymphoma (DLBCL) treated with 4 cycles CHOP plus 6 applications of rituximab : results of the 592 patients of the FLYER trial of the Dshnhl/GLA. Oral and Poster Abstracts, Abstract No. 781 : Session : 626. Presented at : ASH Annual Meeting and Exposition ; December 4-8, 2018 ; San Diego, California. Abstract 781, https://ash.confex.com/ash/2018/webprogram/Paper112403.html
- Ennishi D, et al : Double-Hit Gene Expression Signature Defines a Distinct Subgroup of Germinal Center B-Cell-Like Diffuse Large B-Cell Lymphoma. Journal of Clinical Oncology 2018 ; Dec 3:JCO1801583. doi : 10.1200/JCO.18.01583. [Epub ahead of print], Présenté à la 60e conférence annuelle de l’American Society of Hematology, San Diego, CA, décembre 1-4, 2018.
- Pfreundschuh M, Truemper L, Osterborg A, et al : CHOP-like chemotherapy plus rituximab compared with CHOP-like chemotherapy alone in young patients with good-prognosis diffuse large B-cell lymphoma : a randomized controlled trial by the Mabthera International Trial (MInT) Group. Lancet Oncology 2006 ; 7(5) : 379-391.
- NIH : Institut national du cancer. Division du traitement et du diagnostic du cancer. Common Terminology Criteria for Adverse Events, https://ctep.cancer.gov/protocolDevelopment/electronic_applications/ctc.htm#ctc_40, dernière consultation 19.12.2018.
- Menter T, Dirnhofer S : OMS 2017 : progrès, régression ou pas de côté ? Suisse Med Forum 2018 ; 18(03) : 52-54 DOI : https://doi.org/10.4414/smf.2018.03150.
InFo ONKOLOGIE & HÉMATOLOGIE 2019 ; 7(1) : 30-31