La Journée de la circulation cardiaque à l’hôtel Marriott de Zurich a donné un large aperçu des trois principaux organes du système circulatoire : le cœur, les reins et le cerveau. Outre le syndrome cardiorespiratoire et les douleurs thoraciques, la dyspnée, qui a souvent pour origine une insuffisance cardiaque, faisait partie des thèmes principaux.
Selon le Dr Thomas Weinreich, du centre néphrologique de Villingen-Schwenningen, les patients atteints du syndrome cardiorénal “tombent entre la chaise et le banc” : ni les cardiologues ni les néphrologues ne disposent d’instruments thérapeutiques efficaces et la question fondamentale de la catégorisation de cette affection se pose. Or, le cœur et les reins sont intimement liés : L’insuffisance cardiaque (IC) chronique ou aiguë est une cause importante d’insuffisance rénale aiguë ou chronique. Une maladie rénale chronique (“chronic kidney disease”, CKD) est à son tour un facteur de risque cardiovasculaire indépendant [1] – “et ce même lorsque l’insuffisance rénale n’est pas encore particulièrement avancée, avec un DFG inférieur à 60 ml/min [2]”, a expliqué l’orateur. Un syndrome cardiorénal peut être classé cliniquement en une forme légère (IH + DFG 30-59 ml/min), une forme modérée (IH + DFG 15-29 ml/min) et une forme sévère (IH + DFG <15 ml/min ou dialyse). En outre, il est utile d’établir une classification en fonction du temps (aigu/chronique) et en fonction de la maladie sous-jacente : par exemple, si l’insuffisance rénale aiguë est la maladie de base et l’insuffisance cardiaque la maladie secondaire, on parle de type III, le “syndrome rénocardique aigu”.
Il va sans dire que le traitement de ce complexe de maladies difficiles exige une étroite collaboration interdisciplinaire. “It’s time to motivate cardiologists to think more renal and nephrologists to think more cardiac” est un adage qui semble indiqué dans le cas du syndrome cardiorénal. “En effet, quoi que nous fassions sur le plan pharmacologique, nous courons toujours le risque de nuire au patient, car l’insuffisance rénale et l’insuffisance cardiaque impliquent parfois des processus pathologiques exactement opposés”, explique le Dr Weinreich. Il est donc tout à fait logique de réfléchir à un département de thérapies cardiorespiratoires. En principe, le traitement comprend d’une part un allègement du volume. On utilise des diurétiques (aussi bien des diurétiques de l’anse que des diurétiques thiazidiques pour le blocage séquentiel des tubules). L’objectif est d’obtenir un bilan négatif en sodium et en eau. D’autre part, la fonction cardiaque doit être améliorée et les substances potentiellement néphrotoxiques telles que les inhibiteurs de l’ECA, les bloqueurs des récepteurs de l’angiotensine ou les AINS doivent être suspendues. En dernier lieu, l’ultrafiltration (dialyse péritonéale, procédures extracorporelles) peut être une option.
Le patient souffrant de douleurs thoraciques : quelle évaluation est utile ?
“3% de toutes les consultations de médecins généralistes en Suisse sont dues à des douleurs thoraciques” selon le PD Dr Oliver Gämperli, cardiologie, Hôpital universitaire de Zurich. “En principe, ce chiffre ne semble pas si important, mais si l’on tient compte des coûts consécutifs, puisqu’un patient sur cinq est réorienté pour des examens supplémentaires, la charge économique est remarquable”. Après les causes musculo-squelettiques, c’est la maladie coronarienne (MC) qui est le plus souvent responsable des douleurs thoraciques. Parallèlement, l’IRC reste la première cause de mortalité en Europe après le cancer, même si la mortalité liée à l’IRC a nettement diminué au cours des dernières décennies (probablement grâce à de meilleures mesures préventives et thérapeutiques). Il est donc évident que l’établissement d’un diagnostic approprié pour les douleurs thoraciques est un élément clé du système de santé. Le Dr Gämperli a donc cité les trois étapes les plus importantes pour la prise de décision dans la maladie coronarienne (selon les recommandations des directives européennes de l’ESC pour l’évaluation et le traitement de la maladie coronarienne [3], Fig. 1) .

La probabilité pré-test est parfois calculée en fonction de l’âge, du sexe et des symptômes (critères Diamond/Forrester révisés). Elle joue un grand rôle en amont du diagnostic de la maladie coronarienne : “Selon le théorème de Bayes, un test a la meilleure capacité discriminative lorsque la probabilité pré-test est intermédiaire”, a expliqué l’orateur. En ce qui concerne le choix du test de diagnostic, il convient de préciser ce qui suit : l’anamnèse cardiaque reste déterminante dans l’évaluation de la maladie coronarienne. La distinction entre symptômes typiques, atypiques et non angineux est une première approche largement acceptée du tableau clinique du patient, mais ne permet malheureusement pas, dans de nombreux cas, de déterminer de manière fiable la présence d’une maladie coronarienne, comme l’ont montré des études récentes [4]. Quelles sont donc les procédures diagnostiques complémentaires utiles ? Avec une probabilité de pré-test de 15 à 65%, la bicyclette ergométrique reste un test utile, car facile à réaliser et largement disponible. Toutefois, lorsque la probabilité est plus élevée (65%), la signification est imprécise, de sorte que les directives recommandent ici des techniques d’imagerie supplémentaires. Ils jouent un rôle de plus en plus important dans le diagnostic de la maladie coronarienne et fournissent en outre des informations pronostiques essentielles. “Dans ce contexte, la précision diagnostique des différentes méthodes d’imagerie (SPECT, CMR, PET) est à peu près comparable. L’adéquation du patient (fréquence cardiaque, implants métalliques, fenêtres acoustiques, calcifications coronaires, etc.) est bien plus importante pour le choix de la meilleure méthode”, explique le Dr Gämperli.
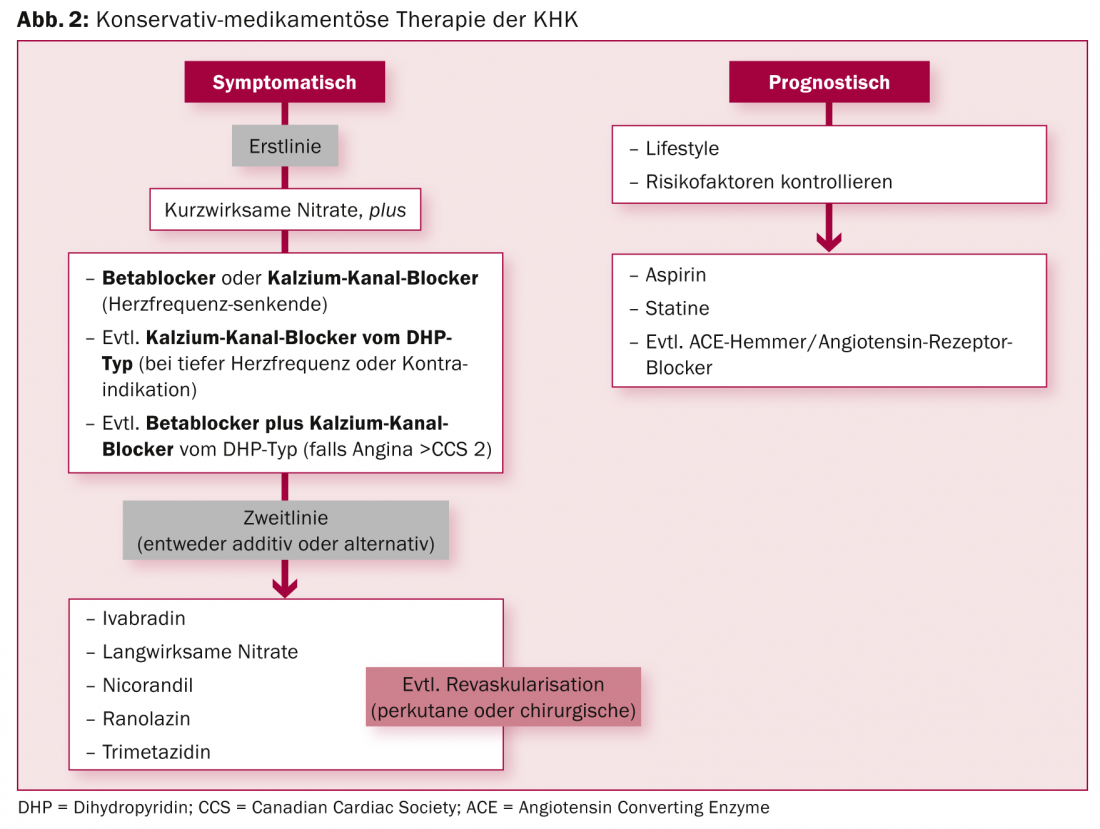
L’IRC stable est en principe une maladie bénigne de bon pronostic. La plupart des patients peuvent être traités en premier lieu par des médicaments. “Il faut cependant identifier les patients à risque, une stratification en termes de traitement est donc très importante”, a expliqué l’expert. La figure 2 résume les possibilités de traitement médicamenteux conservateur. Si une revascularisation s’avère néanmoins nécessaire, la procédure percutanée moderne avec des stents enduits (“drug eluting stents”, DES) se révèle aujourd’hui équivalente à la variante chirurgicale dans de nombreux domaines.
Dyspnée – perspectives cardiologiques et pneumologiques
Selon le PD Dr Andreas Flammer, cardiologie, Hôpital universitaire de Zurich, la dyspnée est le principal symptôme de l’HI, que la fraction d’éjection soit conservée ou réduite. En cas d’HI aiguë, la dyspnée constitue une urgence médicale avec une mortalité élevée, qui mérite une attention appropriée (comme un infarctus). “Contrairement à l’infarctus aigu du myocarde, les interventions en cas d’HI aiguë ne présentent malheureusement que peu de bénéfices – il faut pourtant agir”, a expliqué le Dr Flammer pour illustrer le dilemme. Si la pression artérielle est normale, les diurétiques et les vasodilatateurs sont les principaux piliers (les deux améliorent la dyspnée). La serelaxine a également montré qu’elle pouvait réduire la dyspnée. De plus, dans l’étude RELAX-AHF, la mortalité totale – l’un des critères d’évaluation secondaires – a été significativement réduite par rapport au placebo [5].
Dans le contexte de l’IH chronique symptomatique, le Dr Flammer a fait référence aux jalons médicamenteux qui ont parfois été présentés au congrès de l’ESC 2014, en particulier bien sûr PARADIGM-HF [6]. Une étude de Ruschitzka et al. [7] a également montré en 2013 que la thérapie de resynchronisation cardiaque (CRT) n’apporte aucun bénéfice en cas de complexe QRS étroit, et qu’elle est même plutôt nuisible.
La dyspnée en cas d’HI avec fraction d’éjection préservée (HFpEF) constitue un diagnostic différentiel important et sous-estimé. Le traitement diurétique y est également la pierre angulaire du traitement. Cependant, les résultats des molécules testées (par exemple, périndopril dans PEPCHF, candésartan dans Charm-Preserved, irbésartan dans I-Preserve, spironolactone dans TOPCAT) sont largement décevants. Seul le taux d’hospitalisation a pu être réduit de manière significative, par exemple dans TOPCAT [8] (p=0,04). Les résultats semblent également dépendre de l’origine (les résultats non spécifiques pour le collectif américain ont montré une amélioration significative de l’hospitalisation et de la mortalité).
Enfin, le Dr Daniel Franzen, de la clinique de pneumologie de l’hôpital universitaire de Zurich, a donné un aperçu de l’aspect pneumologique de la maladie. En principe, c’est l’évolution dans le temps de l’anamnèse qui est déterminante : une dyspnée aiguë a le plus souvent pour cause un œdème pulmonaire, les formes chroniques indiquent surtout de l’asthme, mais aussi une BPCO. En clinique, la spirométrie est utile et permet de déduire le VEMS. En outre, la body-pléthysmographie et la mesure de la diffusion du CO permettent de restreindre davantage le diagnostic différentiel d’une maladie pulmonaire chronique. En laboratoire, l’analyse des gaz du sang artériel est à son tour très souvent réalisée et, en imagerie, on utilise la radiographie et, le cas échéant, le scanner thoracique.
“Pour de nombreuses maladies pulmonaires chroniques avec dyspnée, il existe des possibilités de traitement très efficaces : en cas de fibrose pulmonaire, par exemple la pirfénidone [9] (même si le seul traitement présentant un bénéfice en termes de mortalité reste la transplantation pulmonaire) et en cas d’emphysème pulmonaire, la réduction chirurgicale ou bronchoscopique du volume pulmonaire ou la transplantation pulmonaire”. Si l’examen de base est largement normal, il faut penser à une hypertension pulmonaire en cas de dyspnée chronique. (Tab.1).

En cas de dyspnée persistante plusieurs mois après une embolie pulmonaire aiguë, une hypertension pulmonaire thromboembolique chronique (HTTPC) doit être envisagée. “Il ne faut pas non plus oublier les causes psychogènes, après tout, la dyspnée se définit toujours comme une sensation subjective de respiration difficile ou de faim d’air, et non pas en premier lieu comme une hyperpnée, une hypopnée, une tachypnée, une bradypnée, etc.”, a averti l’orateur.
Source : 19e Journée zurichoise de la circulation cardiaque, 4 décembre 2014, Zurich
Littérature :
- Tonelli M, et al : Lancet 2012 Sep 1 ; 380(9844) : 807-814.
- Hillege HL, et al : Circulation 2006 Feb 7 ; 113(5) : 671-678.
- Montalescot G, et al : Eur Heart J 2013 Oct ; 34(38) : 2949-3003.
- Cheng VY, et al : Circulation 2011 Nov 29 ; 124(22) : 2423-2432, 1-8.
- Teerlink JR, et al : Lancet 2013 Jan 5 ; 381(9860) : 29-39.
- McMurray JJV, et al : N Engl J Med 2014 ; 371 : 993-1004.
- Ruschitzka F, et al : N Engl J Med 2013 Oct 10 ; 369(15) : 1395-1405.
- Pitt B, et al : N Engl J Med 2014 Apr 10 ; 370(15) : 1383-1392.
- Noble PW, et al : Lancet 2011 mai 21 ; 377(9779) : 1760-1769.
CARDIOVASC 2015 ; 14(1) : 33-35