Les patients atteints de broncho-pneumopathie chronique obstructive (BPCO) sont sujets à des infections pulmonaires qui aggravent considérablement les symptômes (surtout ceux de la dyspnée). Les données épidémiologiques sont toutefois rares.
Les patients atteints de broncho-pneumopathie chronique obstructive (BPCO) sont susceptibles de contracter des infections pulmonaires qui aggravent considérablement les symptômes, en particulier ceux de la dyspnée. Cependant, les données épidémiologiques sur une telle BPCO exacerbée par l’infection (AECOPD) sont rares [1].
La BPCO (GOLD II-IV) a une prévalence (>40 ans) d’environ 5,9%. Cette population de patients connaît entre 0,6 et 2,7 exacerbations aiguës par an [2]. La détérioration aiguë de la respiration représente un risque de mortalité important pour les patients atteints de BPCO, environ 10% des patients hospitalisés avec une AECOPD décèdent. Les causes de l’AECOPD sont dans la majorité des cas (environ 60%) des infections, pour moitié virales et pour moitié bactériennes. Dans environ 30% des cas, aucun facteur déclenchant ne peut être trouvé. Il convient de garder à l’esprit que les toxines inhalées telles que la nicotine et les oxydes d’azote peuvent déclencher une exacerbation.
Une détérioration respiratoire aiguë peut bien sûr être déclenchée par d’autres facteurs, de sorte que les diagnostics différentiels peuvent inclure, outre la pneumonie aiguë, une insuffisance cardiaque, un pneumothorax, un épanchement pleural, des embolies pulmonaires ou des arythmies récemment apparues [3]. Dans une étude portant sur 1016 patients, les motifs d’hospitalisation en cas de suspicion d’AECOPD étaient les suivants : 48% d’infections respiratoires, 26% d’insuffisance cardiaque, 3% de cancer bronchique, 1% d’embolie pulmonaire, et 1% de pneumothorax [4]. Les possibilités thérapeutiques au cours d’une AECOPD ne sont actuellement pas standardisées et leur efficacité est parfois limitée. C’est pourquoi la prévention de l’exacerbation est d’une grande importance.
Les patients BPCO souffrant d’exacerbations répétées ont une qualité de vie et une espérance de vie réduites (environ 10% des patients BPCO hospitalisés décèdent). La prévention d’une exacerbation peut être obtenue par exemple au moyen de mycolytiques et de bronchodilatateurs oraux. Il est intéressant de noter dans ce contexte que si la gravité d’une exacerbation est réduite, la mortalité ne l’est pas [5]. Les possibilités d’imagerie en cas d’AECOPD sont abordées ci-dessous. L’accent sera toutefois mis sur l’évaluation diagnostique du risque d’AECOPD chez les patients atteints de BPCO.
Imagerie
Les patients atteints de BPCO, en particulier, ne peuvent pas retenir leur souffle longtemps et ont du mal à rester à plat sur le dos. Pour obtenir néanmoins des images “nettes” du thorax, l’acquisition doit donc être aussi rapide que possible. Deux modalités d’examen répondent à ces exigences : la radiographie et la tomodensitométrie (TDM). Dans le cadre de l’étude PROVIDI, les possibilités de la TDM pour prédire l’AECOPD ont été examinées en détail [6].
Radiographie du thorax
L’examen radiologique initial d’un patient atteint d’AECODP consiste en une radiographie du thorax, si possible en position debout dans deux plans [2]. Cela permet d’exclure les maladies de diagnostic différentiel telles que la pneumonie, le pneumothorax, l’épanchement pleural ou l’insuffisance cardiaque. Environ un cinquième des patients présumés atteints d’AECOPD voient leur diagnostic changer, principalement en raison d’une pneumonie, et leur traitement changer en conséquence [3,7–9].
La radiographie du thorax des patients atteints de BPCO révèle des changements caractéristiques par rapport aux personnes en bonne santé. En particulier, l’hyperinflation marquée est évidente, avec des diaphragmes bas, une augmentation de l’espace rétrosternal et une augmentation de l’espace intercostal. La silhouette cardiaque est généralement plutôt étroite et on observe une vascularisation pulmonaire rare. Dans le cadre d’une exacerbation infectieuse, on constate souvent un épaississement des parois bronchiques, ce qui entraîne une nette réduction de la ventilation des parties du poumon situées en périphérie (Fig. 1).
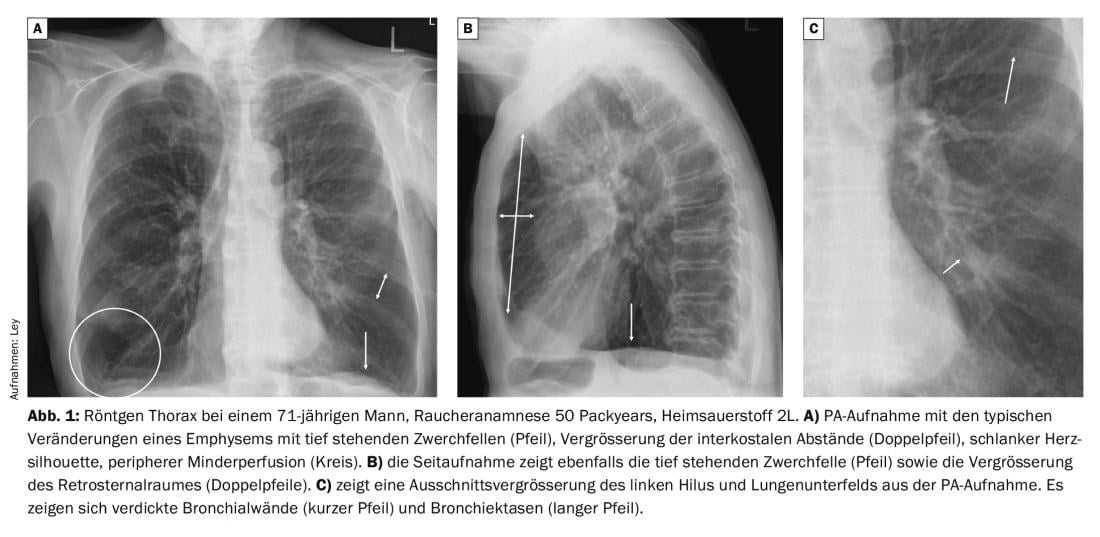
Comme indiqué ci-dessus, environ 20% des patients présentent des résultats pertinents tels que des pneumonies. Dans le cas d’une infection bactérienne typique, on observe un épaississement en surface d’un segment, d’un lobe ou du poumon entier (Fig. 2).

Une étude récente sur des patients AECOPD non hospitalisés a montré un infiltrat dans 20% des cas [10]. De nombreux agents pathogènes ont été identifiés, par exemple Haemophilus et Streptococcus. Il est intéressant de noter qu’il n’y avait pas de différence dans la colonisation pulmonaire entre les patients BPCO avec exacerbation et ceux sans exacerbation. D’autre part, les pneumonies étaient plus fréquentes pendant les mois d’hiver. Il a donc été conclu que les exacerbations et les pneumonies chez les patients atteints de BPCO ont des déclencheurs infectieux communs et constituent un continuum plutôt que des entités distinctes.
Tomodensitométrie (CT)
Un scanner du thorax centré sur le parenchyme pulmonaire peut être réalisé sans injection intraveineuse de produit de contraste. L’admission en apnée est souhaitable, mais ne peut pas toujours être réalisée par les patients atteints d’AECOPD. Il est parfois difficile de se coucher à plat sur la table d’examen et de retenir sa respiration pendant 4 à 10 secondes (selon le scanner). Lorsqu’il s’agit d’exclure une embolie artérielle pulmonaire, l’administration de KM par voie i.v. est indispensable. L’épaisseur de couche de 1 mm s’est imposée pour les deux questions.
Les modifications phénotypiques de la BPCO peuvent être classées en un phénotype d’emphysème et un phénotype respiratoire [11]. On parle de dilatation bronchique lorsque la lumière de la bronche représente 110 à 150% de la lumière de l’artère pulmonaire concomitante. Au-delà de 150%, on parle d’ectasie. De plus, dans les bronchectasies, on constate une absence de rétrécissement vers la périphérie. Les bronchectasies peuvent avoir une configuration cylindrique, variqueuse ou kystique.
La paroi bronchique est évaluée en fonction du rapport diamètre interne/diamètre externe : Si le rapport est de 0,5-0,8, on parle d’un épaississement léger de la paroi, <0,5 désigne un épaississement sévère de la paroi. De plus, chez les patients BPCO ayant des antécédents de tabagisme, on trouve souvent des bronches obstruées par du mucus.
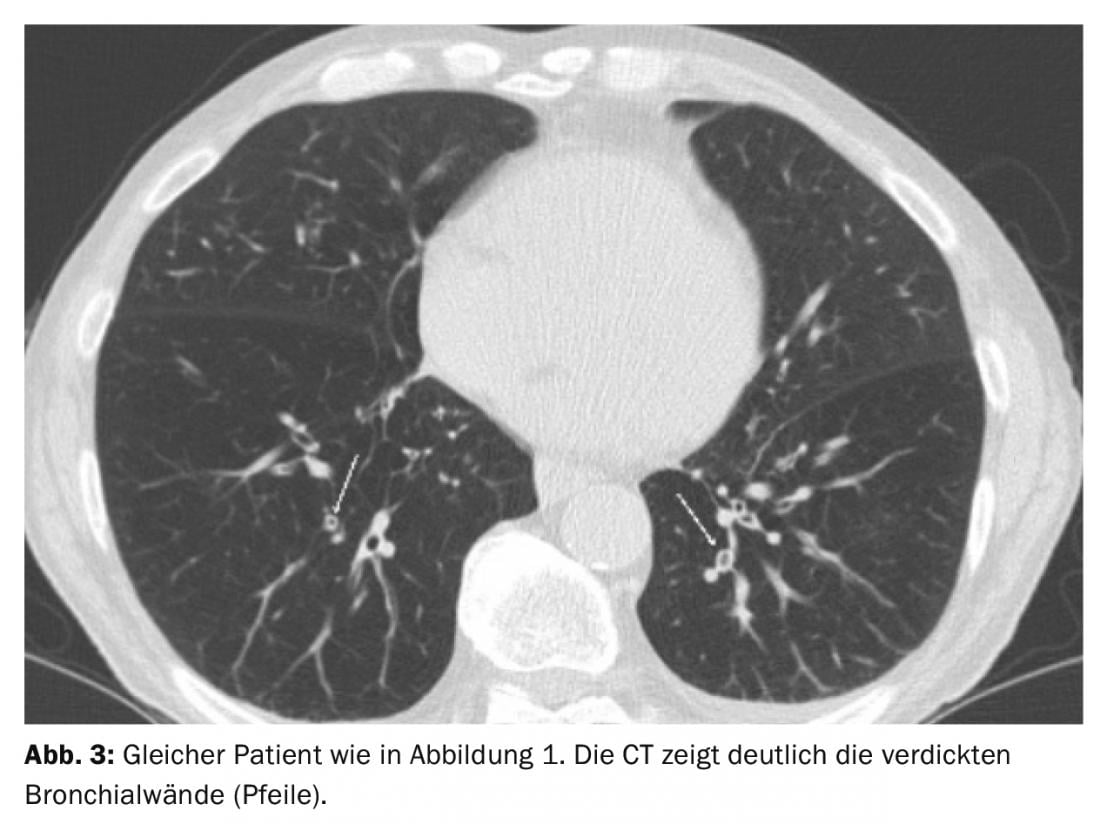
En particulier, les patients présentant un type d’appareil respiratoire semblent particulièrement vulnérables à l’AECOPD. Le scanner a montré que l’épaississement de la paroi bronchique était significativement plus fréquent dans le cadre de l’AECOPD que dans l’intervalle “normal” (Fig. 3) [12]. Cependant, la concordance inter-recteurs est mauvaise pour l’évaluation de l’épaississement de la paroi bronchique.
Comme mentionné initialement, la prévention de l’exacerbation est un objectif important. Pour cela, il faut identifier les patients présentant une susceptibilité accrue à l’exacerbation. L’étude BPCO-Gene a identifié 833 patients ayant eu 0-1 exacerbation et 169 patients ayant eu plus de 2 exacerbations [13]. Il s’est avéré que pour chaque mm d’augmentation de l’épaisseur de la paroi bronchique au niveau des segments, le taux annuel d’exacerbation était multiplié par 1,84. Les patients présentant plus de 35% d’emphysème pulmonaire ont vu leur taux d’exacerbation multiplié par 1,18 pour chaque augmentation de 5% de l’emphysème. Ces données suggèrent qu’un phénotypage de routine des patients atteints de BPCO par scanner semble pertinent.
Outre l’épaisseur de la paroi, la dilatation bronchique est également très pertinente pour une exacerbation. Les bronchectasies augmentaient significativement le risque d’exacerbation (odds ratio de 4,99) et étaient le prédicteur le plus fort parmi plusieurs paramètres (Fig. 4) [14]. La détection ou la connaissance des bronchectasies a également une pertinence thérapeutique évidente, car une antibiothérapie i.v. pour P. aeroginosa peut par exemple être indiquée en présence de bronchectasies [1]. La colonisation bactérienne dans de telles bronchectasies en cas d’exacerbation laisse souvent supposer la présence d’agents pathogènes atypiques, notamment des mycobactéries. Il a été démontré que les mycobactéries étaient plus fréquemment détectées chez les patients présentant des exacerbations rares de la BPCO que chez les patients présentant des exacerbations fréquentes [14].

Outre les voies respiratoires périphériques, les voies respiratoires centrales, la trachée et les bronches principales, jouent également un rôle important dans la limitation des flux respiratoires. Les patients atteints de BPCO génèrent une pression négative considérable dans la trachée et les bronches principales lors de l’inspiration. Deux facteurs entraînent (séparément ou ensemble) un collapsus des voies respiratoires centrales expiratoires (ECAC : expiratory central airway collaps) [15].
Au fil du temps, les attaches cartilagineuses peuvent se ramollir, ce qui aboutit à une malacie. Une telle trachéobronchomalacie a une prévalence de 5-10% chez les patients BPCO [16]. En outre, on observe une augmentation du bombement de la pars membranacea. Lorsque celle-ci entraîne une réduction de la lumière de >50%, on parle de “collapsus dynamique excessif des voies aériennes” (EDAC : excessive dynamic airway collapse) (Fig. 5).
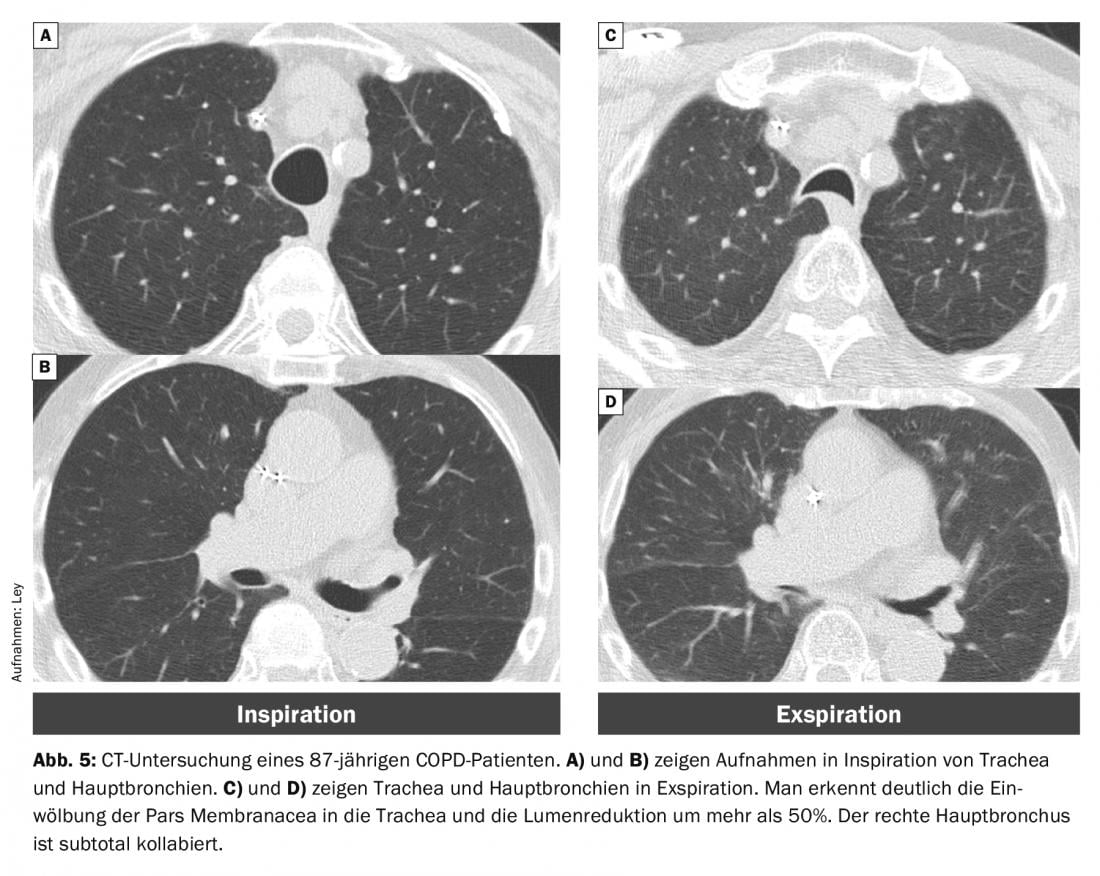
Il est bien connu que les patients atteints de BPCO présentent un taux de collapsus des voies respiratoires significativement plus élevé que les patients normaux. Cependant, cela ne joue pas un rôle pertinent dans la genèse d’une exacerbation, car l’instabilité des voies aériennes ne diffère pas entre les BPCO stables et exacerbées [15].
Cependant, il semble également y avoir un lien entre la sévérité de l’emphysème pulmonaire et les exacerbations [17]. Les patients ont été recrutés dans une population de dépistage du cancer du poumon. Le phénotype BPCO de type emphysème ou non emphysème a été déterminé. Les patients présentant un phénotype d’emphysème étaient nettement plus sévèrement atteints (VEMS prédit : 61% vs 90%) que les patients BPCO non emphysémateux. Il n’est donc pas vraiment surprenant que les exacerbations aient été plus fréquentes dans le groupe de patients plus gravement atteints que dans la population presque saine.
Un effet transversal est la ventilation de régions pulmonaires individuelles. L’hélium hyperpolarisé permet de visualiser la ventilation régionale dans l’imagerie par résonance magnétique (IRM). Chez les patients atteints de BPCO, on trouve régulièrement des défauts de ventilation. Chez les patients atteints de BPCO légère à modérée, l’étendue des défauts de ventilation était en corrélation avec le nombre d’exacerbations [18]. Les défauts de ventilation étaient à leur tour corrélés à l’ampleur de la destruction parenchymateuse (emphysème) et à la maladie respiratoire – soit un phénotype mixte de BPCO. Étant donné que les examens IRM de ventilation ne peuvent être réalisés que dans certains centres dans le monde et que l’évaluation du parenchyme pulmonaire/des voies respiratoires est limitée, des cartes de ventilation ont été établies à l’aide du scanner. Pour ce faire, des ensembles de données TDM inspiratoires et expiratoires de la cohorte BPCO-Gène ont été examinés [19]. Les données ont été superposées à l’aide d’un registre non rigide. Des cartes régionales de déformation ont ainsi pu être établies. Étonnamment, les patients présentant un nombre accru d’exacerbations (≥6/an) présentaient une ventilation plus homogène que les patients ne présentant aucune exacerbation.
Les jeux de données CT offrent également la possibilité de segmenter les structures anatomiques, par exemple les voies respiratoires, en raison de leur haute résolution spatiale. Ces données segmentées peuvent ensuite être utilisées, par exemple, pour une simulation des flux respiratoires et des résistances régionales. 42 patients atteints de BPCO ont été examinés par scanner pendant une exacerbation et pendant 6 à 8 semaines au cours de l’évolution [20]. Les voies respiratoires ont été segmentées à partir des données du scanner et utilisées pour une simulation des flux respiratoires. Il s’est avéré que pendant une exacerbation, il y a une augmentation significative de la résistance des voies respiratoires centrales et périphériques. Il était intéressant de constater que c’était surtout la diminution de la résistance périphérique des voies respiratoires qui était associée à la récupération fonctionnelle. Par conséquent, une inflammation excessive des voies respiratoires périphériques semble être un facteur déterminant dans l’apparition d’une exacerbation (les voies respiratoires de 4e à 8e génération bronchique ont été étudiées). Cela signifie que ces régions doivent être atteintes de manière thérapeutique, mais comme les flux respiratoires sont significativement modifiés pendant une exacerbation, des médicaments oraux ou des substances inhalées de très petit diamètre doivent être administrés.
Digression sur l’hypertension artérielle pulmonaire
On sait que la BPCO affecte non seulement les petites voies respiratoires et les alvéoles, mais aussi les petites artères pulmonaires (diamètre <500 µm). Ces modifications vasculaires sont également observées chez les patients atteints de BPCO modérée et chez les fumeurs dont la fonction pulmonaire est normale. On peut donc supposer que la vasculopathie apparaît dès les premiers stades d’une maladie respiratoire associée au tabagisme. Environ 4% des patients atteints de BPCO ont une hypertension pulmonaire (HTP), l’HTP-COPD est répertoriée dans le groupe 3 de la classification OMS des HTP [21]. Dans une grande étude portant sur plus de 54.000 participants, la PH-COPD était un facteur de risque significatif pour le traitement et la mortalité de l’AECOPD en milieu hospitalier. D’autre part, une étude échocardiographique a montré l’effet d’une exacerbation sur la fonction cardiaque droite : Pendant l’exacerbation, la PASP estimée était de 40 mmHg et après la convalescence de 29 mmHg [22]. Cependant, l’échocardiographie est parfois difficile pour évaluer la PASP chez les patients atteints de BPCO, et le standard de référence, le cathéter cardiaque droit invasif, ne peut pas être réalisé chez tous les patients atteints de BPCO. Là encore, le scanner est d’un grand secours avec une mesure simple : un rapport diamètre de l’artère pulmonaire/aorte ascendante >1:1 était clairement associé à la survenue d’une AECOPD (Odds Ratio 4,78) (Fig. 6) [23]. Concrètement, les patients de l’étude sur les gènes de la BPCO ayant un rapport PA:A >1 ont présenté une exacerbation dans 53% des cas. La détermination du diamètre de l’artère pulmonaire peut se faire sur des couches axiales, juste avant la bifurcation [24].

Messages Take-Home
- En cas de suspicion de BPCO exacerbée, l’examen radiographique du thorax est une méthode importante pour identifier les diagnostics différentiels.
- L’évaluation du statut et la caractérisation de la BPCO par tomodensitométrie sont des examens utiles pour déterminer le risque individuel d’exacerbation.
- Les patients présentant un phénotype respiratoire de BPCO (épaississement des parois et dilatation des bronches) sont particulièrement susceptibles de développer une exacerbation.
Littérature :
- Hoffken G, Lorenz J, Kern W, et al : (2005) [S3-guideline on ambulant acquired pneumonia and deep airway infections]. Pneumologie 59 : 612-664.
- Lange CG, Scheuerer B, Zabel P : (2004) [Acute exacerbation of COPD]. Internist (Berl) 45 : 527-538.
- McCrory DC, Brown C, Gelfand SE, Bach PB : (2001) Management of acute exacerbations of COPD : a summary and appraisal of published evidence. Chest 119 : 1190-1209.
- Connors AF, Jr, Dawson NV, Thomas C, et al : (1996) Outcomes following acute exacerbation of severe chronic obstructive lung disease. The SUPPORT investigators Study to Understand Prognoses and Preferences for Outcomes and Risks of Treatments). Am J Respir Crit Care Med 154 : 959-967
- Wedzicha JA, Calverley PMA, Albert RK, et al. : (2017) Prevention of COPD exacerbations : a European Respiratory Society/American Thoracic Society guideline. Eur Respir J 50.
- Jairam PM, van der Graaf Y, Lammers JW, et al. : (2015) Les observations incidentes sur le scanner thoracique sont associées à une augmentation des exacerbations de la BPCO et de la mortalité. Thorax 70 : 725-731.
- Emerman CL, Cydulka RK : (1993) Evaluation des critères de haut niveau pour la radiographie thoracique dans l’exacerbation aiguë de la bronchopneumopathie chronique obstructive. Ann Emerg Med 22 : 680-684
- Snow V, Lascher S, Mottur-Pilson C : (2001) The evidence base for management of acute exacerbations of COPD : clinical practice guideline, part 1. Chest 119 : 1185-1189.
- Soto FJ, Varkey B : (2003) Evidence-based approach to acute exacerbations of COPD. Curr Opin Pulm Med 9:117-124
- Williams NP, Ostridge K, Devaster JM, et al. : (2018) Impact des exacerbations radiologiquement stratifiées : insights into pneumonia aetiology in COPD. Respir Res 19 : 143.
- Lynch DA, Austin JH, Hogg JC et al (2015) CT-Definable Subtypes of Chronic Obstructive Pulmonary Disease : A Statement of the Fleischner Society. Radiologie. 10.1148/radiol.2015141579:141579
- Hackx M, Ghaye B, Coche E, et al. : (2015) Exacerbation sévère de la BPCO : caractéristiques CT. Copd 12 : 38-45.
- Han MK, Kazerooni EA, Lynch DA, et al. : (2011) Les exacerbations de la maladie pulmonaire obstructive chronique dans l’étude COPDGene : phénotypes radiologiques associés. Radiology 261 : 274-282.
- Kawamatawong T, Onnipa J, Suwatanapongched T (2018) Relations entre la présence de bronchiectasies et les exacerbations aiguës chez les patients BPCO thaïlandais. Int J Chron Obstruct Pulmon Dis 13 : 761-769
- Leong P, Tran A, Rangaswamy J, et al. : (2017) Expiratory central airway collapse in stable COPD and during exacerbations. Respir Res 18:163
- Patel R, Irugulapati L, Patel V, et al. : (2009) La prévalence de la trachéobronchomalacie chez les patients souffrant d’asthme ou de maladie pulmonaire obstructive chronique. The Internet Journal of Pulmonary Medicine 12 : 1-5.
- Barros MC, Hochhegger B, Altmayer S, et al. : (2018) Quantitative computed tomography phenotypes, spirometric parameters, and episodes of exacerbation in heavy smokers : An analysis from South America. PLoS One 13 : e0205273.
- Kirby M, Pike D, Coxson HO, et al. : (2014) Hyperpolarized (3)He ventilation defects used to predict pulmonary exacerbations in mild to moderate chronic obstructive pulmonary disease. Radiology 273 : 887-896.
- Bragman FJ, McClelland JR, Modat M, et al. : (2014) Multi-scale analysis of imaging features and its use in the study of COPD exacerbation susceptible phénotypes. Med Image Comput Comput Assist Interv 17 : 417-424.
- Hajian B, De Backer J, Vos W, et al : (2018) Changes in ventilation-perfusion during and after an COPD exacerbation : an assessment using fluid dynamic modeling. Int J Chron Obstruct Pulmon Dis 13 : 833-842.
- Medrek SK, Sharafkhaneh A, Spiegelman AM, et al. : (2017) Admission pour l’exacerbation de la BPCO est associée au diagnostic clinique de l’hypertension pulmonaire : Résultats d’une étude longitudinale rétrospective d’une population d’anciens combattants. Copd 14 : 484-489.
- Ozben B, Eryuksel E, Tanrikulu AM, et al. : (2015) Acute Exacerbation Impairs Right Ventricular Function in COPD Patients. Hellenic J Cardiol 56 : 324-331.
- Wells JM, Washko GR, Han MK, et al : (2012) Pulmonary arterial enlargement and acute exacerbations of COPD. N Engl J Med 367 : 913-921.
- Rho JY, Lynch DA, Suh YJ, et al. : (2018) CT measurements of central pulmonary vascular as predictors of severe exacerbation in COPD. Medicine (Baltimore) 97 : e9542.
- Vogelmeier C, Buhl R, Burghuber O, et al. : (2018) S2k-Leitlinie zur Diagnostik und Therapie von Patienten mit chronisch obstruktiven Bronchitis und Lungenemphysem (COPD). AWMF en ligne.
InFo PNEUMOLOGIE & ALLERGOLOGIE 2019 ; 1(2) : 10-14