L’endocardite infectieuse est une infection de l’endocarde, en particulier des feuillets valvulaires, dont l’incidence annuelle est de 3 à 10/100 000 personnes. En cas de mortalité et de morbidité élevées, les stratégies de prévention, telles que le respect de l’antibioprophylaxie (AP) chez les patients présentant des antécédents cardiaques, sont une priorité absolue. Les directives actuelles limitent l’AP aux patients à haut risque et aux interventions principalement dans la zone buccale/dentaire.
L’endocardite infectieuse (EI) est une infection de l’endocarde et plus particulièrement des feuillets valvulaires, dont l’incidence annuelle est estimée à 3-10 pour 100 000 personnes [1–3]. La principale caractéristique de l’EI est l’infection des végétations des valves cardiaques, qui peuvent s’emboliser dans l’organisme et former d’autres foyers d’infection septique. Le pronostic de la maladie est mauvais, avec une mortalité hospitalière de 15-20% et une mortalité à un an de 30% [1,4]. La morbidité chez les survivants est élevée, avec un risque résiduel de rechute, de nouvelle infection ou de détérioration progressive de la fonction de la valve, qui peut être associée à une insuffisance cardiaque et à la nécessité d’une intervention médicale et chirurgicale supplémentaire [1,4]. Malgré l’amélioration des traitements médicaux et chirurgicaux au cours des 30 dernières années, l’IE reste donc l’une des maladies infectieuses les plus meurtrières.
En cas de persistance d’une mortalité et d’une morbidité élevées, les stratégies de prévention, telles que le respect de l’antibioprophylaxie (AP) chez les patients présentant des antécédents cardiaques, sont une priorité absolue. Les directives AP sur l’endocardite ont été établies pour la première fois en 1955 par l’American Heart Association (AHA), bien qu’elles aient considérablement évolué depuis leur introduction. De nombreux pays et associations professionnelles ont ainsi modifié les directives et les ont adaptées à leurs propres besoins. En outre, une simplification a eu lieu en 2008.
La nécessité d’une protection antibiotique a été limitée aux patients à haut risque, les patients présentant un risque moyen d’EI n’étant plus pris en compte dans la plupart des directives actuelles. Il s’agit notamment de la valve aortique bicuspide, du prolapsus de la valve mitrale, ainsi que du défaut de septum ventriculaire (VSD) et de la persistance du canal de Botal (PDA). En raison du manque de données cliniques (notamment l’absence d’étude randomisée et contrôlée sur le sujet), l’AP pour la prévention de l’IE reste un sujet controversé. Actuellement, les directives suivantes sont valables pour la Suisse : les directives de l’AHA de 2007 [3], les directives AP de Flückiger et al. révisées en 2008. [5] et les lignes directrices de l’ESC de 2015 [6]. Les directives suisses sur la prophylaxie de l’endocardite [5] n’ont pas été révisées depuis 2008. Comme il existe certaines divergences avec les lignes directrices de l’ESC 2015 [6] sur le sujet, nous souhaitons profiter de l’occasion pour discuter de certains points et nouveautés.
Contexte historique : la voie de la simplification et de la restriction
L’IE en tant qu’entité pathologique a été identifiée pour la première fois en 1870 par Winge et al. décrites [8]. L’hypothèse selon laquelle des bactéries peuvent pénétrer dans le système circulatoire au cours d’une intervention dentaire invasive et provoquer ainsi une EI a été émise pour la première fois en 1923 par Lewis et Grant, bien que cette thèse n’ait été prouvée qu’en 1935 par Okell et Elliott. Ces auteurs ont ainsi pu déduire que 61% des patients ayant subi une extraction dentaire ont des hémocultures positives pour Streptococcus viridans, alors que l’on sait que Streptococcus viridans peut être identifié comme le germe responsable dans 40 à 45% des cas d’IE. Connaissant l’effet antimicrobien des sulfamides, il a été postulé pour la première fois en 1930 qu’un AP pourrait entraîner une réduction de la fréquence de l’EI. D’abord Hirsch et al. ont montré dans une étude randomisée une réduction de la bactériémie streptococcique au moyen de la pénicilline, ouvrant ainsi la voie aux premières directives officielles de l’AHA sur la prophylaxie de l’endocardite, publiées en 1955.
Directives suisses sur la prophylaxie de l’endocardite
Après la publication par Moreillon des premières directives suisses sur le sujet en 2000 [9], les directives ont été considérablement simplifiées en 2008. Cela reposait sur les considérations suivantes :
- Les activités quotidiennes telles que le brossage des dents ou la mastication sont plus susceptibles de provoquer une IE qu’une intervention dentaire.
- Même si l’AP est efficace à 100 %, il ne permet de prévenir qu’un petit nombre d’EI.
- Les patients à haut risque sont plus susceptibles d’avoir une évolution létale de l’IE que les autres patients
- Les effets secondaires des antibiotiques et leur coût doivent être pris en compte.
Les directives suisses pour la prophylaxie de l’endocardite [5], révisées en 2008, sont basées sur les directives 2007 de l’AHA [3] et sur les directives allemandes AP de 2007 [10]. L’utilisation d’une prophylaxie antibiotique pour prévenir l’EI est généralement considérée comme justifiée, car l’EI, bien que rare, est associée à une mortalité et une morbidité élevées. En outre, une courte prévention médicamenteuse est préférable à un traitement prolongé de l’infection, en particulier chez les patients présentant des antécédents cardiaques ou des épisodes antérieurs d’IE, qui sont susceptibles de récidiver. En outre, les bactéries de la flore buccale, du tractus gastro-intestinal et du tractus urogénital peuvent favoriser l’IE. En fin de compte, l’efficacité d’un AP pour éviter l’IE n’a pu être démontrée que dans des expériences sur des animaux, mais un AP est très probablement efficace chez l’homme également.
Mesures périopératoires générales non spécifiques
Il est important de respecter les mesures générales périopératoires telles qu’une hygiène dentaire, buccale et cutanée rigoureuse pour tous les patients, en particulier pour le groupe à haut risque [6]. Dans tous les cas, une bonne hygiène buccale est bien plus importante qu’un antibiotique à un moment donné de la vie, car une bactériémie se produit quotidiennement, même en mâchant et en se brossant les dents. Éviter les piercings et les tatouages est également très important dans ce contexte. Si des plaies existent au moment de l’opération, elles doivent être soigneusement désinfectées. En outre, tout foyer infectieux doit être correctement traité par antibiotique et tout agent pathogène doit être éradiqué afin de réduire la colonisation bactérienne. Chez les patients à haut risque, l’indication de cathéters veineux centraux et d’examens invasifs doit être retenue et les mesures d’hygiène hospitalière doivent être respectées d’urgence.
Indications pour la prophylaxie de l’endocardite
L’AP n’est recommandée que pour les patients à haut risque lors d’interventions bien définies qui sont associées à un risque accru de bactériémie (tableau 1). Les patients qui reçoivent une prophylaxie antibiotique périopératoire n’ont pas besoin de prophylaxie de l’endocardite, car les bactéries rencontrées lors de l’opération prévue sont déjà couvertes par l’administration de l’antibiotique spécifiquement choisi.
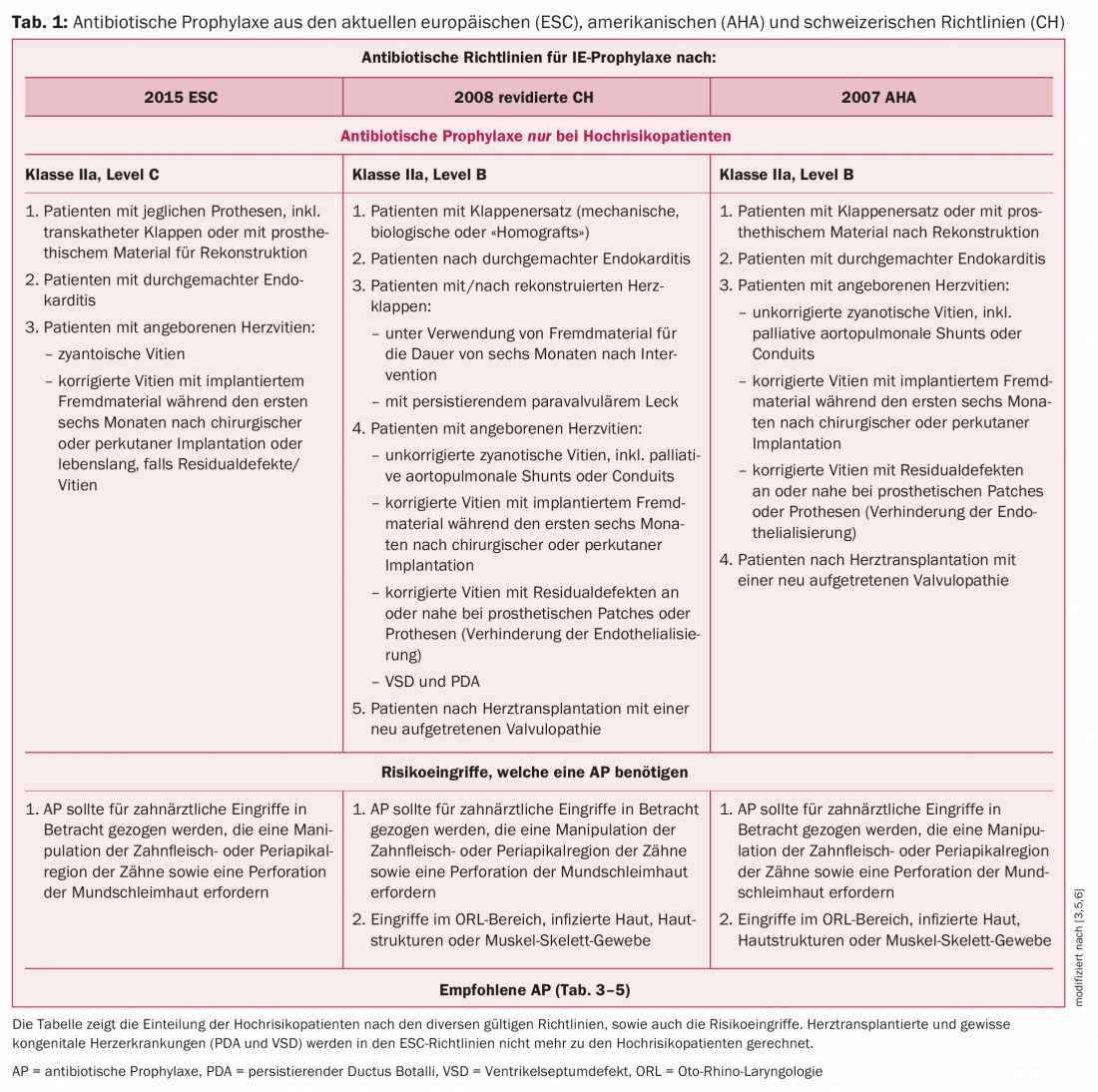
Les patients à haut risque sont définis différemment selon les directives. Pour résumer grossièrement, ce groupe peut être divisé en patients porteurs de prothèses, patients atteints de cardiopathies congénitales ou d’endocardites antérieures. Alors que les directives de l’AHA et de la Suisse incluaient encore les transplantés cardiaques dans les patients à risque, les directives européennes de 2015 ne prennent plus en compte ce groupe pour la prophylaxie de l’endocardite. Il s’agit d’un sujet controversé et il existe différents points de vue sur le sujet selon les groupes de travail. En raison de l’immunosuppression avec une mauvaise évolution en cas d’IE ainsi que de la présence fréquente d’une valvulopathie (par ex. insuffisance tricuspide suite aux biopsies cardiaques répétées), nous continuons à recommander, contrairement aux directives de l’ESC, une AP avant les interventions à risque. Pour plus de détails sur la définition des patients à haut risque, voir le tableau 1 et le tableau 2.

Classification des AP par interventions/interventions et systèmes d’organes
On entend par AP une dose unique (perorale ou parentérale) d’un antibiotique administrée 30 à 60 minutes avant l’intervention. L’objectif est d’obtenir une efficacité maximale de l’antibiotique pendant l’intervention. L’administration perorale est privilégiée pour les petites interventions, généralement dentaires ou cutanées, et l’administration parentérale pour les interventions plus importantes et/ou sous anesthésie. L’AP en dose unique avant l’intervention est limitée aux interventions dentaires afin d’éviter le développement d’une EI suite à une bactériémie transitoire. Toutes les autres interventions dans les voies respiratoires, la peau, le tractus urogénital et le tractus gastro-intestinal sans indication d’infection ne constituent plus une indication d’AP [6]. Les interventions abdominales électives constituent une exception importante, pour lesquelles une dose parentérale unique est recommandée (prophylaxie antibiotique périopératoire). En cas d’infections préexistantes, l’AP doit être considérée comme la première dose d’un traitement antibiotique plus long et nécessaire. Dans ce cas, nous recommandons de faire appel à un infectiologue afin d’adapter au mieux le traitement antibiotique. Les recommandations posologiques du traitement prophylactique unique de l’AP sont basées sur une fonction rénale et hépatique normale. Un ajustement de la dose n’est généralement pas nécessaire en cas d’administration unique, mais il est bien entendu nécessaire en cas de traitement prolongé. Les directives AP pour les enfants sont très similaires à celles des adultes. Dans ce cas, seul le dosage des antibiotiques diffère.
Interventions dentaires
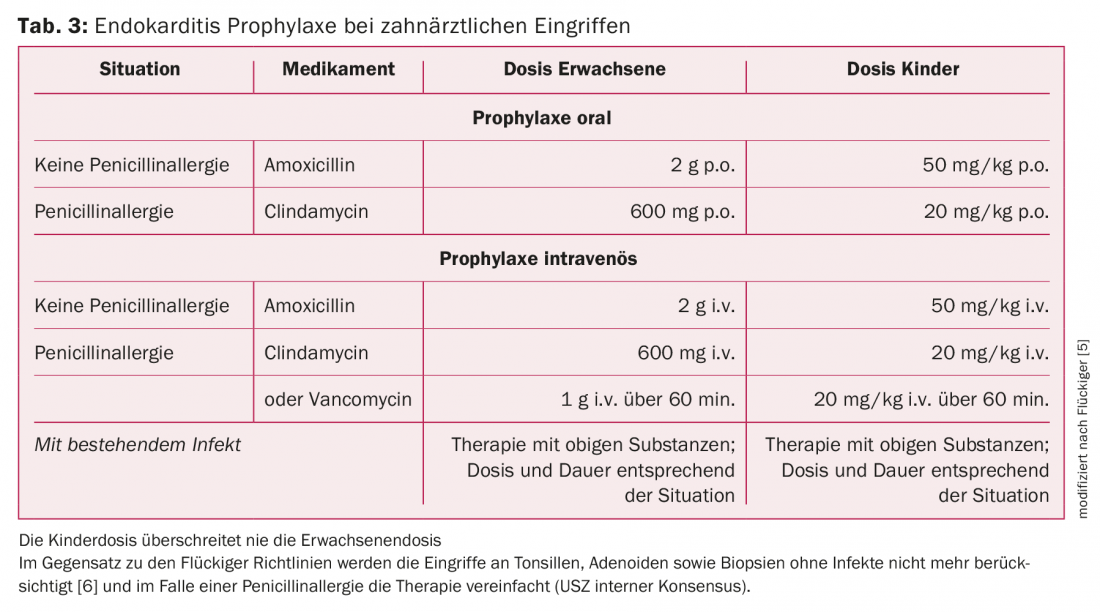
Dents et/ou mâchoires : la condition principale pour réduire la fréquence des IE est une bonne hygiène buccale, car les manipulations quotidiennes dans la cavité buccale, comme le brossage des dents, peuvent provoquer une bactériémie. Pour les patients à risque, un contrôle dentaire deux fois par an est indiqué. L’AP est indiquée pour les manipulations dentaires qui impliquent la gencive ou la région périapicale des dents ou qui perforent la muqueuse orale (extractions, interventions chirurgicales, traitements d’abcès, thérapie parodontale, biopsies). Les agents pathogènes les plus fréquents dans la cavité buccale pouvant provoquer une IE sont les streptocoques du groupe des viridans et, par conséquent, la pénicilline ou l’amoxicilline sont les antibiotiques de premier choix. En cas d’allergie à la pénicilline, les directives suisses pour le choix des antibiotiques font la distinction entre la réaction de type tardif (céfuroxime) et la réaction de type immédiat (clindamycine). Dans les directives de l’ESC, cela est simplifié et toute allergie à la pénicilline est simplement traitée par la clindamycine. Pour plus de détails sur le PA recommandé, voir le tableau 3.
Interventions non dentaires
Voies respiratoires : dans les directives suisses de 2008, l’AP était généralement considéré comme indiqué. Compte tenu des directives ESC 2015, nous considérons qu’une AP pour une bronchoscopie, une laryngoscopie ou une intubation n’est plus indiquée. De même, en l’absence d’infection, l’AP n’est pas indiquée pour une amygdalectomie ou une adénotomie. Les patients à haut risque (tab. 2) qui subissent une intervention invasive pour traiter une infection établie (drainage d’abcès) devraient en revanche bénéficier d’une prophylaxie ou d’un traitement analogue à la procédure appliquée aux interventions dentaires (tab. 3).
Tractus gastro-intestinal : la plupart des interventions sur le tractus gastro-intestinal, telles que les endoscopies (gastroscopie ou coloscopie avec ou sans biopsie), ne nécessitent pas d’AP. En revanche, en cas d’infection établie ou lorsqu’il est utile d’administrer un antibiotique pour prévenir une infection de la plaie ou une septicémie chez les patients à haut risque, un antibiotique est indiqué. En outre, les interventions abdominales électives (cholécystectomie, résection sigmoïdienne, appendicectomie) constituent une indication d’AP. Dans ce cas, il est recommandé d’administrer une AP parentérale 30 minutes avant l’intervention. Le traitement de choix est l’amoxicilline/acide clavulanique, car on souhaite couvrir les entérocoques et les anaérobies. En cas d’allergie à la pénicilline, la vancomycine est indiquée, mais il faut ici ajouter des substances actives contre les bactéries à Gram négatif et anaérobies.
Dans le cas d’infections préexistantes, l’AP est la première dose d’un traitement antibiotique prolongé et nécessaire. Un antibiotique actif contre les entérocoques, les bactéries à Gram négatif et les bactéries anaérobies est également recommandé Pour plus de détails sur les recommandations d’AP dans le tractus gastro-intestinal, voir le tableau 4.
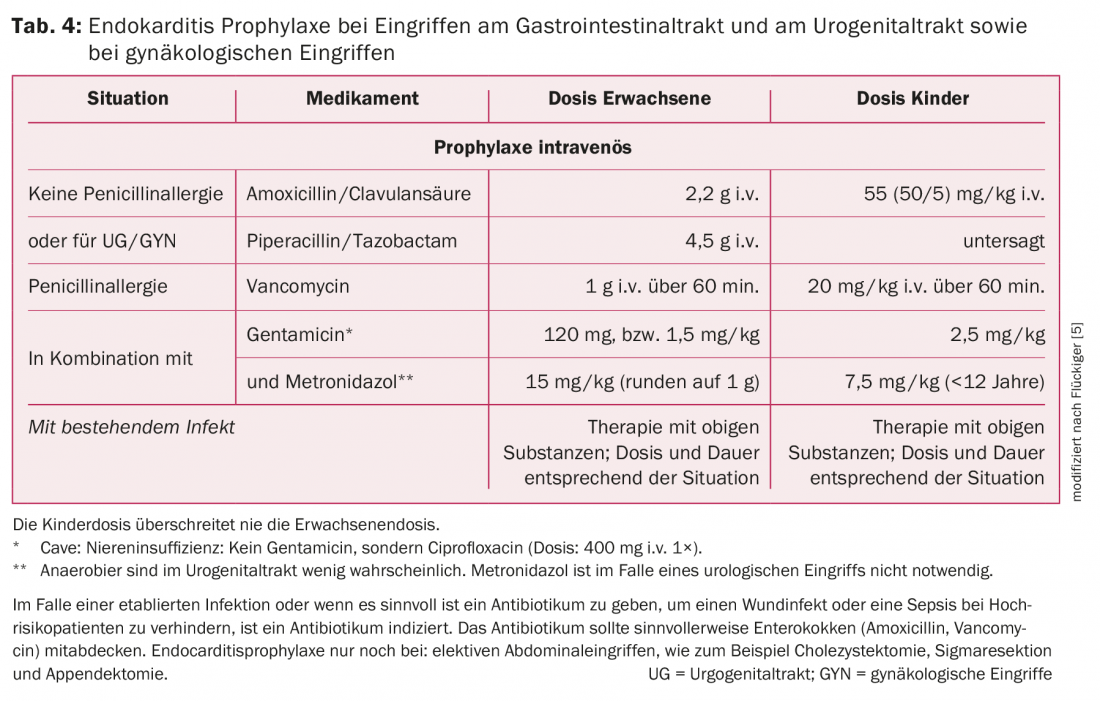
Tractus urogénital : les opérations ou les interventions endoscopiques en cas d’urine stérile ou d’absence d’infection ne nécessitent pas d’AP. En présence d’une infection, il faut choisir un antibiotique ayant une activité contre les entérocoques. Dans certaines circonstances, il peut être utile de compléter le traitement par une préparation contre les germes Gram négatifs (tab. 5).
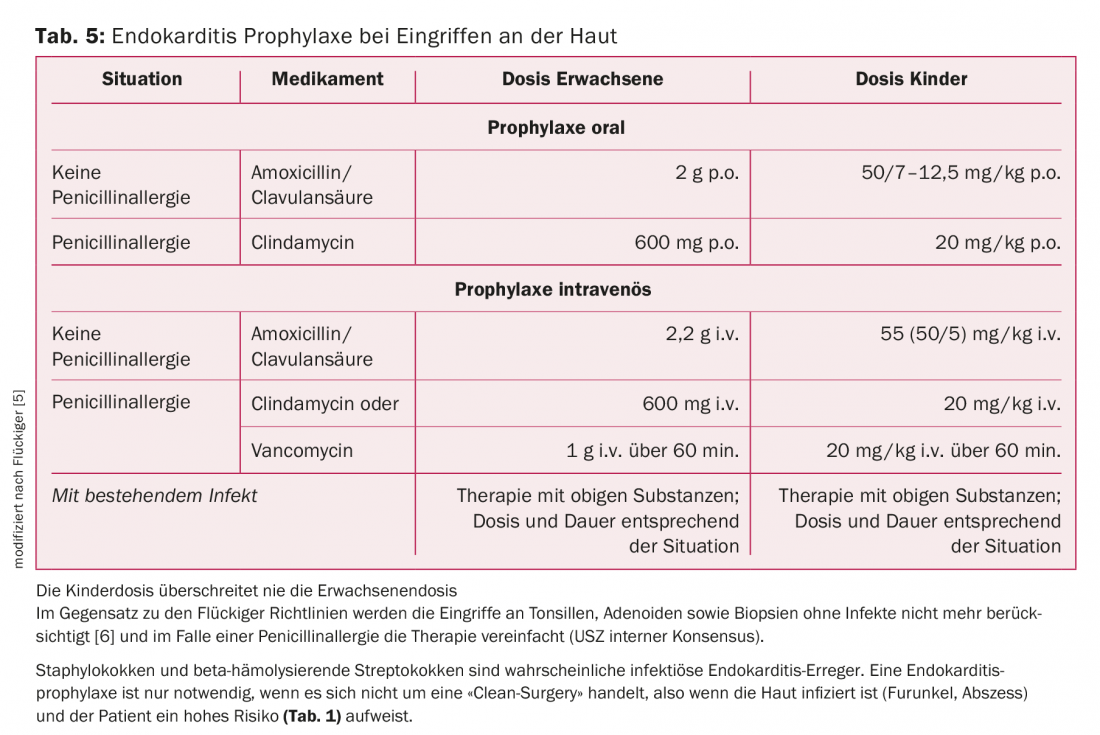
Peau : les agents pathogènes les plus courants dans les infections cutanées sont les staphylocoques et les streptocoques. L’AP n’est indiquée que lorsqu’il ne s’agit pas d’une “clean-surgery”, c’est-à-dire lorsque la peau est infectée (furoncle, abcès) et que le patient présente un risque élevé (tab. 2). L’amoxicilline/acide clavulanique est le traitement de choix (tab. 5).
Discussion
L’endocardite infectieuse reste l’une des maladies infectieuses les plus mortelles et la prévention est donc le meilleur traitement d’une IE. C’est pourquoi nous recommandons en principe l’AP pour éviter l’IE malgré le manque de données et l’absence de consensus. Le sujet reste très controversé et il existe des divergences de traitement au sein des mêmes groupes de travail. Nous proposons la dernière directive de l’ESC comme référence principale pour la prophylaxie de l’endocardite. L’élimination des transplantés cardiaques du groupe des patients à risque reste pour nous peu claire. Pour ces patients, nous recommandons toujours une consultation avec le cardiologue traitant avant toute intervention à risque.
De notre point de vue, la PA des directives suisses en cas d’interventions dentaires peut être simplifiée et adaptée aux directives de l’ESC. Une adaptation en fonction du type d’allergie nous semble plutôt compliquée au quotidien. Nous avons adapté cela en conséquence dans nos directives internes. Dans les directives suisses, l’AP sans infection active n’est recommandée que pour les soins dentaires et certaines interventions sur l’appareil respiratoire. En revanche, les directives de l’ESC ne prennent en compte que les interventions dentaires en tant qu’interventions à risque. Une dentition personnelle assainie semble en tout cas être l’une des mesures prophylactiques les plus importantes.
Des études plus ciblées et prospectives devraient finalement clarifier la question qui se pose depuis longtemps et fournir de meilleures données sur le risque d’événements indésirables liés aux antibiotiques dans l’IE. Les nouvelles lignes directrices de l’AHA sont prévues pour 2018 et, le cas échéant, elles nous donneront un aperçu de nouveaux aspects et sujets à rediscuter.
Messages Take-Home
- En 1955, l’American Heart Association (AHA) a établi pour la première fois des directives sur la prophylaxie de l’endocardite en raison d’une corrélation frappante entre les interventions dentaires, la bactériémie transitoire qui s’ensuit et l’endocardite infectieuse.
- Depuis leur création et en l’absence de données suffisantes, ces directives ont été révisées et simplifiées à plusieurs reprises.
- Les directives actuelles limitent l’antibioprophylaxie (AP) aux patients à haut risque et aux interventions, principalement dans le domaine bucco-dentaire.
- Malheureusement, il n’y a pas de consensus sur ce point – les différentes lignes directrices définissent chacune différemment les patients à haut risque. Conformément aux directives récemment publiées par l’European Society of Cardiology (ESC), nous recommandons de respecter l’AP lors de manipulations de la gencive ou de la région périapicale des dents dans ce groupe à haut risque.
Littérature :
- Cahill TJ, Prendergast BD : Endocardite infectieuse. Lancet 2016 ; 387(10021) : 882-893.
- Achermann Y, et al : Endocardite de la valve prothétique et infection de la circulation sanguine due à Mycobacterium chimaera. J Clin Microbiol 2013 ; 51(6) : 1769-1773.
- Wilson W, et al : Prevention of infective endocarditis : guidelines from the American Heart Association : a guideline from the American Heart Association Rheumatic Fever, Endocarditis, and Kawasaki Disease Committee, Council on Cardiovascular Disease in the Young, and the Council on Clinical Cardiology, Council on Cardiovascular Surgery and Anesthesia, and the Quality of Care and Outcomes Research Interdisciplinary Working Group. Circulation 2007 ; 116(15) : 1736-1754.
- Hoen B, Duval X : Endocardite infectieuse. N Engl J Med 2013 ; 369(8) : 785.
- Fluckiger U, Troillet N : [New Swiss guidelines for the prevention of infective endocarditis]. Rev Med Suisse 2008 ; 4(174) : 2134-2138.
- Habib G, et al. : 2015 ESC Guidelines for the management of infective endocarditis : The Task Force for the Management of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by : European Association for Cardio-Thoracic Surgery (EACTS), the European Association of Nuclear Medicine (EANM). Eur Heart J 2015 ; 36(44) : 3075-3128.
- Habib G, et al. : Guidelines on the prevention, diagnosis, and treatment of infective endocarditis (new version 2009) : the Task Force on the Prevention, Diagnosis, and Treatment of Infective Endocarditis of the European Society of Cardiology (ESC). Endorsed by the European Society of Clinical Microbiology and Infectious Diseases (ESCMID) and the International Society of Chemotherapy (ISC) for Infection and Cancer. Eur Heart J 2009 ; 30(19) : 2369-2413.
- Contrepois A : Notes sur la première histoire de l’endocardite infectieuse et le développement d’un modèle expérimental. Clin Infect Dis 1995 ; 20(2) : 461-466.
- Moreillon P : Endocarditis prophylaxis revisited : experimental evidence of efficacy and new Swiss recommendations. Groupe de travail suisse pour la prophylaxie de l’endocardite. Schweiz Med Wochenschr 2000 ; 130(27-28) : 1013-1026.
- Naber CK, et al : New guidelines for infective endocarditis : a call for collaborative research. Int J Antimicrob Agents 2007 ; 29(6) : 615-616.
CARDIOVASC 2017 ; 16(6) : 3-8