Le traitement par les anticorps anti-PD-1, anti-PDL-1 et anti-CTLA-4 permet également d’obtenir des rémissions à long terme chez les patients atteints de tumeurs jusqu’ici incurables. Certains facteurs prédictifs permettent d’évaluer si un patient atteint d’un cancer répond à un traitement par inhibiteur de point de contrôle. Étant donné que le système immunitaire est fortement activé dans le cadre d’une immunothérapie, des effets secondaires auto-immuns peuvent survenir. Afin de prendre en charge au mieux les patients atteints de cancer, une collaboration interdisciplinaire entre les oncologues et les médecins généralistes est nécessaire.
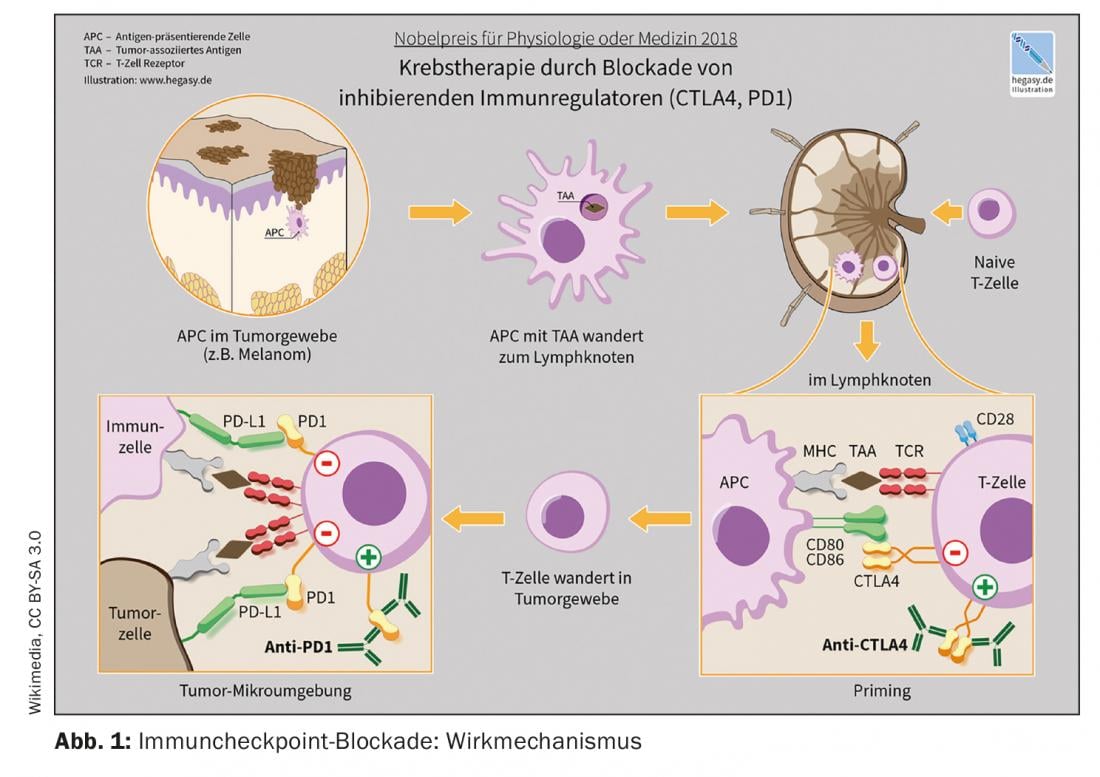
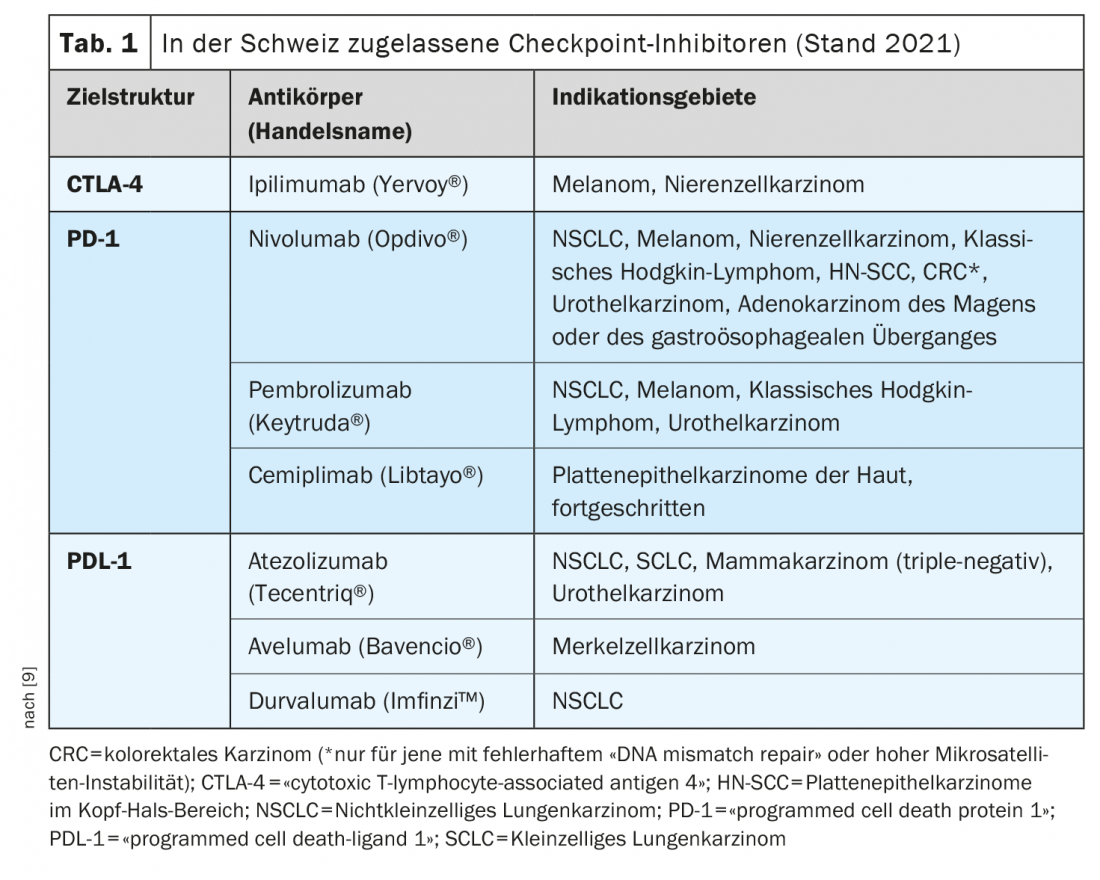
L’autorisation de mise sur le marché des inhibiteurs de points de contrôle est l’un des développements les plus révolutionnaires de l’immuno-oncologie au cours des dernières années. Les inhibiteurs de points de contrôle activent les lymphocytes T dans leur lutte contre les cellules tumorales. Plusieurs anticorps monoclonaux ciblant les points de contrôle immunitaires PD-1 (Programmed death-1), PDL-1 (PD-Ligand 1) et CTLA-4 (Cytotoxic T-Lymphocyte Antigen-4) sont désormais disponibles [1]. Ces options de traitement sont considérées comme la nouvelle norme pour un nombre croissant d’entités tumorales, soit seules, soit en combinaison avec la chimiothérapie, explique le Dr Raphaël Delaloye, Tumor Center, Hôpital universitaire de Bâle [2]. L’inhibition des points de contrôle est l’une des stratégies les plus utilisées dans le domaine de l’immunothérapie. Leur efficacité repose sur l’activation des défenses anti-tumorales en interrompant les interactions inhibitrices entre les cellules présentatrices d’antigènes et les lymphocytes T au niveau des “points de contrôle”. “Les inhibiteurs de points de contrôle immunitaires peuvent rétablir un équilibre entre la cellule tumorale et la réponse immunitaire”, explique le conférencier [2]. Le premier anticorps anti-CTLA-4, l’ipilumumab (Yervoy®), a été approuvé en 2011, suivi en 2015 par les anticorps anti-PD-1, le nivolumab (Opdivo®) et le pembrolizumab (Keytruda®). La combinaison ipilimumab/nivolumab a reçu une autorisation de Swissmedic en 2016 pour le traitement du mélanome [2,3]. Un exemple d’utilisation combinée de l’inhibition du point de contrôle immunitaire et de la chimiothérapie est l’association pembrolizumab (anti-PD-1-Ak) plus carboplatine et paclitaxel ou nab-paclitaxel, autorisée en Suisse pour le traitement de première ligne des adultes atteints de cancer du poumon non à petites cellules (NSCLC) métastasé.
Est-il possible de prédire la réponse au traitement ?
Deux facteurs principaux expliquent pourquoi tous les patients ne présentent pas la même réponse à un traitement par inhibiteurs de points de contrôle immunitaires. D’une part, la pertinence des mécanismes bloqués pour la tolérance tumorale est déterminante. Il a été démontré que la détermination de l’expression de PDL-1 dans les échantillons tumoraux est un biomarqueur prédictif de la réponse aux inhibiteurs de PD-1/PDL-1 [4]. L’intervenant illustre son propos par l’exemple suivant : l’étude CheckMate 057 a montré une association entre l’expression de PDL-1 et la réponse clinique au nivolumab dans le NSCLC en traitement de seconde ligne [2,5]. Les patients qui avaient une forte expression de PDL-1 étaient plus susceptibles de répondre au traitement anti-PDL-1, mais même ceux qui avaient moins de 1% de PDL-1 ont montré une meilleure réponse par rapport à la chimiothérapie (docétaxel) [2,5]. Le deuxième facteur important pour la réponse au traitement est le “microenvironnement” de la tumeur. Le microenvironnement environnant des cellules tumorales joue un rôle important [2]. En fonction de la présence de cellules immunitaires actives dans la tumeur, celle-ci est qualifiée d’enflammée (“chaude”) ou de non enflammée (“froide”) [6]. Les signatures génétiques inflammatoires sont associées à une meilleure réponse aux immunothérapies.

Gestion des effets indésirables : Que faut-il prendre en compte ?
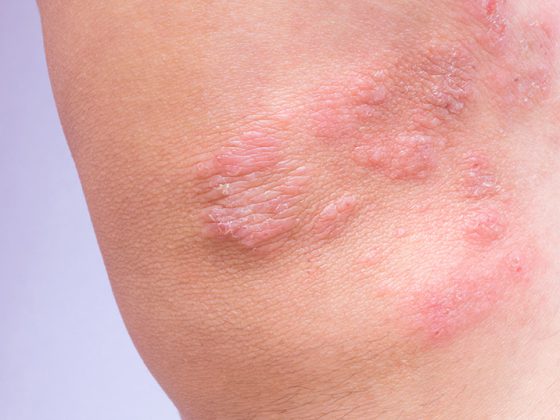
Les inhibiteurs de points de contrôle immunitaires peuvent être utilisés seuls, en combinaison avec une autre immunothérapie (par exemple dans le cas du mélanome) ou en combinaison avec la chimiothérapie (par exemple dans le cas du NSCLC). L’intervalle entre les doses d’inhibition des points de contrôle administrées par perfusion intraveineuse est généralement de deux ou trois semaines. “En règle générale, cette perfusion ne nécessite pas de prémédication, contrairement à la chimiothérapie”, précise le Dr Delaloye [2]. Il n’y a généralement pas de toxicité aiguë, comme des nausées ou des réactions allergiques, et les effets secondaires de l’immunothérapie ne surviennent généralement qu’après un certain délai. La forte activation du système immunitaire due au traitement s’accompagne du risque que les cellules immunitaires détruisent également les tissus sains de l’organisme, tout organe pouvant en principe être attaqué. Dans certains cas, ces effets secondaires peuvent mettre la vie en danger. Le dépistage précoce est essentiel, et les médecins généralistes jouent un rôle très important, souligne le Dr Delaloye [2]. Les effets secondaires surviennent le plus souvent 6 à 8 semaines après le début de l’immunothérapie. Par conséquent, chez les patients sous immunothérapie, il faut toujours penser à un effet secondaire immuno-médié en cas d’apparition de nouveaux symptômes. Les plus fréquents sont l’exanthème, la diarrhée, la colite ou la gastrite. Plus rarement, des troubles de la thyroïde, une insuffisance rénale, une hépatite ou une pneumonie peuvent survenir. Le conférencier recommande de prendre contact avec les spécialistes oncologiques traitants en cas de suspicion et montre, à l’aide d’exemples de cas, à quoi peut ressembler une gestion réussie des effets secondaires à médiation immunitaire (encadré) [2].

Immunothérapie du cancer quo vadis – le suspense reste entier
Avec les inhibiteurs de points de contrôle, les thérapies à base de cellules T font partie des innovations les plus prometteuses dans le domaine de l’immuno-oncologie. Les patients atteints de tumeurs avancées peuvent notamment en bénéficier. La thérapie génique TCR (T cell receptor) consiste à greffer un récepteur de cellules T spécifique à une mutation dans des cellules T fraîches prélevées dans le sang du patient. Les lymphocytes T ainsi génétiquement modifiés ne sont pas limités fonctionnellement et peuvent alors, de retour dans le corps de la personne malade, combattre le cancer [8]. La thérapie cellulaire CAR (récepteur antigénique chimérique) T est basée sur des cellules T génétiquement modifiées avec des récepteurs synthétiques spécifiques de l’antigène. Tisagenlecleucel est une molécule appartenant au groupe des cellules CAR-T, qui a été approuvée en 2018 [7].
La recherche de vaccins contre le cancer est également un sujet important en immuno-oncologie [7]. Ils sont basés sur un principe similaire à celui des inhibiteurs de points de contrôle, mais devraient présenter un risque moindre d’effets secondaires toxiques. Pour les patients dont les tumeurs ne présentent pas de néoantigènes, les scientifiques peuvent s’appuyer sur une large sélection d’épitopes antigéniques de la lignée germinale largement spécifiques de la tumeur pour le développement de vaccins [7]. La recherche se concentre également sur le développement de nouvelles plateformes technologiques qui établissent des profils de biomarqueurs très complexes sur la base d’analyses microscopiques, génétiques, moléculaires et expérimentales, afin de mieux prédire le succès des interventions thérapeutiques [7].
Congrès : Forum pour la formation médicale continue
Littérature :
- Kähler KC, et al. : pour le comité “Effets secondaires cutanés” de l’Association d’oncologie dermatologique : JDDG 2020 ; 18(6) : 582-609.
- Delaloye R : Immunothérapie et thérapies ciblées en oncologie. Dr. med. Raphaël Delaloye, Forum pour la formation médicale continue 27.01.2022
- Information sur les médicaments, www.swissmedicinfo.ch (dernière consultation 30.03.2022)
- Prelaj A, et al : Eur J Cancer 2019 ; 106 : 144-159.
- Horn L, et al : J Clin Oncol 2017 ; 35 : JCO2017743062-33
- Hegde PS, Karanikas V, Evers S : Clin Cancer Res 2016 ; 22(8) : 1865-1874.
- Deutsches Konsortium fürTranslationale Krebsforschung, https://dktk.dkfz.de (dernière consultation 30.03.2022)
- Centre Max Delbrück de médecine moléculaire, www.mdc-berlin.de/de/news (dernière consultation 30.03.2022)
- Riggenbach E, et al : Swiss Med Forum 2021 ; 21(0506) : 78-82.
PRATIQUE DU MÉDECIN DE FAMILLE 2022 ; 17(4) : 38-39