Les progrès dans notre compréhension sur la physiopathologie du carcinome rénal ont contribué au dévelopement de nouveaux medicaments. Ceux-ci interviennent directement sur les voies de signalisation moléculaire impliquant le VEGF, PDGF et mTOR. De plus, ces dernières années, des nouveaux traitements ont vus le jour, agissant sur le systeme immunitaire et permettant la reconnaissance puis l’élimination des cellules tumorales. Ou en sommes nous aujourd’hui avec le traitement du mRCC? Quelles sont les recommandations actuelles?
Le carcinome rénal reste relativement rare en Suisse avec une incidence de 950 cas et responsable de 1,8% des décès par an dus à un cancer. Les hommes sont nettement plus souvent touchés que les femmes (67,9% vs 32,1%) et environ un tiers des patients présentent déjà des métastases loco-régionales ou à distance au moment du diagnostic [1]. Chez près de 25% des patients présentant une maladie localisée, des métastases surviennent à distance après une néphrectomie à visée curative [2].
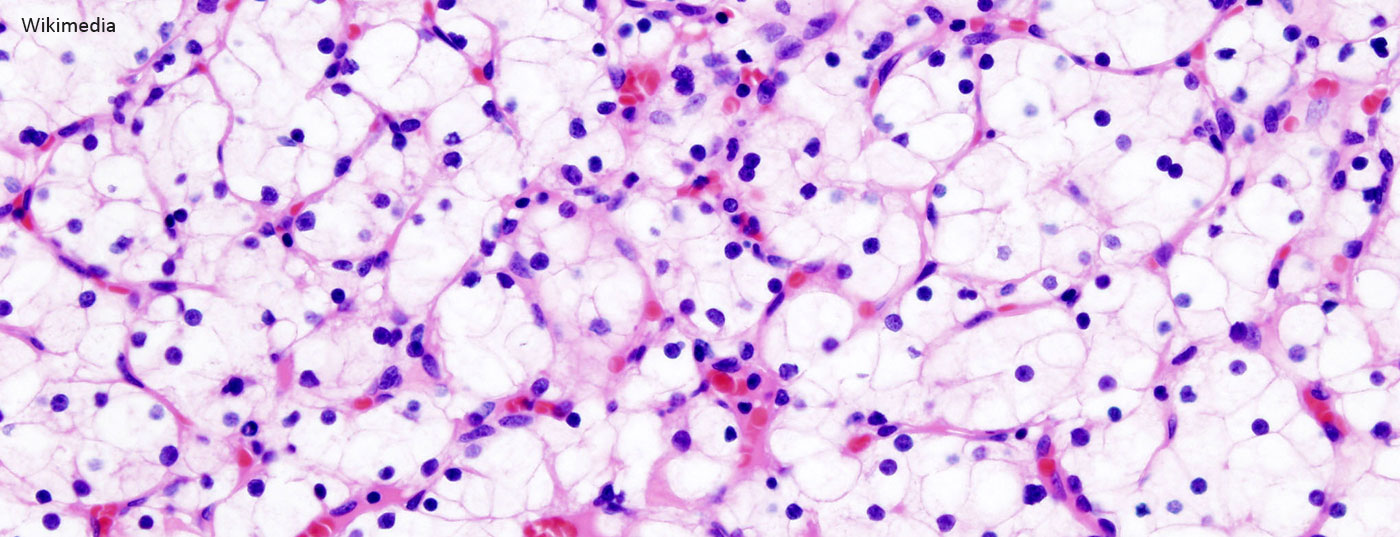
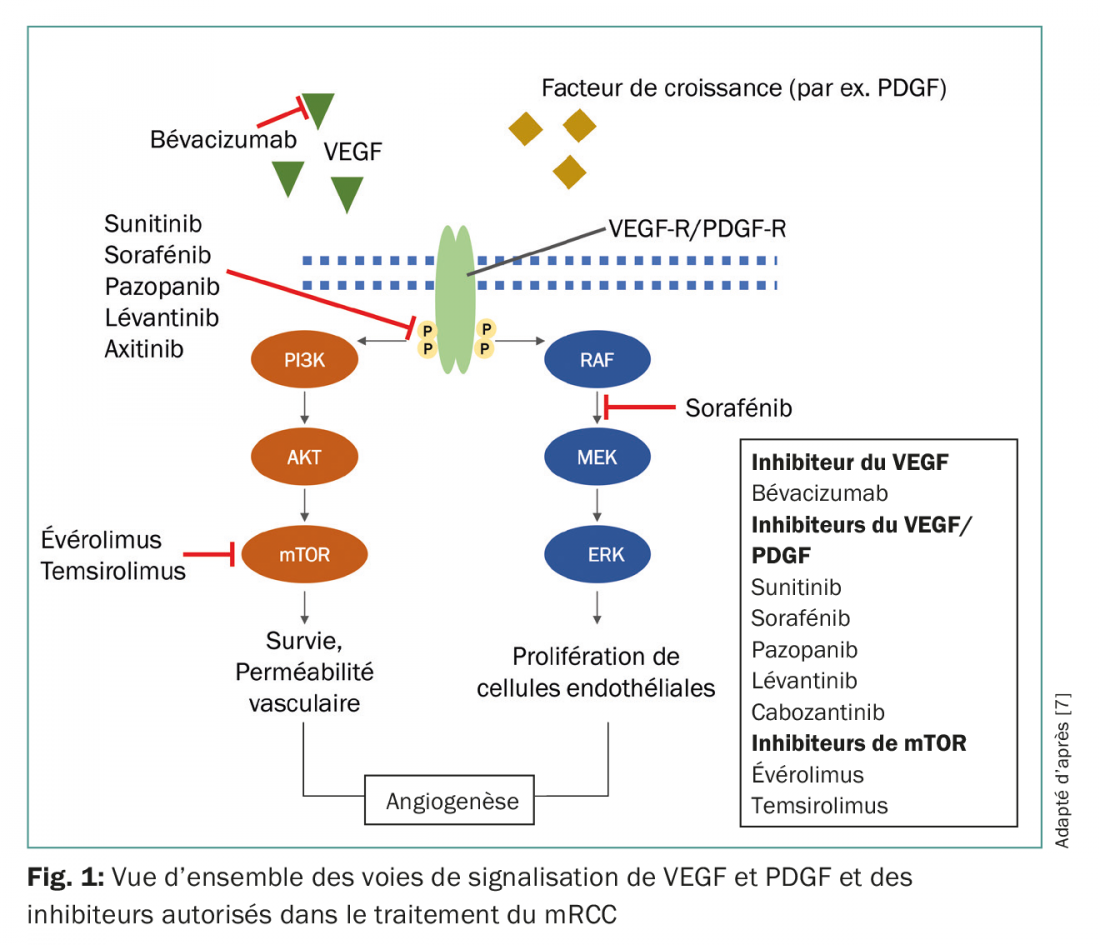
Parmi les nombreux sous-types de carcinomes rénaux, le carcinome à cellules claires est le plus fréquent, représentant 70 à 75% des cas; il est associé à une inactivation du gène de von Hippel-Lindau (VHL), ce qui induit une activité accrue du facteur induit par l’hypoxie (HIF) et en dernier lieu, une surexpression du facteur de croissance de l’endothélium vasculaire (VEGF) et du facteur de croissance dérivé des plaquettes (PDGF) [3,4]. L’activité du HIF peut en outre être renforcée par la voie de signalisation de la cible de la rapamycine chez les mammifères (mTOR) [5]. La compréhension de ces liens a contribué de manière décisive au développement de nouveaux médicaments, qui interviennent spécifiquement au niveau des voies de signalisation de VEGF, PDGF et mTOR (Fig 1).
Ces dernières années ont vu par ailleurs le développement de traitements axés sur la lutte du système immunitaire contre la tumeur. L’expression de CTLA-4 et PD-1 par les cellules T activées entraîne, lors des différentes phases de la réponse immunitaire, une baisse de l’activité des cellules T. L’ipilimumab, un anticorps monoclonal (AcM) anti-CTLA-4 et le nivolumab, un AcM, dirigé contre PD-1 contribuent, en inhibant ces récepteurs inhibiteurs de point de contrôle, à induire l’efficacité de la réponse des cellules T contre la tumeur [6].
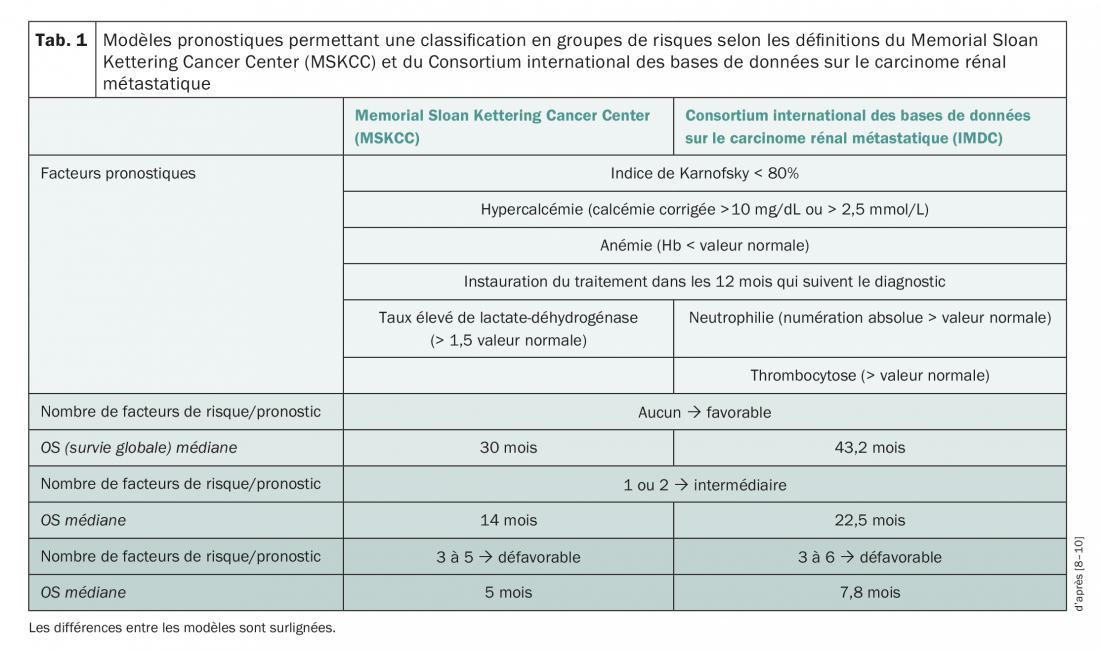
Classification en groupes de risques et directives
Les modèles pronostiques et la classification des patients en différents groupes de risques constituent une base importante pour les prises de décisions thérapeutiques. Les critères du Memorial Sloan Kettering Cancer Center (MSKCC) datent de l’époque où les traitements ciblés n’étaient pas encore bien établis [8]. Le Consortium international des bases de données sur le carcinome rénal métastatique (IMDC) a défini des facteurs servant de base à l’évaluation des risques [9,10]. Les deux systèmes ne se différencient que sur quelques points et répartissent les patients en groupes de risques correspondant à un pronostic favorable, intermédiaire ou défavorable (Tab. 1). La prise en charge du mRCC est en évolution constante depuis la première autorisation de mise sur le marché d’un traitement ciblé (sunitinib, 2006). De nouvelles directives de l’Association européenne d’urologie (AEU) publiées début 2018 recommandent déjà, sur la base de l’étude CheckMate-214, de traiter les patients dont les risques correspondent à un pronostic intermédiaire/défavorable avec l’association nivolumab/ipilimumab [11]. Dans le cadre de cette étude, l’association de nivolumab et d’ipilimumab, comparée au sunitinib, a permis d’atteindre, après un suivi médian de 25,2 mois, un taux de survie à 1,5 an de 75% par rapport à 60% au traitement par sunitinib (HR 0,63, p<0,001). La survie médiane sans progression (PFS) était de 11,6 mois dans le groupe nivolumab/ipilimumab et de 8,4 mois dans le groupe sunitinib, cette différence entre les bras de traitement n’étant cependant pas statistiquement significative (HR 0,82, p=0,03) [12]. Le taux de réponse objective était de 42% versus 27% (p<0,001) et le taux de rémissions complètes sous immunothérapie combinée était également supérieur de 9% par rapport à celui observé sous sunitinib (1%). L’association d’ipilimumab et de nivolumab est autorisée depuis peu en Suisse dans le traitement du mRCC. Le Groupe suisse de recherche clinique sur le cancer (SAKK) réalise actuellement une étude de phase II avec l’ipilimumab et le nivolumab en première ou deuxième ligne de traitement (SAKK 07/17). Cet article traite par la suite principalement de la prise en charge thérapeutique avec les inhibiteurs de la tyrosine kinase (ITK) anti-angiogéniques ciblés et les inhibiteurs de mTOR.
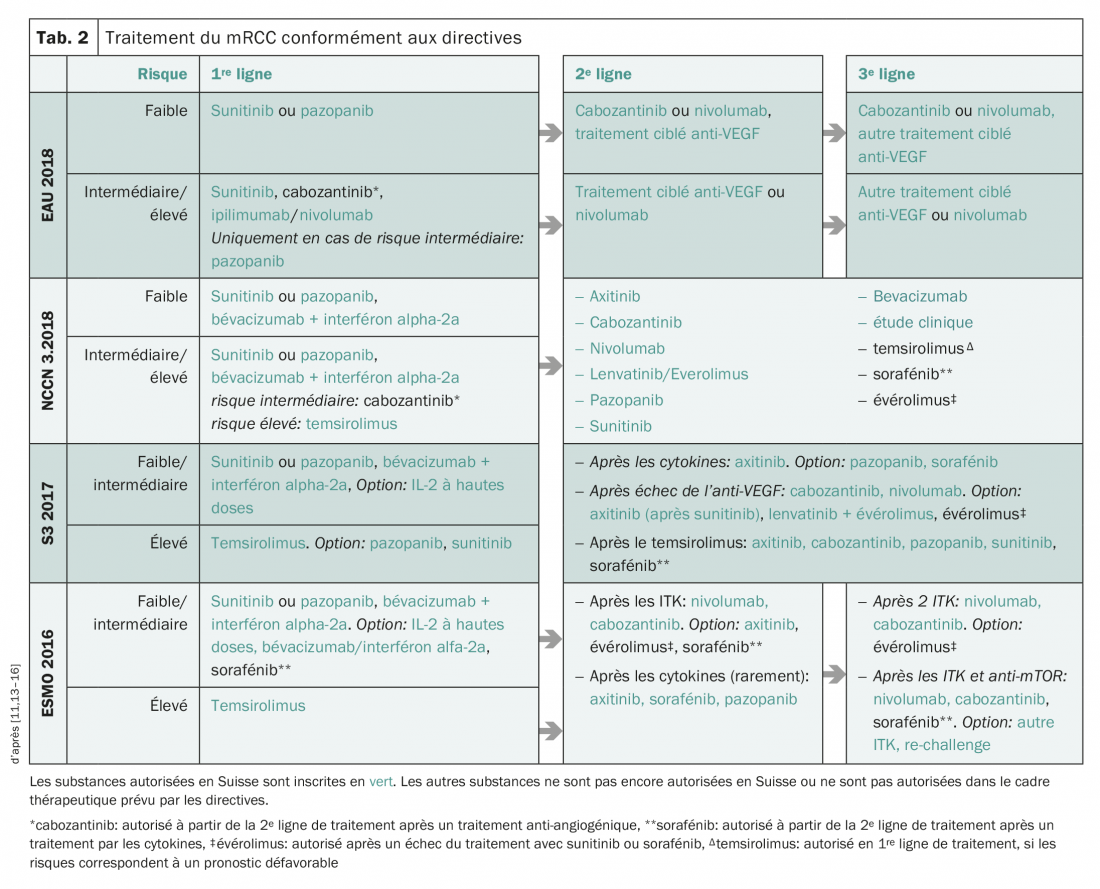
Le Tableau 2 donne une vue d’ensemble des directives actuelles se concentrant sur les substances autorisées en Suisse.
La néphrectomie, comme «traitement standard» dans la prise en charge du mRCC
La néphrectomie est, depuis pratiquement vingt ans, un élément fixe du traitement du mRCC, étant donné qu’il a pu être démontré que l’intervention chirurgicale avant un traitement par interféron-alpha (IFN-α) apporte un avantage en termes de survie, par comparaison au traitement seul par IFN-α [17,18]. Le rôle de la néphrectomie en lien avec des traitements anti-angiogéniques ciblés était cependant obscur jusqu’à présent, bien que des études rétrospectives tendaient à confirmer l’utilité d’une telle intervention [19]. Lors de l’ESMO 2017, des données sur la séquence néphrectomie → sunitinib versus sunitinib → néphrectomie (étude SURTIME) ont été présentées. Bien que l’étude ait été arrêtée prématurément en raison de la lenteur du recrutement des patients, elle peut être utilisée comme source de données prospectives. Aucune différence n’a pu être mise en évidence entre les groupes de traitement en ce qui concerne la PFS médiane après 7 mois (42,0% vs 42,9%, p>0,99); une tendance à une meilleure survie globale (OS) s’est toutefois dégagée dans le groupe ayant subi une intervention chirurgicale secondaire (HR 0,57, IC à 95% 0,34–0,95, p=0,032) [20]. Avec la publication récente de l’étude de phase III CARMENA, on dispose désormais de données prospectives qui démontrent la non-infériorité d’une monothérapie par sunitinib par comparaison à la néphrectomie associée au sunitinib chez les patients ayant un risque correspondant à un pronostic intermédiaire ou défavorable [21]. Dans le cadre de cette étude, 450 patients ont reçu par randomisation soit un traitement par néphrectomie/sunitinib, soit un traitement par sunitinib seul. Chez les patients qui ne recevaient que le sunitinib en monothérapie, une OS médiane plus longue que dans le groupe ayant subi une néphrectomie (18,4 vs 13,9 mois, HR 0,89) a été mise en évidence et les critères de non-infériorité du sunitinib ont été en conséquence satisfaits [21]. Les auteurs en concluent que, bien que la néphrectomie puisse être utile pour le contrôle des symptômes (macrohématurie, douleurs néphrétiques), le traitement avec un inhibiteur du VEGF sans néphrectomie n’entraîne donc aucun inconvénient en termes d’OS [21]. En présence d’un faible risque, la décision sera très certainement aussi à l’avenir en faveur d’une néphrectomie chez la majorité des patients.
Choix du traitement de première ligne
Le plus souvent, on utilise jusqu’à présent le sunitinib et le pazopanib en traitement de première ligne chez les patients ayant un risque correspondant à un pronostic favorable ou intermédiaire [22]. Les données de l’étude CheckMate-214 et l’autorisation de l’association nivolumab/ipilimumab entraîneront un changement de l’algorithme de traitement. Nous attendons aussi avec intérêt les données de l’étude IMmotion151 (atézolizumab et bévacizumab vs. sunitinib) sur la survie globale. Le choix du traitement de première ligne se fonde toutefois aussi sur les caractéristiques individuelles de chaque patient et sur les éventuelles comorbidités [22].
Sous traitement par sunitinib, la PFS médiane était plus que doublée, par comparaison à l’IFN-α (11 vs 5 mois, HR 0,539, p<0,001) et une OS médiane supérieure à deux ans a été atteinte (26,4 vs 21,8 mois, HR 0,821, p=0,051) [23]. Dans le cadre de l’étude à accès élargi réalisée en situation réelle, on a observé également sous traitement par sunitinib une PFS médiane de 9,4 mois et une OS médiane de 18,7 mois [24]. Après plus de dix ans d’expérience, le sunitinib en tant que traitement standard a pris la relève de l’IFN-α qui était le traitement standard de référence de première ligne [25].
Dans l’étude de non-infériorité, randomisée, de phase III COMPARZ, avec une PFS médiane de 8,4 mois, le pazopanib n’était pas inférieur au sunitinib (9,5 mois) (HR 1,05). L’OS médiane était également comparable entre les deux traitements (pazopanib: 28,3 mois, sunitinib 29,1 mois, HR 0,92) et le taux de réponse objective était de 31% sous pazopanib vs 25% sous sunitinib [26]. Dans le cadre d’une étude randomisée concernant la préférence des patients (étude PICES), l’évaluation était statistiquement significativement meilleure pour le pazopanib par rapport au sunitinib [27]. Avec l’association du bévacizumab et d’un IFN-α, qui est une autre option dans le traitement de première ligne, une amélioration de la PFS médiane de 3,3 mois a été observée par rapport à l’IFN-α (8,5 vs 5,2 mois, HR 0,71) [28]. Chez les patients présentant des risques correspondant à un pronostic défavorable, un allongement net de l’OS médiane a également été mis en évidence sous traitement par temsirolimus par rapport à l’IFN-α (10,9 vs 7,3 mois, HR 0,73) [29].
Choix du traitement de deuxième ligne et traitements ultérieurs
Outre la durée de la réponse au traitement de première ligne, les symptômes du patient et les comorbidités existantes, les toxicités individuelles observées auparavant entrent aussi en ligne de compte dans le choix du traitement de deuxième ligne [22,30]. Les patients qui, sous le traitement précédent, ont présenté des effets indésirables importants ou une baisse importante de leur qualité de vie tirent donc éventuellement profit d’un changement de classe de substances [22]. Par exemple, un diabète de type 2 mal équilibré peut s’aggraver en raison de l’utilisation d’un inhibiteur de mTOR, des maladies cardiovasculaires peuvent constituer un facteur de risque dans le cadre des traitements anti-VEGF et les maladies auto-immunes existantes doivent être prises en compte dans le cadre de traitements basés sur un inhibiteur du point de contrôle [31–33].
Dans l’étude de phase III AXIS, une PFS médiane (HR 0,66, p<0,0001) et une OS médiane significativement plus longues ont été obtenues avec l’axitinib par rapport au sorafénib en deuxième ligne de traitement (20,1 mois vs 19,2 mois, HR 0,97, p=0,37) [34]. En outre, par comparaison à l’évérolimus, aussi bien le cabozantinib dans l’étude de phase III METEOR (21,4 vs 17,1 mois, HR 0,70, p=0,0002) que le nivolumab dans l’étude de phase III CheckMate-025 (25,0 vs 19,6 mois, HR 0,73, IC à 98,5% 0,57–0,93, p=0,002) ont conduit à une amélioration significative de l’OS médiane [35,36]. Aucun bénéfice en termes de PFS n’a cependant pu être démontré avec le nivolumab (4,6 vs 4,4 mois, HR 0,88, p=0,11) [36]. L’association du lenvatinib et de l’évérolimus a entraîné, comparativement à l’évérolimus, un allongement significatif de la PFS médiane (14,6 vs 5,5 mois, HR 0,40, p=0,0005) mais était toutefois associée à des toxicités importantes [37,38].
Gestion du traitement et des effets indésirables
La réussite du traitement en cas de mRCC dépend d’une part du choix du traitement et d’autre part de la gestion des effets indésirables. Dans le cadre de l’étude COMPARZ, différents profils d’effets indésirables qui pourraient avoir une influence sur le choix individuel de la substance ont été observés sous traitement par sunitinib et pazopanib [26]. L’administration de sunitinib a occasionné fatigue, syndrome main-pied et mucite orale, celle de pazopanib a entraîné davantage d’élévations des enzymes hépatiques et de pertes de poids. Le médicament de l’étude a été arrêté plus souvent dans le groupe pazopanib que dans le groupe sunitinib en raison d’effets indésirables [26].
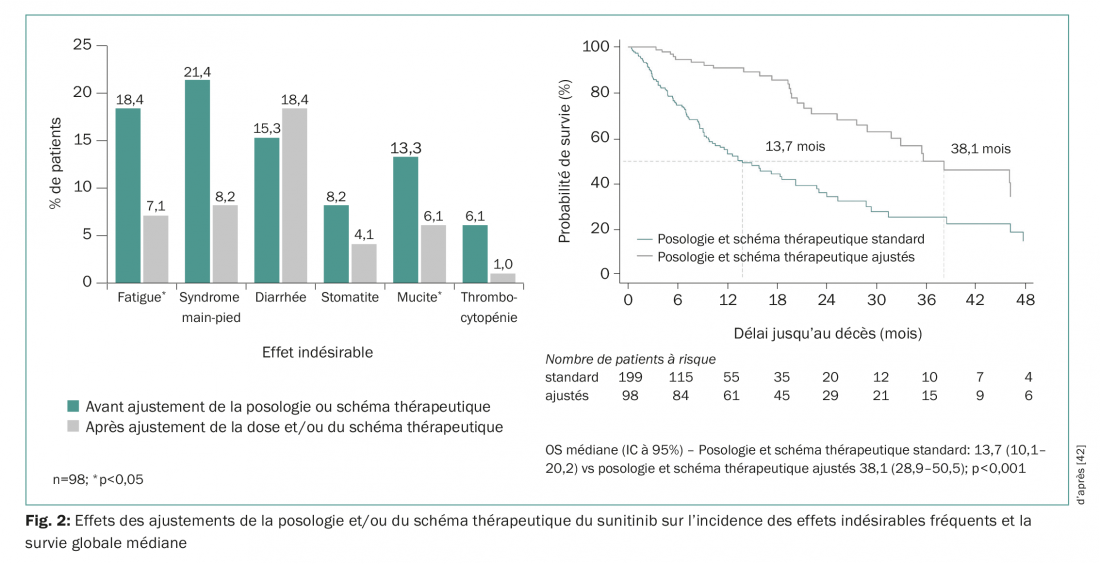
Les analyses pharmacologiques rétrospectives indiquent qu’une exposition plus élevée au sunitinib est liée à de meilleurs résultats cliniques, cependant aussi à un taux supérieur d’effets indésirables [39]. Différentes études ont permis depuis lors de démontrer qu’un ajustement du schéma thérapeutique du sunitinib de «4 semaines de traitement/2 semaines de pause (4/2)» à «2 semaines de traitement/1 semaine de pause (2/1)» peut contribuer à une baisse des effets indésirables les plus fréquents, sans toutefois altérer l’efficacité du traitement [40,41]. Ce résultat est également confirmé par les données du registre prospectif STAR-TOR réalisé en conditions réelles en Allemagne. Les ajustements de la posologie et/ou du schéma thérapeutique au cours du traitement par sunitinib ont permis d’obtenir une diminution des effets indésirables fréquents (hormis la diarrhée) et une amélioration de l’OS médiane (Fig. 2) [42]. Les ajustements de la posologie sont également souvent nécessaires et courants avec le traitement par le pazopanib [43].
Perspectives
Compte tenu du grand choix actuel d’options thérapeutiques dans le traitement du mRCC et des autres substances à venir, la question du choix du traitement et de la séquence thérapeutique optimaux reste un thème central. Par exemple, dans le cadre de la cohorte EuroTARGET, différents marqueurs ont été évalués à l’aide des données des patients traités par sunitinib, pazopanib ou sorafénib afin de personnaliser le traitement du mRCC [44]. À l’avenir aussi, la gestion proactive et individuelle du traitement et des effets indésirables aura de plus une influence déterminante sur les résultats cliniques.
Bibliographie:
- Ligue contre le cancer Suisse: Le cancer en Suisse: les chiffres. Stand Okt. 2017 www.liguecancer.ch/a-propos-du-cancer/les-chiffres-du-cancer/-dl-/fileadmin/downloads/sheets/chiffres-le-cancer-en-suisse.pdf
- Choueiri TK, Motzer RJ: Systemic Therapy for Metastatic Renal-Cell Carcinoma. New England Journal of Medicine 2017; 376(4): 354–366.
- Clark PE: The role of VHL in clear-cell renal cell carcinoma and its relation to targeted therapy. Kidney international 2009; 76(9): 939-945.
- Nickerson ML, et al.: Improved Identification of von Hippel-Lindau Gene Alterations in Clear Cell Renal Tumors. Clinical Cancer Research 2008; 14(15): 4726-4734.
- Thomas GV, et al.: Hypoxia-inducible factor determines sensitivity to inhibitors of mTOR in kidney cancer. Nature medicine 2006; 12(1): 122-127.
- Sathianathen NJ, et al.: The current status of immunobased therapies for metastatic renal-cell carcinoma. ImmunoTargets and Therapy 2017; 6: 83-93.
- Rini BI, Small EJ: Biology and Clinical Development of Vascular Endothelial Growth Factor–Targeted Therapy in Renal Cell Carcinoma. Journal of Clinical Oncology 2005; 23(5): 1028–1043.
- Motzer RJ, Bacik J, Murphy BA, Russo P Mazumdar M: Interferon-Alfa as a Comparative Treatment for Clinical Trials of New Therapies Against Advanced Renal Cell Carcinoma. Journal of Clinical Oncology 2002; 20(1): 289–296.
- Heng DYC, et al.: External validation and comparison with other models of the International Metastatic Renal–Cell Carcinoma Database Consortium prognostic model: a population–based study. Lancet. Oncology 2013; 14(2): 141–148.
- Heng DYC, et al.: Prognostic Factors for Overall Survival in Patients With Metastatic Renal Cell Carcinoma Treated With Vascular Endothelial Growth Factor–Targeted Agents: Results From a Large, Multicenter Study. Journal of Clinical Oncology 2009; 27(34): 5794–5799.
- Powles T, et al.: Updated European Association of Urology Guidelines Recommendations for the Treatment of First-line Metastatic Clear Cell Renal Cancer. European urology 2017.
- Motzer RJ, et al.: Nivolumab plus Ipilimumab versus Sunitinib in Advanced Renal-Cell Carcinoma. New England Journal of Medicine 2018; 378(14): 1277–1290.
- S3-Leitlinie Diagnostik, Therapie und Nachsorge des Nierenzellkarzinoms. Langversion 1.2 – April 2017, AWMF-Registernummer: 043/017-OL.
- Escudier B, et al.: Renal cell carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up†. Annals of Oncology 2016; 27(5): v58–v68.
- NCCN: National Comprehensive Cancer Network Clinical Practice Guidelines in Oncology – Kidney Cancer Version 3.2018. NCCN.org Feb. 6 2018.
- www.swissmedicinfo.ch.
- Flanigan RC, et al.: Nephrectomy Followed by Interferon Alfa-2b Compared with Interferon Alfa-2b Alone for Metastatic Renal-Cell Cancer. New England Journal of Medicine 2001; 345(23): 1655–1659.
- Mickisch GH, Garin A, et al.: Radical nephrectomy plus interferon-alfa-based immunotherapy compared with interferon alfa alone in metastatic renal-cell carcinoma: a randomised trial. Lancet 2001; 358(9286): 966–970.
- Culp SH: Cytoreductive nephrectomy and its role in the present–day period of targeted therapy. Ther Adv Urol 2015; 7(5): 275–285.
- Bex A, et al.: Immediate versus deferred cytoreductive nephrectomy in patients with synchronous metastatic renal cell carcinoma (mRCC) receiving sunitinib (EORTC 30073 SURTIME. Annals of Oncology 2017; 28(5): v605–v649; doi: 10.1093/annonc/mdx440.
- Mejean A, et al.: Sunitinib Alone or after Nephrectomy in Metastatic Renal-Cell Carcinoma. The New England journal of medicine 2018. doi: 10.1056/NEJMoa1803675
- Osorio JC, et al.: Optimizing Treatment Approaches in Advanced Renal Cancer. Oncology 2017; 31(12): 919–926, 928–930.
- Motzer RJ, et al.: Overall Survival and Updated Results for Sunitinib Compared With Interferon Alfa in Patients With Metastatic Renal Cell Carcinoma. Journal of Clinical Oncology 2009; 27(22): 3584–3590.
- Gore ME, et al.: Final results from the large sunitinib global expanded-access trial in metastatic renal cell carcinoma. British journal of cancer 2015; 113(1): 12–19.
- Motzer RJ, et al.: Sunitinib: Ten Years of Successful Clinical Use and Study in Advanced Renal Cell Carcinoma. The Oncologist 2017; 22(1): 41–52.
- Motzer RJ, et al.: Pazopanib versus Sunitinib in Metastatic Renal-Cell Carcinoma. New England Journal of Medicine 2013; 369(8): 722–731.
- Escudier B, et al.: Randomized, Controlled, Double-Blind, Cross-Over Trial Assessing Treatment Preference for Pazopanib Versus Sunitinib in Patients With Metastatic Renal Cell Carcinoma: PISCES Study. Journal of Clinical Oncology 2014; 32(14): 1412–1418.
- Rini BI, et al.: Bevacizumab Plus Interferon Alfa Compared With Interferon Alfa Monotherapy in Patients With Metastatic Renal Cell Carcinoma: CALGB 90206. Journal of Clinical Oncology 2008; 26(33): 5422–5428.
- Hudes G, et al.: Temsirolimus, Interferon Alfa, or Both for Advanced Renal-Cell Carcinoma. New England Journal of Medicine 2007; 356(22): 2271–2281.
- Fischer S, et al.: Sequence of treatment in locally advanced and metastatic renal cell carcinoma. Translational andrology and urology 2015; 4(3): 310–325.
- Johnson DB, et al.: Immune Checkpoint Inhibitor Therapy in Patients With Autoimmune Disease. Oncology 2018; 32(4): 190–194.
- Morviducci L, et al.: Everolimus is a new anti-cancer molecule: metabolic side effects as lipid disorders and hyperglycemia. Diabetes research and clinical practice 2018.
- Schmidinger M, et al.: Cardiac toxicity of sunitinib and sorafenib in patients with metastatic renal cell carcinoma. Journal of clinical oncology : official journal of the American Society of Clinical Oncology 2008; 26(32): 5204–5212.
- Rini BI, et al.: Comparative effectiveness of axitinib versus sorafenib in advanced renal cell carcinoma (AXIS): a randomised phase 3 trial. Lancet 2011; 378(9807): 1931–1939.
- Motzer RJ, et al.: Long-term follow-up of overall survival for cabozantinib versus everolimus in advanced renal cell carcinoma. British journal of cancer 2018; 118(9): 1176–1178.
- Motzer RJ, et al.: Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma. The New England journal of medicine 2015; 373(19): 1803–1813.
- Motzer RJ, et al.: Lenvatinib, everolimus, and the combination in patients with metastatic renal cell carcinoma: a randomised, phase 2, open-label, multicentre trial. Lancet Oncol 2015; 16(15): 1473–1482.
- Rothermundt C, et al.: Second-line treatment for metastatic clear cell renal cell cancer: experts› consensus algorithms. World journal of urology 2017; 35(4): 641–648.
- Houk BE, et al.: Relationship between exposure to sunitinib and efficacy and tolerability endpoints in patients with cancer: results of a pharmacokinetic/pharmacodynamic meta-analysis. Cancer Chemotherapy and Pharmacology 2009; 66(2): 357–371.
- Atkinson BJ, et al.: Clinical Outcomes in Metastatic Renal Cell Carcinoma Patients Treated with Alternative Sunitinib Schedules. The Journal of urology 2014; 191(3): 611–618.
- Najjar YG, et al.: A 2 weeks on and 1 week off schedule of sunitinib is associated with decreased toxicity in metastatic renal cell carcinoma. European Journal of Cancer 2014; 50(6): 1084–1089.
- Boegemann M, et al.: Treatment modification with sunitinib in first-line (1L) metastatic renal cell carcinoma (mRCC): An analysis of the STAR-TOR registry. Journal of Clinical Oncology 2018; 36(6_suppl): 602–602.
- Iacovelli R, et al.: Clinical outcome of patients who reduced sunitinib or pazopanib during first-line treatment for advanced kidney cancer. Urologic oncology 2017; 35(9): 541.e547–541.e513.
- van der Zanden LFM, et al.: Description of the EuroTARGET cohort: A European collaborative project on TArgeted therapy in renal cell cancer-GEnetic- and tumor-related biomarkers for response and toxicity. Urologic oncology 2017; 35(8): 529.e529–529.e516.
InFo ONKOLOGIE & HÄMATOLOGIE 2018; 6(5): veröffentlicht am 19.10.18 (ahead of print)