Dans le cas de la BPCO, deux hypothèses semblent gravées dans le marbre : La maladie doit être définie dans l’examen spirométrique par un rapport entre la capacité d’une seconde FEV1 et la capacité vitale forcée FVC inférieur à 70% (FEV1/FVC <70) et les hommes âgés qui fument des cigarettes sont concernés. Le fait que ce n’est pas toute la vérité n’est pas encore parvenu à tous. L’occasion pour un groupe de recherche de formuler de nouveaux critères de définition.
Daiana Stolz de la Clinique de pneumologie de l’Hôpital universitaire de Fribourg (Allemagne) et de la Clinique de pneumologie de l’Hôpital universitaire de Bâle remettent en question les concepts de diagnostic et de traitement de la bronchopneumopathie chronique obstructive (BPCO), qui datent parfois de plusieurs décennies [1]. Les chercheurs formulent trois points clés qui devraient aider à aborder la BPCO à l’avenir :
- De nouveaux critères de diagnostic de la BPCO qui vont au-delà de la spirométrie
- Une nouvelle classification des sous-types 1 à 5 de la BPCO qui va au-delà de la fumée de cigarette
- Une nouvelle définition de l’exacerbation qui va au-delà de la nécessité d’un traitement médicamenteux
La BPCO est une maladie hétérogène qui entraîne de nombreuses conséquences systémiques et comorbidités qui peuvent varier d’un patient à l’autre. “C’est pourquoi nous pensons que les critères de diagnostic que nous utilisons aujourd’hui ne sont tout simplement pas assez bons”, a expliqué la pneumologue. La raison principale de cette évaluation est que les critères n’ont pas changé depuis des décennies et sont principalement basés sur la spirométrie après bronchodilatation. Cependant, celle-ci serait trop limitée pour refléter la diversité de la physiopathologie de la maladie. Il est bien connu que la spirométrie n’est pas sensible aux changements pathologiques à un stade précoce de la BPCO, qu’elle est globalement sous-utilisée ou souvent mal interprétée et que, de plus, elle n’est pas prédictive des symptômes.
L’objectif est de repousser le moment du diagnostic de l’âge moyen de la retraite au milieu de la trentaine, afin de stopper les altérations respiratoires précoces et les destructions emphysémateuses du parenchyme pulmonaire et de prévenir les défaillances d’organes ultérieures. Actuellement, la BPCO est diagnostiquée lorsque les lésions organiques sont déjà irréversibles, selon le professeur Stolz.
Elle plaide donc pour une définition plus large afin de prendre en compte les limitations du débit d’air détectées par des tests de fonction pulmonaire plus sensibles, ainsi que les changements pathologiques détectés par l’imagerie médicale. Les chercheurs estiment qu’en détectant la maladie plus tôt, il est possible d’augmenter les possibilités d’un traitement efficace, d’identifier les mécanismes responsables de la maladie et ainsi d’interrompre et d’inverser le cours de la maladie.
Nouveaux critères de diagnostic
Pour un futur diagnostic, le groupe présente trois critères pour définir la BPCO :
- Présence de symptômes respiratoires
- Anamnèse personnelle concernant les facteurs de risque
- Présence d’une limitation persistante du débit d’air ou d’une hétérogénéité ventilatoire détectée par spirométrie ou d’autres tests de la fonction pulmonaire, histologie ou scanner.
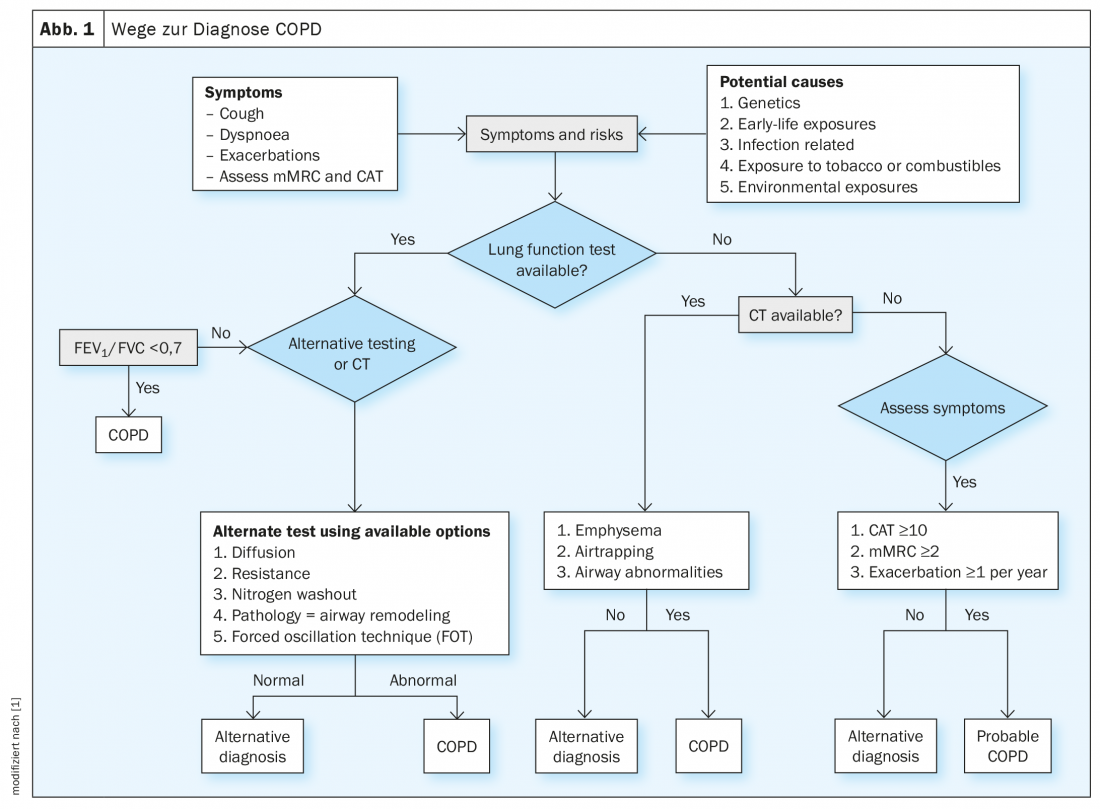
En clinique, il faut d’abord évaluer les symptômes et les facteurs de risque et, si disponible, effectuer un test de la fonction pulmonaire. Si une obstruction est présente en termes de VEMS/CVF <70, le diagnostic de BPCO peut être posé, sinon des tests alternatifs sont proposés : En cas de modification de la capacité de diffusion, de la résistance, du nitrogen washout, de la pathologie (airway remodeling) et de la technique d’oscillation forcée (FOT), une BPCO peut également être diagnostiquée.
En l’absence de test de la fonction pulmonaire, un scanner peut être envisagé comme méthode de diagnostic : En cas d’emphysème, d’aérotrapping ou d’anomalies des voies respiratoires, le diagnostic de BPCO est également possible. (Fig. 1). Si aucun scanner n’est disponible et que vous n’avez que les symptômes, le professeur Stolz recommande de s’orienter vers les valeurs CAT ≥10, mMrc ≥2 ainsi que ≥1 exacerbation/an. “S’ils apparaissent en même temps que les symptômes correspondants, vous pouvez supposer qu’il s’agit probablement d’une BPCO”.
Classification en sous-types
Auparavant, la BPCO était considérée comme une maladie de fumeurs, mais il est désormais reconnu que plusieurs autres facteurs sont impliqués dans la pathologie. En fonction des facteurs de risque associés au développement de la maladie chez un patient, un sous-type correspondant peut être attribué.
Les patients qui ne fument pas sont généralement plus jeunes et ont une meilleure fonction pulmonaire que ceux qui développent leur BPCO à cause de leur consommation de cigarettes. De même, tous ne présentent pas un déclin accéléré de la fonction pulmonaire avec l’âge, et environ 50% des patients atteints de BPCO ont un déclin normal de la fonction pulmonaire – mais n’atteignent jamais le pic de santé attendu de leur fonction pulmonaire au début de l’âge adulte.
Différentes méthodes de pronostic et considérations thérapeutiques peuvent être appliquées en fonction de la pathophysiologie individuelle des personnes concernées. En conséquence, la Commission propose de considérer la maladie comme ayant plusieurs évolutions potentielles au fil du temps, qui peuvent être dues à des facteurs de risque individuels et s’accumuler au cours de la vie, différents facteurs de risque ayant une importance plus ou moins grande. Par exemple, l’exposition à l’intérieur et sur le lieu de travail est plus importante que l’exposition à l’extérieur. Le diagnostic et les options de traitement doivent être envisagés de manière adaptée en conséquence.
Sur la base de chaque facteur de risque prédominant qui alimente la maladie, les scientifiques proposent une classification en 5 sous-types [2] :
- Type 1 – BPCO d’origine génétique (par ex. déficit en α1-antitrypsine)
- Type 2 – événements précoces de la vie (ex. : asthme infantile)
- Type 3 – Infections respiratoires (par ex. infections respiratoires infantiles, BPCO associée à la tuberculose ou au VIH)
- Type 4 – Exposition liée au tabagisme ou au vapotage (par ex. tabac, cannabis, tabagisme passif, y compris l’exposition in utero)
- Type 5 – lié à l’environnement (par ex. polluants atmosphériques intérieurs, exposition professionnelle aux vapeurs, gaz, poussières, etc., smog)
Bien entendu, les patients peuvent être affectés par plus d’un sous-type ; il est suggéré de relier le diagnostic à l’exposition la plus importante. Il faudrait analyser davantage de données pour déterminer avec précision comment les sous-types se rapportent aux endotypes et comment ceux-ci se rapportent à leur tour aux phénotypes. Les connaissances qui en résulteront permettront de déterminer quel type de traitement peut être envisagé pour les différents sous-types.
Exacerbations
Les scientifiques considèrent que la définition actuelle de l’exacerbation est problématique, car elle ne prend pas en compte le processus sous-jacent de l’événement, ni les sous-types ou l’utilisation de biomarqueurs pour la catégoriser. Elle peut également conduire à des diagnostics erronés et entraver les progrès dans ce domaine.
Le professeur Stolz propose donc une définition plus efficace : une exacerbation devrait être définie comme une augmentation de la toux, de la dyspnée ou de la production de crachats, plus au moins l’une des manifestations suivantes : Augmentation de la limitation du débit d’air ou de l’hétérogénéité de la ventilation, augmentation de l’inflammation des voies respiratoires ou de l’inflammation systémique, preuve d’une infection bactérienne ou virale – toujours en l’absence d’ischémie cardiaque aiguë, d’insuffisance cardiaque congestive ou d’embolie pulmonaire.
Une telle définition objective pourrait contribuer à améliorer l’évaluation standardisée et le traitement spécifique au patient. Cette approche s’accompagne d’examens standard qui doivent être réalisés à partir d’une liste de facteurs de risque essentiels chaque fois qu’un patient se présente avec une augmentation des symptômes respiratoires de la BPCO.
En outre, la Commission propose d’objectiver la gravité de l’exacerbation en fonction de certains critères basés sur le degré de détérioration clinique, biologique et physiologique. La présence de l’un de ces critères (par exemple une hypoxémie cliniquement significative, une attention réduite, des problèmes cardiaques) suffit à définir une exacerbation comme grave. Une évaluation globale de la gravité peut alors être calculée sur la base du nombre total de critères remplis. En revanche, les définitions des exacerbations légères ou modérées ne sont plus nécessaires, conclut-elle.
Source : Symposium : Towards elimination of COPD – Innovative views from the Lancet Commission on COPD ; Exposé : Revisiting the diagnosis and classification of COPD. Congrès de l’European Respiratory Society, Barcelone, 6.09.2022.
Littérature :
- Stolz D, Mkorombindo T, Schumann DM, et al : vers l’élimination de la bronchopneumopathie chronique obstructive : une commission du Lancet. Lancet 2022 ; 400 (10356) : 921-972 ; doi : 10.1016/S0140-6736(22)01273-9.
- Brusselle GG, Humbert M : Classification of COPD : fostering prevention and precision medicine in the Lancet Commission on COPD. Lancet 2022 ; 400 (10356) : 869-871 ; doi : 10.1016/S0140-6736(22)01660-9.
InFo PNEUMOLOGIE & ALLERGOLOGIE 2022 ; 4(4) : 38-39











