Entre 30 et 80% des patients atteints de cancer sont malnutris au moment du diagnostic. La malnutrition augmente la mortalité et la morbidité et diminue la tolérance aux traitements anti-tumoraux. Le dépistage de la malnutrition au moyen d’instruments de mesure établis fait partie intégrante de tout traitement anti-tumoral. Les objectifs de la thérapie nutritionnelle progressive sont le traitement de la malnutrition, l’amélioration de la qualité de vie, l’amélioration de l’effet des thérapies anti-tumorales et la réduction des effets secondaires. Un régime cétogène n’est pas recommandé.
La cachexie tumorale est une constatation fréquente chez les personnes atteintes de cancer. La cachexie désigne une perte de poids principalement due à une altération du métabolisme, généralement causée par la tumeur elle-même. Il s’agit d’un état complexe, métabolique et endocrinien. La perte de poids ne concerne pas seulement la graisse corporelle, mais aussi les muscles. Les patients qui souffrent de cachexie peuvent également manquer d’appétit.
On distingue trois niveaux de cachexie : la précachexie, la cachexie et la cachexie réfractaire. On parle de précachexie lorsque la perte de poids est inférieure à 5% et qu’il existe des modifications métaboliques. La cachexie réfractaire survient souvent au stade terminal des maladies tumorales. Le métabolisme est alors catabolique et l’espérance de vie restante est généralement inférieure à trois mois.
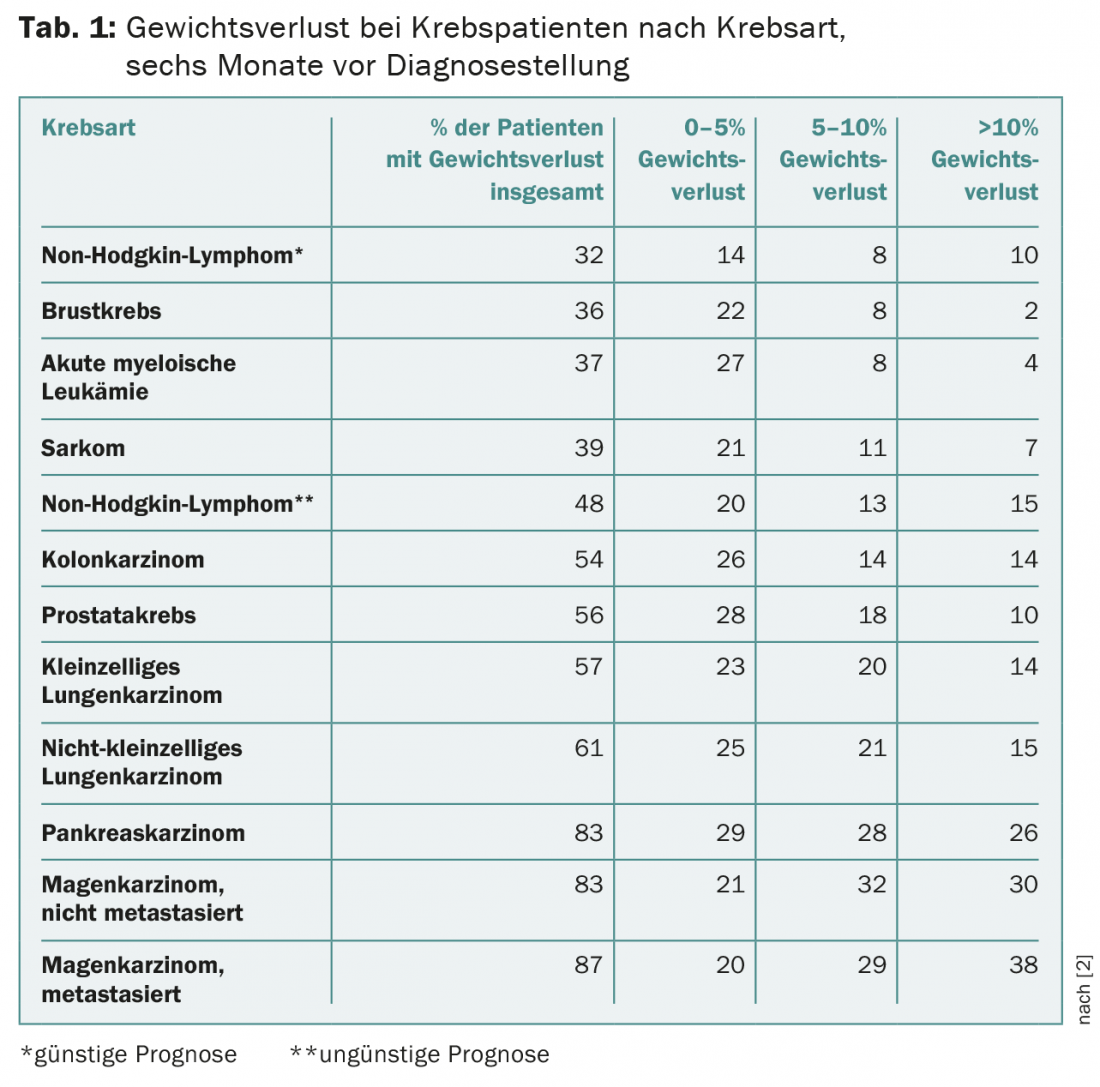
Selon la progression de la tumeur et sa localisation, 30 à 80% des patients sont déjà malnutris au moment du diagnostic. Dès 1980, Dewys et al. montrent qu’entre 31 et 87% des patients étaient malnutris avant le diagnostic. Au moment du diagnostic, 16% des patients souffraient de malnutrition sévère (tableau 1).
Causes de la malnutrition
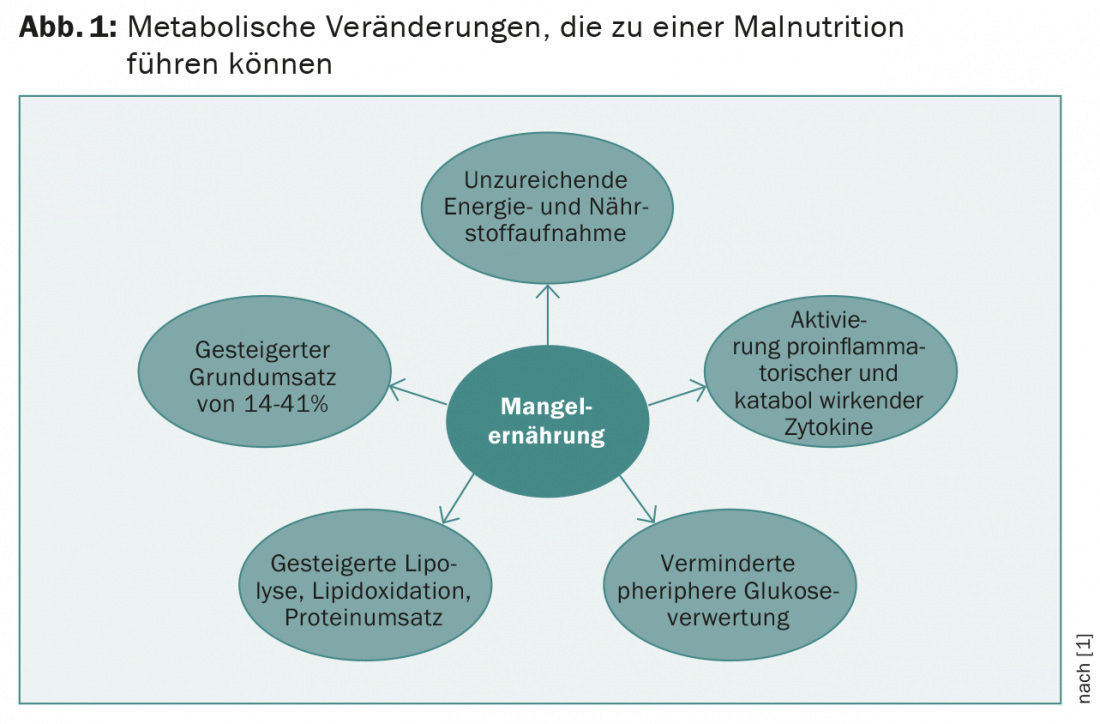
Les modifications métaboliques associées à la tumeur entraînent la malnutrition . L’une des causes est la diminution de l’apport alimentaire. Celle-ci est causée, entre autres, par une diminution de l’appétit, une altération du goût, des effets psychologiques et une xérostomie. Mais la déshydratation et la sarcopénie sont également des déterminants caractéristiques. L’activation systématique des cytokines pro-inflammatoires et cataboliques (facteur de nécrose tumorale-α, interleukine-1, interleukine-6, interleukine-8, interféron-γ) joue un rôle central. De plus, la lipolyse, l’oxydation des lipides et la dégradation des protéines sont augmentées. Le catabolisme des protéines musculaires est en outre favorisé par les cytokines prokachectiques. Le taux métabolique de base peut être augmenté de 14 à 41%. Une modification de la situation hormonale (testostérone, hormones thyroïdiennes et de croissance) contribue également à l’apparition de la cachexie (figure 1).
En conséquence de la malnutrition, la mortalité est plus élevée. De même, le risque de morbidité augmente. Il s’agit de troubles de la cicatrisation des plaies, d’un risque accru d’escarres, d’infections et de dysfonctionnements d’organes. En outre, la tolérance aux traitements anti-tumoraux diminue.
Reconnaître la malnutrition
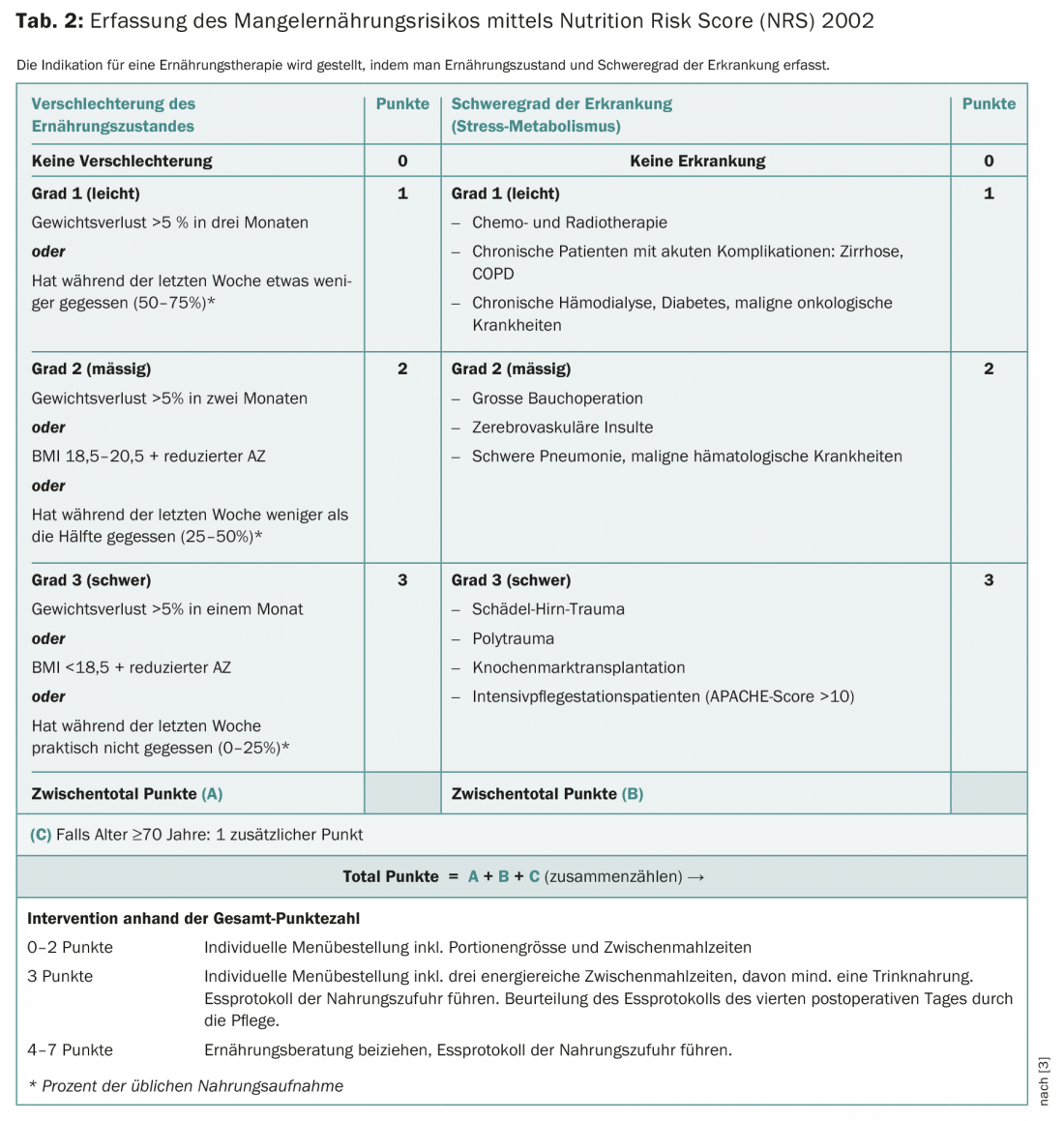
Le dépistage de la malnutrition au moyen d’instruments de mesure établis fait partie intégrante de tout traitement anti-tumoral. Le NRS-2002 (Nutrition Risk Score-2002) ou le PG-SGA (Patient-Generated Subjective Global Assessement) sont les plus appropriés. Dans la pratique clinique quotidienne, le NRS-2002 s’est avéré être un instrument de dépistage validé (tableau 2).
Il consiste en un pré-screening de quatre questions :
- L’IMC est-il inférieur à 20,5 kg/m2 ?
- Perte de poids au cours des trois derniers mois ?
- Réduction de l’apport alimentaire au cours de la semaine écoulée ?
- Existe-t-il une maladie grave ?
Si la réponse à une question est oui, le dépistage doit être complété. Une thérapie nutritionnelle doit être initiée à ≥3 points (voir exemple de cas).

Une étude de mise en œuvre menée au Danemark a montré que l’évaluation du statut de risque des patients par les professionnels de la santé et par le responsable de l’étude était pratiquement toujours la même, que le dépistage par le NRS-2002 ait été effectué par des diététiciens ou des infirmiers. Kondrupt et al. ont pu démontrer la facilité d’utilisation du NRS-2002, puisque 99% des 750 patients admis à l’hôpital ont pu être dépistés.
Principes de la thérapie nutritionnelle du cancer
Il n’est pas clairement établi qu’une thérapie nutritionnelle en cas de malnutrition améliore le pronostic. Les patients bénéficient toutefois d’une meilleure réponse au traitement de la tumeur et d’une réduction des effets secondaires pendant le traitement. Les objectifs de la thérapie nutritionnelle chez les patients atteints de cancer sont les suivants :
- Détection, prévention et traitement de la malnutrition
- Amélioration de la qualité de vie
- Améliorer l’efficacité des thérapies anti-tumorales
- Réduire les effets secondaires des thérapies anticancéreuses.
Le traitement nutritionnel des patients atteints de malnutrition tumorale est divisé en six étapes. La stratégie nutritionnelle thérapeutique est une ligne directrice valable de la Société allemande de médecine nutritionnelle (DGEM), de la Société européenne de nutrition parentérale et entérale (ESPEN) et de la Société allemande de gériatrie (DGG). A partir d’un NRS-2002 ≥3, une thérapie nutritionnelle est indiquée (tableau 3). La thérapie nutritionnelle débute idéalement au stade de la précachexie, mais au plus tard au stade de la cachexie. Au stade de la cachexie réfractaire, le bénéfice de la thérapie nutritionnelle n’existe plus.

Besoins en énergie et en protéines
Les besoins en énergie sont calculés de la manière suivante :
Patients immobiles : 20-25 kcal/kgKG/jour
Sans perte de poids : 30-35 kcal/kgKG/jour
Avec perte de poids : 35-40 kcal/kgKG/jour
Les besoins en protéines sont calculés de la manière suivante :
Sans perte de poids : 1,2-1,5 g/kgKG/jour
Avec perte de poids : 1,5-2,0 g/kgKG/jour
Les besoins en glucides se situent entre 40 et 50 % de l’apport énergétique total. Les besoins en glucides dans le traitement du cancer font l’objet de discussions aussi bien sur les forums non spécialisés que dans les revues spécialisées. Deux questions se posent : un régime cétogène prévient-il ou réduit-il la croissance des tumeurs ? Un régime alimentaire riche en protéines et en graisses réduit-il la progression de la maladie tumorale ou le risque de récidive ?
Les études sur le régime cétogène chez les patients atteints de cancer pour réduire la croissance tumorale sont nombreuses. Les bases de données électroniques telles que Pubmed et la Cochrane Library affichent plus de 270 études, à la fois humaines et animales. Les études sur les animaux ont montré une différence dans la croissance tumorale et la survie, mais les études sur l’homme n’ont pas encore pu le démontrer. C’est pourquoi nous ne recommandons pas de régime cétogène.
Il n’est pas possible de dire avec certitude si un régime alimentaire riche en protéines et en graisses réduit le risque de récidive. L’étude d’observation prospective de Meyerhardt, publiée en 2012, montre une relation significative entre la charge glycémique ou le taux de glucose dans le sang et la glycémie. l’apport total en glucides et le risque de récidive. Chez les patients cancéreux qui perdent du poids et présentent une résistance accrue à l’insuline, il est recommandé d’augmenter l’apport en graisses au détriment de l’apport en glucides (ratio 50:50), d’une part pour réduire la charge glycémique et d’autre part pour augmenter la densité énergétique de l’alimentation.
Une alimentation riche en énergie
Une alimentation riche en énergie est nécessaire dans la plupart des cas. La base de la nutrithérapie est l’enrichissement des plats. Cela permet de maintenir ou d’améliorer l’apport énergétique malgré la réduction de l’apport alimentaire. L’enrichissement se fait par le biais d’aliments à haute densité énergétique tels que les huiles végétales, la crème entière, le beurre, les noix, les avocats, le lait de coco, le miel, la poire, le lait concentré, le fromage blanc à la crème, etc. Si ces mesures ne suffisent pas, les maltodextrines et les protéines en poudre peuvent être ajoutées aux aliments et aux boissons. Une cuillère à soupe de maltodextrine fournit environ 9 g de glucides et 38 kcal, une cuillère à soupe de protéines en poudre fournit environ 9 g de protéines et 38 kcal.
Les formules d’alimentation buvable sont un autre outil de la thérapie nutritionnelle des patients atteints de tumeurs et souffrant de malnutrition. L’efficacité est démontrée avec un niveau de preuve A en cas de radiothérapie, de risque nutritionnel élevé 10 à 14 jours avant une chirurgie majeure et chez tous les patients cinq à sept jours avant une chirurgie abdominale majeure (ESPEN Guidelines Onkologie 2006). Chez les patients souffrant de malnutrition et de tumeurs ambulatoires, les études de Poulsen et Usler ont montré une amélioration de la couverture des besoins en énergie et en protéines, mais aucune amélioration significative de la qualité de vie n’a été observée. Il est donc indispensable d’avoir une discussion approfondie avec les patients sur les possibilités et les avantages de la nutrition orale (tableau 4).

Situations nutritionnelles particulières
En cas de maladies et de traitements tumoraux, des troubles tels que l’altération du goût, la nausée, le vomissement, la diarrhée, la xérostomie et la stomatite peuvent apparaître, en particulier dans la bouche, la gorge et le tractus gastro-intestinal. La prise en charge nutritionnelle de ces troubles est très importante et nécessite des conseils nutritionnels personnalisés qui soutiennent et accompagnent les personnes concernées de manière ciblée.
Littérature :
- van Cutsem E, et al : The causes and consequences of cancer-associated malnutrition. Europ J Oncology Nursing 2005 ; Supplt 2 : S51-63.
- DeWys WD, et al : Effet pronostique de la perte de poids avant la chimiothérapie chez les patients cancéreux. Am J Med 1980 ; 69 : 491-497.
- Kondrup J, et al : Nutritional risk screening (NRS 2002) : a new method based on an analysis of controlled clinical trials. Clin Nutr 2003 ; 22(3) : 321-336.
Littérature complémentaire :
- van Eys J : Effet du statut nutritionnel sur la réponse au traitement. Cancer Research 1982 ; (Suppl.) 42 : 747s-753a.
- Fredix EW, et al : Effet de différents types de tumeurs sur la dépense énergétique au repos. Cancer Res 1991 ; 51(22) : 6138-6141.
- Arends J, et al : ESPEN Guidelines on Enteral Nutrition : Non-surgical oncology. Clin Nutr 2006 ; 2 : 245-259.
- Farber G, et al : Cancer et nutrition. Oncologue 2011 ; 17 : 906-912.
- Meyerhardt JA, et al : Dietary glycemic load and cancer recurrence and survival in patients with stage 3 colon cancer. J Natl Cancer Inst 2012 ; 104(22) : 1702-1711.
- Poulsen GM, et al : Essai randomisé sur les effets du conseil nutritionnel individuel chez les patients cancéreux. Clin Nutr 2014 ; 33 : 749-753.
- Uster A, et al : Influence d’une intervention nutritionnelle sur la consommation alimentaire et la qualité de vie des patients atteints de cancer : un essai contrôlé randomisé. Clin Nutr 2013 ; 29 : 1342-1349.
- Evans WJ, et al : Cachexia : A new definition. Clin Nutr 2008 ; 27 : 793-799.
- Kondrup J, et al : Incidence du risque nutritionnel et causes de soins nutritionnels inadéquats dans les hôpitaux. Clin Nutr 2002 ; 21 : 461-468.
- Valenthi L, et al. : Lignes directrices de la Société allemande de nutrition. Aktuelle Ern.medizin 2013 ; 38 : 97-111.
InFo ONKOLOGIE & HÄMATOLOGIE 2015 ; 3(9-10) : 26-30
PRATIQUE DU MÉDECIN DE FAMILLE 2016 ; 11(8) : 11-15