En cas de changement de caractère ou de maladresse motrice nouvellement apparue, mesurer le périmètre crânien et procéder à un examen neurologique, éventuellement répétitif. En Suisse, le traitement des tumeurs cérébrales de l’enfant fait partie de la médecine hautement spécialisée (MHS). Le traitement et la prise en charge optimale des enfants atteints de tumeurs cérébrales ne peuvent être réalisés que dans des hôpitaux disposant d’équipes interdisciplinaires expérimentées et bien rodées.
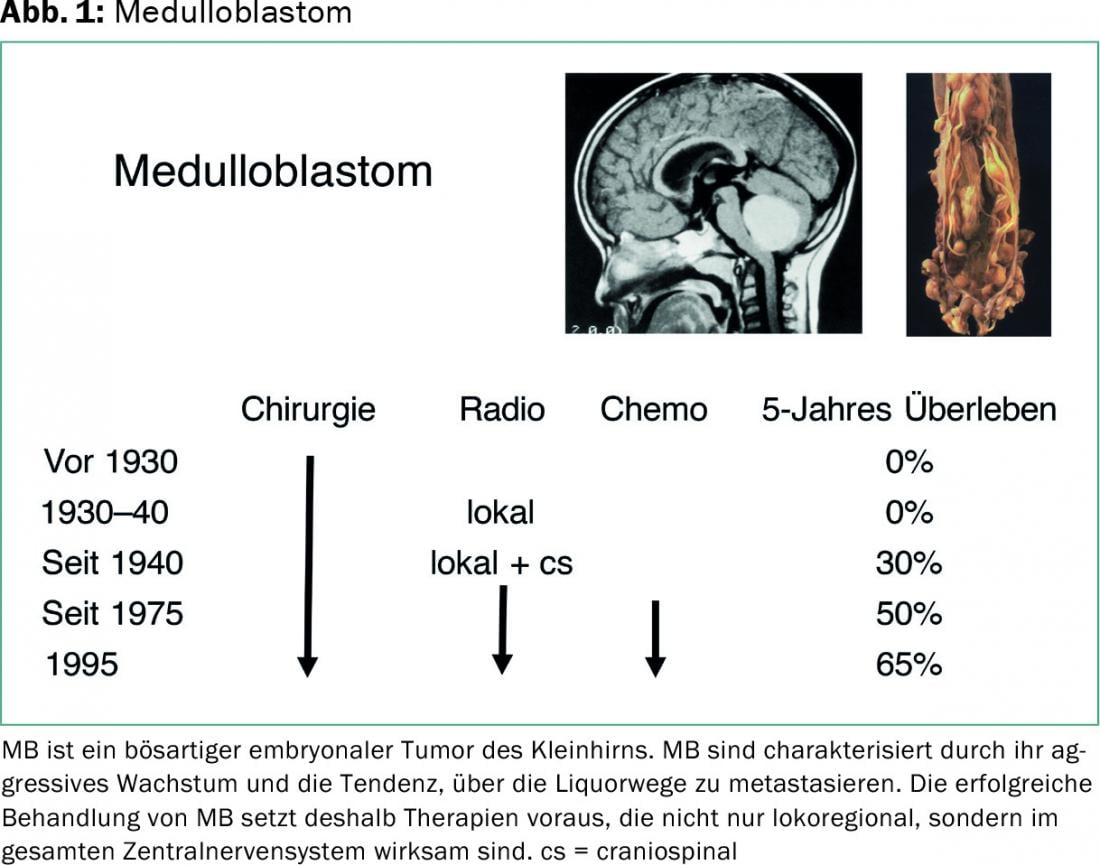
Le médulloblastome (MB) est une tumeur embryonnaire maligne du cervelet. Elle survient principalement chez les jeunes enfants et les enfants en bas âge et constitue la tumeur cérébrale maligne la plus fréquente dans ce groupe d’âge. Selon la classification OMS des tumeurs du système nerveux central, les MB sont classées en grade IV.
Les MB se caractérisent par leur croissance agressive et leur tendance à métastaser par les voies du LCR. Le traitement réussi de la MB nécessite donc des thérapies qui ne sont pas seulement efficaces au niveau locorégional, mais dans l’ensemble du système nerveux central. Après une résection tumorale aussi complète que possible, il s’agit généralement d’une radiothérapie (avec irradiation de l’ensemble du cerveau et de l’axe spinal, et saturation dans la zone tumorale élargie), ainsi que d’une chimiothérapie.
Les MB se manifestent souvent par des signes cérébelleux et des symptômes d’augmentation de la pression intracrânienne. Sa localisation dans la fosse crânienne postérieure entraîne une obstruction des voies d’écoulement du liquide céphalorachidien et donc une hydrocéphalie occlusive. Chez les enfants de moins de deux ans, en raison des sutures et des fontanelles encore ouvertes, la pression intracrânienne se manifeste principalement par une croissance excessive de la tête et des fontanelles protubérantes. La perception précoce de la pression intracrânienne est difficile lorsqu’elle ne se manifeste initialement que par un changement de caractère. Il s’agit ici pour le praticien de mesurer le périmètre crânien, car une croissance excessive de la tête n’est souvent pas remarquée par les parents et de procéder à un examen neurologique, éventuellement répétitif.
La perception et l’interprétation correcte de troubles moteurs parfois très discrets peuvent également poser problème (“il est juste un peu maladroit”). Chez les enfants plus âgés, les adolescents et les adultes, les maux de tête, les vomissements, la parésie des abducteurs (souvent non gênante subjectivement) et les papilles congestives prédominent.
La plupart du temps, les MB apparaissent de manière sporadique, sans cause familiale ou environnementale apparente. Dans quelques cas, les MB apparaissent dans le cadre de syndromes familiaux de prédisposition au cancer, par exemple le syndrome de Li-Fraumeni.
Taux de survie des patients atteints de MB
Les taux de survie des patients atteints de MB se sont améliorés au cours des dernières décennies. Alors qu’avant 1970, seuls 20% environ des patients survivaient, les taux de survie à cinq ans sont aujourd’hui nettement plus élevés, puisqu’ils atteignent 65%. Cependant, en fonction de facteurs cliniques, histologiques et moléculaires, le pronostic varie considérablement d’un cas à l’autre [1].
Malheureusement, il s’est avéré que 40 à 100 % des survivants de la MB à long terme présentaient des troubles de croissance et des dysfonctionnements endocriniens parfois considérables, et près de 90 % des déficits cognitifs (y compris des problèmes de concentration et de mémoire). Les déficits cognitifs ne sont généralement pas une conséquence directe de la tumeur ou de la chirurgie tumorale, mais sont principalement liés à la radiothérapie, en fonction de la dose de rayonnement et de l’âge du patient. Normalement, cela ne se traduit pas par une perte de ce qui a déjà été appris, mais par une diminution du taux d’apprentissage.
Les troubles de l’audition sont également relativement fréquents : Les dérivés du platine peuvent endommager les cellules ciliées de l’oreille interne, tandis que les radiations peuvent endommager le nerf auditif. Il est donc important de procéder à des audiométries régulières pendant la chimiothérapie. En fonction de l’étendue de la tumeur, les patients atteints de MB souffrent souvent aussi de troubles moteurs, y compris de troubles de l’équilibre. Ataxies et parésies. Ces troubles ne régressent pas toujours après la thérapie. En conséquence, les mesures de réadaptation telles que la physiothérapie et l’ergothérapie ne doivent pas commencer à la fin du traitement, mais pendant celui-ci.
Les tests neuropsychologiques sont intégrés dans le diagnostic accompagnant la thérapie chez les enfants. L’objectif est de favoriser le développement scolaire et professionnel par des mesures appropriées. Souvent, l’intégration sociale des anciens patients atteints de MB est également compromise. Plus de la moitié des survivants à long terme de la MB vivent seuls ou dans leur famille nucléaire et ont tendance à se retirer en raison de leur handicap.
Quelles sont les stratégies pour améliorer la qualité de vie apparemment très réduite de ces patients ? Outre les mesures de réintégration sociale et de réadaptation à l’école et au travail, il s’agit surtout de réduire les effets tardifs liés au traitement en évitant ou en retardant la radiothérapie chez les jeunes enfants et de mieux stratifier les patients en fonction des risques.
Possibilités de prévision
Depuis le début des années 80, plusieurs grandes études ont défini des facteurs pronostiques cliniques (y compris d’imagerie) pour la MB. Il est apparu que la détection de métastases leptoméningées au moment du diagnostic (fig. 2) était le facteur pronostique le plus important, suivi de la masse tumorale résiduelle et de l’âge du patient au moment du diagnostic.
Ces facteurs cliniques ont été utilisés pour classer les patients MB en un groupe “à risque standard” (pas de métastases, <1,5 cm2 de masse tumorale résiduelle, âge du patient au moment du diagnostic ≥3 ans) et un groupe “à haut risque” (métastases, ≥1,5 cm2 de masse tumorale résiduelle, et âge du patient au moment du diagnostic<3 ans). Elles ne suffisent toutefois pas à définir de manière fiable un groupe de patients dont le risque de progression tumorale est si faible qu’ils pourraient être traités avec des modalités thérapeutiques nettement moins toxiques.

Grâce à l’analyse en série de l’expression des gènes sur plusieurs centaines de MB, il a été possible ces dernières années d’identifier des sous-groupes moléculaires de MB [2–4].
Actuellement, les MB sont classés en quatre sous-groupes (Wnt/Wingless=WNT, Sonic hedgehog=SHH, groupe 3, groupe 4) selon des critères de biologie moléculaire (tableau 1). Ces sous-groupes se distinguent également par des critères épidémiologiques et cliniques. Les preuves de métastases sont très rares pour le sous-type WNT, rares pour le sous-type SHH, mais fréquentes pour les groupes 3 et 4. Le pronostic est très favorable pour le sous-type WNT, favorable pour les jeunes enfants et intermédiaire pour les personnes âgées dans le sous-type SHH, défavorable pour le sous-type du groupe 3 et intermédiaire pour le sous-type du groupe 4. Dans le sous-type SHH en particulier, l’utilisation d’inhibiteurs de SMO ouvre de nouvelles options thérapeutiques [5].

Les études multicentriques actuelles et prévues ont pour objectif de réduire les effets tardifs liés au traitement tout en maintenant un taux de guérison élevé dans les MB à faible risque, et d’améliorer les taux de survie dans les groupes à haut risque [1]. Suivant la devise de l’OMS : “Cure is more than the eradication of cancer… cure is the restoration of health”.
Littérature :
- Gerber NU, et al : Recent developments and current concepts in medulloblastoma. Cancer Treat Rev 2014 ; 40(3) : 356-365.
- Kool M, et al : Molecular subgroups of medulloblastoma : an international meta-analysis of transcriptome, genetic aberrations, and clinical data of WNT, SHH, Group 3, and Group 4 medulloblastomas. Acta Neuropathol 2012 ; 123(4) : 473-484.
- Northcott PA, et al : Medulloblastomics : the end of the beginning. Nat Rev Cancer 2012 ; 12(12) : 818-834.
- Taylor MD, et al : Sous-groupes moléculaires du médulloblastome : le consensus actuel. Acta Neuropathol 2012 ; 123(4) : 465-472.
- Rudin CM, et al : Treatment of medulloblastoma with hedgehog pathway inhibitor GDC-0449. N Engl J Med 2009 ; 361(12) : 1173-1178.
InFo ONKOLOGIE & HÄMATOLOGIE 2016 ; 4(5) : 25-27