Les troubles vasomoteurs (VMS) tels que les bouffées de chaleur et les sueurs sont parmi les symptômes les plus courants de la ménopause. L’hormonothérapie ménopausique (MHT) constitue le traitement le plus efficace. La décision de recourir ou non à la MHT est basée, entre autres, sur l’intensité des symptômes individuels, les comorbidités, le risque individuel de certaines maladies et l’attitude personnelle vis-à-vis de la ménopause et du traitement des symptômes liés à la ménopause. En 2015, les recommandations de la SSGO sur la MHT ont été mises à jour.
Les bouffées de chaleur et les sueurs (troubles vasomoteurs, VMS) font partie des symptômes les plus courants de la ménopause. La prévalence de ces troubles peut atteindre 50% en phase de reproduction et de périménopause et jusqu’à 80% en postménopause. La durée totale médiane des SGV fréquents (c’est-à-dire ≥6 jours avec SGV au cours des deux dernières semaines) est de 7,4 ans, et même de plus de 11,8 ans si le début se situe en pré- ou en début de périménopause [1]. Les SMV sont attribués à un dysfonctionnement hypothalamique thermorégulateur dû à la réduction de l’activité opioïde centrale endogène associée à la ménopause et due à une carence en œstrogènes [2].
Diagnostic
Le diagnostic de base du VMS comprend l’anamnèse et le laboratoire :
- Antécédents : la femme est-elle ménopausée ? (aménorrhée secondaire depuis douze mois) ; questionnaire sur les symptômes de la ménopause, par ex. échelle d’évaluation de la ménopause (MRS) II
- Laboratoire : existe-t-il un hypogonadisme hypergonadotrope ? (FSH >40 UI/l avec trois mesures à quelques semaines d’intervalle ; déficit en œstrogènes à E2 <30 pg/ml)
Dans le diagnostic différentiel du VMS, on distingue les “wet flushes” des “dry flushes”, c’est-à-dire si la sensation de chaleur s’accompagne également de transpiration (tableau 1) [3,4]. En conséquence, le diagnostic différentiel comprend :
- Diagnostic de laboratoire en sérum ou en urine Sang EDTA : FSH, estradiol, progestérone, TSH, fT3, fT4, anti-TPO, TRAK, hémogramme différentiel, transaminases, créa-
- tinine, potassium, glycémie à jeun, hémocultures si nécessaire, test VIH, test TINE, tryptase, VIP (peptide intestinal vasoactif), calcitonine
- Diagnostic de laboratoire dans l’urine collectée sur 24 heures : 5-Hy-
- acide droxyindolacétique (5-HIAA), catécholamines (adrénaline, noradrénaline) ou métabolites de catécholamines (métanéphrines, normétanéphrine), méthylhistamine ou acide 1,4-méthylimidazolacétique
- Le cas échéant, imagerie : radiographie thoracique, scanner thoracique, échographie rénale
- Biopsie de la moelle osseuse, le cas échéant.

Thérapie
Pour le traitement du SMV, on dispose de l’hormonothérapie ménopausique conventionnelle (MHT), de la médecine alternative et complémentaire et de la pharmacothérapie non hormonale. Nous allons maintenant nous intéresser de plus près à la MHT, car en 2015, la Société suisse de gynécologie et d’obstétrique (SSGO) a mis à jour sa lettre d’experts sur la MHT [5].
Hormonothérapie de la ménopause (MHT)
Indications, posologie et mode d’administration : la MHT conventionnelle implique l’utilisation d’œstrogènes, de progestatifs et, dans une moindre mesure, d’androgènes. Les indications de la MHT systémique sont le VMS. D’autres troubles liés à la ménopause peuvent également être améliorés ou supprimés, comme les troubles du sommeil, les états dépressifs, la baisse des performances et de la mémoire, les symptômes osseux et articulaires, les modifications de la vue, de la peau et des muqueuses, ainsi que la chute des cheveux.
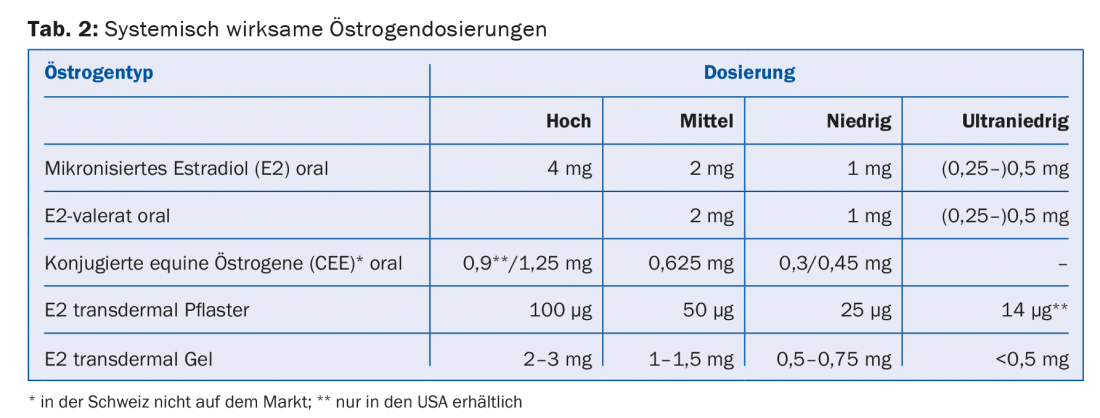
Les œstrogènes à action systémique existent en différents dosages (élevé, moyen, faible et ultra-faible) et formes d’administration (comprimés, gel, patch) (tableau 2). Chez les femmes ayant un utérus, l’administration supplémentaire d’un progestatif est indiquée pour la protection de l’endomètre. Il est également possible d’administrer directement un progestatif par le biais d’un DIU (Mirena®). Les doses d’œstrogène et de progestatif doivent être aussi faibles que possible. Toutefois, en cas de ménopause précoce (<40 ans) et de ménopause précoce (<45 ans), une “vraie” substitution hormonale doit être poursuivie au moins jusqu’à 51 ans. Chaque MHT devrait être réévalué chaque année. Il n’est pas nécessaire ni utile de limiter arbitrairement la durée d’application de la MHT.
Les contre-indications : Les contre-indications absolues à la MHT sont la grossesse, les saignements vaginaux inexpliqués, le cancer du sein et de l’endomètre et les thromboembolies artérielles et veineuses. Les contre-indications relatives sont par exemple une maladie hépatique aiguë, un dysfonctionnement hépatique chronique sévère, des calculs biliaires, certains troubles du métabolisme lipidique, l’hypertension et les migraines.
Bénéfices supplémentaires d’une MHT
Prévention des fractures : sous MHT, le risque de fracture lié à l’ostéoporose diminue significativement de 25 à 40% dans toutes les localisations. Chez les femmes présentant un risque accru de fracture, la MHT est donc un traitement de premier choix, même dans les cas asymptomatiques. Il n’existe pas de données sur les fractures pour les préparations de MHT à faible et ultra-faible dose. Il n’est pas recommandé de commencer une MHT dans le seul but de prévenir les fractures après l’âge de 60 ans. En revanche, une MHT individualisée peut être poursuivie au-delà de 60 ans dans le seul but de prévenir les fractures, à condition de prendre en compte les avantages et les risques potentiels à long terme par rapport aux traitements alternatifs non hormonaux. En cas d’ostéoporose manifeste (avec fracture), un traitement spécifique est indiqué.
Maladie coronarienne : une monothérapie par œstrogènes à dose moyenne réduit significativement le risque de maladie coronarienne et la mortalité totale chez les femmes qui commencent une MHT à l’âge de <60 ans ou dans les dix ans suivant la ménopause (“fenêtre favorable”). Une administration combinée d’œstrogènes et de progestatifs débutant dans la fenêtre favorable a un effet neutre à positif en fonction du progestatif utilisé. La seule prévention cardiovasculaire primaire n’est pas une indication de MHT. L’HMT est contre-indiquée en prévention secondaire et en cas de maladie coronarienne symptomatique existante.
Les risques de la MHT
les accidents vasculaires cérébraux (AVC) : Le risque supplémentaire d’AVC ischémique attribuable à l’utilisation d’une MHT par voie orale augmente en fonction de l’âge. Il n’existe pas de “fenêtre bon marché”. Le risque absolu reste faible chez les femmes <60 ans dans la Women’s Health Initiative (WHI) [6] et dans les grandes études d’observation, avec un à deux cas pour 10 000 années-femmes. Après 60 ans, le risque d’IVC peut atteindre un niveau significatif sous MHT orale. Sous une MHT transdermique à dose faible à moyenne, le risque est moindre. Par conséquent, les œstrogènes transdermiques devraient être préférés chez les femmes présentant un risque de base d’IVC plus élevé.
Thromboembolie veineuse (TEV) : il n’y a pas de “fenêtre favorable”. Sous MHT, dans le groupe des 50-59 ans, le risque supplémentaire de TEV avec CEE plus acétate de médroxyprogestérone (MPA) est de 11 cas pour 10000femmes-années (WHI) et de 4 cas avec CEE seul. Le risque le plus élevé est observé dans les premiers mois suivant le début du traitement. Sous une MHT transdermique à dose faible à moyenne, le risque est plus faible ou n’augmente pas. La durée d’utilisation et le type/dosage du progestatif peuvent influencer le risque de TEV en combinaison avec les œstrogènes. Avec la progestérone et la dydrogestérone micronisées, le risque semble être moindre qu’avec les progestatifs synthétiques.
Système nerveux central : les conséquences à long terme sur la cognition et la démence d’une MHT débutée en périménopause ou en début de postménopause sont encore largement inconnues. Une MHT débutée tardivement (>65 ans) pourrait avoir un effet défavorable sur la cognition. Une MHT commencée autour de la ménopause et poursuivie jusqu’à dix ans pourrait être associée à une réduction du risque de maladie d’Alzheimer.
Cancer du sein : en ce qui concerne le risque de cancer du sein, il convient de distinguer les monothérapies œstrogéniques des traitements œstroprogestatifs. Selon l’étude WHI, le risque de cancer du sein et la mortalité par cancer du sein ne sont pas significativement réduits chez les femmes hystérectomisées traitées par CEE seul pendant sept ans. Dans les études WHI, Danish Osteoporosis Prevention Study (DOPS) [7] et Nurses’ Health Study (NHS) [8], aucune augmentation du risque d’incidence et de mortalité du cancer du sein n’a été constatée sous monothérapie par œstrogènes jusqu’à une durée d’observation cumulée de 13, 16 et 19 ans respectivement. Lors d’une monothérapie par œstrogènes ≥20 ans, une augmentation du risque de cancer du sein a été observée chez les femmes de poids normal, mais pas chez les femmes en surpoids ou obèses.
La situation est différente dans le cas d’un traitement œstroprogestatif. Sous CEE + MPA, le risque de cancer du sein n’est pas augmenté chez les premières utilisatrices pendant les 5,6 premières années de traitement. Le risque commence ensuite à augmenter. Sous CEE + MPA, neuf cas de cancer du sein invasif de plus pour 10 000 femmes-années ont été observés dans la WHI que dans le groupe témoin, après une période d’observation cumulée de 13 ans. En revanche, l’E2 + acétate de noréthistérone (NETA) dans la DOPS n’a pas augmenté le risque de cancer du sein pendant la période d’observation de 16 ans. La progestérone micronisée et la dydrogestérone combinées à un œstrogène peuvent être associées à un risque plus faible que les progestatifs synthétiques. L’ampleur de l’augmentation du risque sous un traitement combiné œstroprogestatif dépend donc du type de progestatif utilisé et de la durée d’application.
Mortalité
Les méta-analyses, les essais contrôlés randomisés et les études d’observation démontrent tous une réduction de la mortalité globale lorsque les participantes à l’étude ont reçu une monothérapie à base d’œstrogènes à dose moyenne avant l’âge de 60 ans ou au cours des dix premières années postménopausiques (“fenêtre favorable”). Dans la DOPS, la mortalité totale n’a pas diminué de manière significative sous E2 et sous E2 + NETA. A l’inverse, la NHS montre, en accord avec d’autres études, que l’ovariectomie bilatérale prophylactique est associée à une augmentation de la mortalité à long terme chez les femmes de moins de 50 ans. Sous monothérapie œstrogénique, après 13 ans (WHI) ou 16 ans (DOPS) d’observation, la mortalité totale, la mortalité cardiaque et la mortalité par cancer du sein ont été significativement réduites.
Influence sur d’autres risques
Dans l’étude WHI, comme dans l’étude BCDDP, une réduction significative du nombre de cancers du côlon a été observée avec l’administration combinée de CEE et de MPA par voie orale, mais pas avec la monothérapie par CEE par voie orale. La MHT transdermique ne semble pas réduire l’incidence du cancer du côlon. Il n’existe aucune preuve épidémiologique d’une modification du risque de cancer bronchique ou de la vésicule biliaire par une MHT. En revanche, la MHT par voie orale (mais pas transdermique) augmente le risque de cholélithiase et de cholécystectomie.
Littérature :
- Avis NE, et al : Duration of menopausal vasomotor symptoms over the menopause transition. JAMA Intern Med 2015 ; 175(4) : 531-539.
- Freedman RR : Hot flashes : behavioral treatments, mechanisms, and relation to sleep. Am J Med 2005 ; 118 Suppl 12B : 124-130.
- von Wolff M, Stute P : Endocrinologie gynécologique et médecine de la reproduction : le livre pratique. 1 ed. Schattauer GmbH, Stuttgart 2013.
- Fazio SB : Approche du flushing chez l’adulte. Uptodate 2015.
- Birkhäuser M, et al. : Recommandations actuelles sur le traitement hormonal de la ménopause (THM). Lettre d’expert No 42. Société suisse de gynécologie et d’obstétrique 2015.
- Manson JE, et al : Menopausal hormone therapy and health outcomes during the intervention and extended poststopping phases of the Women’s Health Initiative randomized trials. JAMA 2013 ; 310(13) : 1353-1368.
- Schierbeck LL, et al : Effect of hormone replacement therapy on cardiovascular events in recently postmenopausal women : randomised trial. BMJ 2012 ; 345 : e6409.
- Chen WY, et al : Unopposed estrogen therapy and the risk of invasive breast cancer. Arch Intern Med 2006 ; 166(9) : 1027-1032.
PRATIQUE DU MÉDECIN DE FAMILLE 2016, 11(2) : 14-17