Les troubles thyroïdiens subcliniques sont fréquents. Bien que l’hypothyroïdie latente soit souvent surtraitée, l’inverse peut avoir un impact sur la mortalité.
Les troubles thyroïdiens subcliniques sont fréquents. Environ 13% sont touchés par une hyperthyroïdie subclinique [1], 4-8% dans la population jeune et 15-18% dans la population âgée par une hypothyroïdie subclinique [2]. Quand et comment traiter ?
Les patients hyperthyroïdiens âgés souvent peu symptomatiques
On parle d’hyperthyroïdie latente lorsque le taux de TSH est inférieur à la limite inférieure de la plage de référence et que la T4 et la T3 libres sont normales. Sur le plan étiologique, on peut distinguer les causes exogènes (surtraitement hormonal) et endogènes ; ces dernières comprennent notamment la maladie de Basedow, l’adénome toxique et le goitre nodulaire toxique. Alors que la maladie de Basedow survient principalement chez les jeunes patients (<65 ans) et dans les régions saturées en iode, l’adénome toxique et le goitre nodulaire sont plus fréquents dans les régions déficitaires en iode et chez les personnes âgées [3]. Selon les données de l’étude SHIP, la répartition par sexe est à peu près comparable (m=14% ; f=20%) [1]. Si l’on considère le taux d’orientation des patients hyperthyroïdiens, on constate que les jeunes patients souffrant d'”hyperthyroïdie sévère” sont nettement plus nombreux à être orientés vers des centres spécialisés (jusqu’à 70%), tandis que les patients plus âgés restent sous la responsabilité de leur médecin généraliste en tant que “cas légers” (15-40% d’entre eux sont orientés). Le professeur Matthias Schott, directeur médical du service d’endocrinologie de l’hôpital universitaire de Düsseldorf (D), met toutefois en garde : “Les patients âgés en particulier présentent des symptômes qui sont moins faciles à cerner : perte d’appétit, fatigue, faiblesse et humeur dépressive”.
Les patients atteints d’hyperthyroïdie infraclinique meurent-ils plus tôt ?
Même si les faibles niveaux de TSH sont souvent temporaires, une hyperthyroïdie latente ne doit pas être prise à la légère – car elle peut notamment entraîner des complications cardiovasculaires et squelettiques et avoir un impact sur la mortalité.
“Bien sûr, les patients atteints d’hyperthyroïdie latente ont un risque accru de développer une fibrillation auriculaire”, estime le Pr Schott. Ainsi, deux grandes études prospectives ont montré un risque deux à trois fois plus élevé de développer une fibrillation auriculaire chez les patients hypothyroïdiens âgés. On a également constaté une augmentation de l’incidence de la fibrillation auriculaire chez les patients âgés présentant un faible taux de TSH (0,1-0,5 mlU/l) [4]. Une méta-analyse avec un suivi de 8,8 ans a également montré une incidence significativement plus élevée chez les personnes souffrant d’hyperthyroïdie subclinique et un risque attribuable de 41,5%. Aucune différence n’a été observée en ce qui concerne le sexe, l’âge ou les maladies cardiovasculaires préexistantes [5].
Bien que l’AVC soit considéré comme une complication potentielle de la fibrillation auriculaire en cas d’hyperthyroïdie manifeste [6], cela ne semble pas être le cas en ce qui concerne l’hyperthyroïdie subclinique.
Cependant, les données groupées d’une méta-analyse montrent un lien entre l’hyperthyroïdie subclinique et l’insuffisance cardiaque. Sur la période d’étude de 10,4 ans, le HR pour l’insuffisance cardiaque était significativement plus élevé, en particulier chez les patients présentant une hyperthyroïdie subclinique de type 2 (HR=1,94 ; IC à 95% : 1,01-3,72) [7]. “Les patients souffrant d’hyperthyroïdie latente ont un risque accru d’insuffisance cardiaque, en particulier lorsque la TSH est de <0,1 mU/l”, conclut le professeur Schott.
Il existe également un lien avec les maladies coronariennes : les patients atteints d’hyperthyroïdie latente ont un risque légèrement plus élevé d’événements coronariens (HR=1,21), ajusté en fonction de l’âge et du sexe, bien qu’aucune modification significative du risque n’ait été observée compte tenu du degré d’abaissement de la TSH [5].
Blum et ses collègues ont également confirmé un risque accru d’ostéoporose dans leur méta-analyse de treize études prospectives [8].
Last but not least : les patients souffrant d’hyperthyroïdie infraclinique meurent-ils plus tôt que les personnes euthyroïdiennes ? Collet et ses collègues ont répondu par l’affirmative à cette question. Leur méta-analyse portant sur un total de dix cohortes d’études (n=52 674) a révélé une augmentation, certes faible mais significative, de la mortalité globale [5]. Plus les patients atteints d’hyperthyroïdie latente sont âgés, plus la probabilité de décéder de cette hyperthyroïdie en raison de l’excès de mortalité est élevée. Cela vaut aussi bien pour les hommes que pour les femmes [9]. C’est également la conclusion d’une étude de cohorte danoise plus récente portant sur près de 630 000 patients [10].
Le professeur Schott conclut qu’il existe donc en principe une indication pour le traitement de l’hyperthyroïdie latente. La question cruciale est de savoir comment les traiter.
Quand le patient hyperthyroïdien subclinique bénéficie-t-il d’un traitement ?
En principe, trois options thérapeutiques sont disponibles : la médication, la thérapie à l’iode radioactif et la chirurgie.
Médicaments : alors que l’hyperthyroïdie de libération est bien entendu traitée de manière symptomatique (éventuellement avec des bêtabloquants), l’hyperthyroïdie de formation est traitée de manière thyréostatique. Celle-ci comprend principalement l’administration de faibles doses de thiamazole, de carbimazole ou de propylthiouracile. En raison de leur longue demi-vie, une seule administration quotidienne suffit pour le thiamazole et le carbimazole. Les doses plus élevées doivent être administrées deux à trois fois par jour (tab. 1). Des contrôles doivent être effectués à des intervalles de deux semaines pour le traitement initial et toutes les six à dix semaines pour le traitement continu.

Opération : l’indication est donnée s’il s’agit d’une grosse thyroïde (>50 ml), s’il existe de multiples nodules, en particulier des nodules froids, si le patient souhaite une “guérison” rapide ou si des phénomènes de compression des tissus mous sont démontrés chez ce patient.
Thérapie à l’iode radioactif : une thérapie à l’iode radioactif peut être envisagée en cas de thyroïde de taille normale à modérément hypertrophiée, en cas d’opération préalable de la thyroïde et de contre-indication (relative) à la chirurgie. Il ne doit pas y avoir de suspicion de carcinome.
Le professeur Schott résume : “Si vous avez une suppression maximale de la TSH et que le patient >a 65 ans, le traitement doit être ablatif, généralement à l’aide d’une thérapie à l’iode radioactif, d’une chirurgie en fonction de la taille de la thyroïde et de la présence de nodules. Chez les patients plus jeunes, le traitement doit être envisagé en fonction des symptômes et des comorbidités possibles”. En présence d’une hyperthyroïdie subclinique légère, un traitement doit être envisagé chez les patients >65 ans. Dans ce cas, les patients plus jeunes n’en bénéficient pas (aperçu 1).

“Attention à la croyance dans les chiffres”
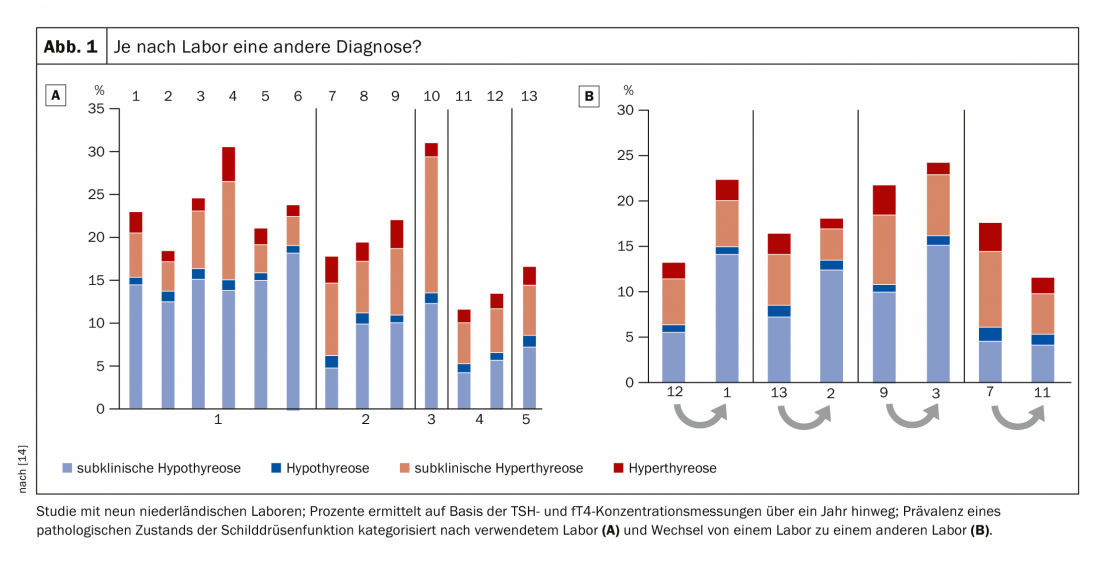
Alors que l’hyperthyroïdie latente a tendance à être sous-estimée, l’hypothyroïdie latente fait l’objet d’une sur-thérapie. Le problème commence avec la valeur normale de la TSH. Depuis des années, la limite supérieure de la norme est discutée, la valeur de coupure de 2,5 mU/l est basée sur un compromis statistique [11]. Et en effet, le cut-off de la TSH pourrait être déplacé vers le haut de 1 à 2 mU/l avant qu’une mesure de la fT4 ne soit nécessaire [12]. Une étude menée sur des centenaires a montré qu’ils avaient des taux de TSH beaucoup plus élevés, mais qu’ils étaient en parfaite santé, du moins en ce qui concerne leur fonction thyroïdienne [13]. Cependant, il existe une tendance à vouloir définir des concentrations absolues de TSH qui servent d’outil de décision pour savoir si un patient doit être surveillé de plus près ou même traité. Le professeur Jörg Bojunga, chef du service d’endocrinologie et de diabétologie et directeur adjoint de l’hôpital universitaire de Francfort-sur-le-Main (D), est critique à ce sujet. Il fait référence non seulement à la construction de la valeur de coupure 2,5 mU/l, mais également aux grandes différences dans l’analyse en laboratoire. Ainsi, une étude s’est penchée sur la question de savoir dans quelle mesure le diagnostic d'”hypothyroïdie subclinique” était, pour ainsi dire, un état “induit par le laboratoire”. Résultat : selon le laboratoire, l’analyse du même échantillon présentait un écart de 6 à 15%. La même chose s’est produite lorsqu’un échantillon a été envoyé du laboratoire 1 au laboratoire 2 pour un nouveau test : Le simple fait de changer de laboratoire doublait ou réduisait de moitié la possibilité pour le patient d’être diagnostiqué avec une hypothyroïdie subclinique (Fig. 1) [14]. Ces résultats jettent le doute sur la fiabilité absolue des mesures de TSH/fT4. “Il s’agit d’une problématique purement de laboratoire. Attention donc à la croyance dans les chiffres”, prévient le professeur Bojunga. “En cas de résultats subcliniques, un contrôle est toujours nécessaire. Il ne faut en aucun cas agir directement”, déclare l’expert en se référant aux données d’assurance selon lesquelles bien plus de 90% reçoivent déjà un traitement après une seule mesure de la TSH.
99 cas sur 100 traités inutilement
Dans de nombreux cas, lorsque la TSH est initialement élevée, la fonction thyroïdienne se normalise sans autre intervention. L’hypothyroïdie subclinique n’évolue vers une hypothyroïdie manifeste que chez 1 à 5 % des patients [15]. “Cela signifie que si vous traitez déjà après la première mesure, vous traitez inutilement 99 cas sur 100”, fait remarquer le professeur Bojunga ; les personnes âgées sont particulièrement exposées au risque d’être surtraitées.
Qu’en est-il maintenant du risque de complications ? Alors que le risque de maladie cardiovasculaire augmente clairement en présence d’une hyperthyroïdie infraclinique, l’hypothyroïdie latente semble avoir un effet globalement positif : La mortalité globale est plutôt plus faible. Si les données concernant l’infarctus du myocarde sont limites, le risque d’insuffisance cardiaque, d’accident vasculaire cérébral, de maladie coronarienne (et d’ailleurs de cancer) n’est pas augmenté jusqu’à une valeur de TSH de 7 [16]. Il faut retenir ces deux valeurs : “Entre TSH 7 et 10, seule l’IRC augmente, l’insuffisance cardiaque n’augmente pas vraiment, et ce n’est qu’à partir d’une TSH de 10 qu’il se passe vraiment quelque chose”. Conclusion amusée du conférencier : “On vit manifestement plus longtemps avec une hypothyroïdie subclinique”. Il n’est pas non plus possible de démontrer un lien entre la dépression et l’hypothyroïdie latente, ni une influence sur la sexualité chez les femmes.
Pas de lévothyroxine chez les patients âgés comorbides !
La question de l’utilité de la lévothyroxine dans le traitement de l’hypothyroïdie subclinique a été examinée dans une étude en double aveugle, randomisée et contrôlée par placebo, publiée en 2017 et menée en parallèle. Celle-ci comprenait 737 patients (âgés de ≥65 ans) souffrant d’hypothyroïdie subclinique persistante. Sur une période d’étude d’un an, aucun bénéfice significatif n’a été observé avec un traitement à la lévothyroxine [17]. Cave : chez les patients présentant des comorbidités, par exemple une maladie coronarienne, la lévothyroxine augmente même la mortalité [18]!
Néanmoins, la lévothyroxine est généralement prescrite lorsque la TSH est comprise entre 4,5 et 10. “En fait, le risque de recevoir des hormones thyroïdiennes par erreur a augmenté au fil des ans. Les deux tiers de ceux qui en ont reçu avaient plus de soixante ans – et ce sont ceux qui ne devraient pas en recevoir”, explique le professeur Bojunga. De plus, ces patients n’avaient reçu qu’une seule mesure de TSH avant le début du traitement.
Si l’on considère le sex-ratio, ce sont surtout les femmes ménopausées qui reçoivent des hormones thyroïdiennes.
Quand traiter ?
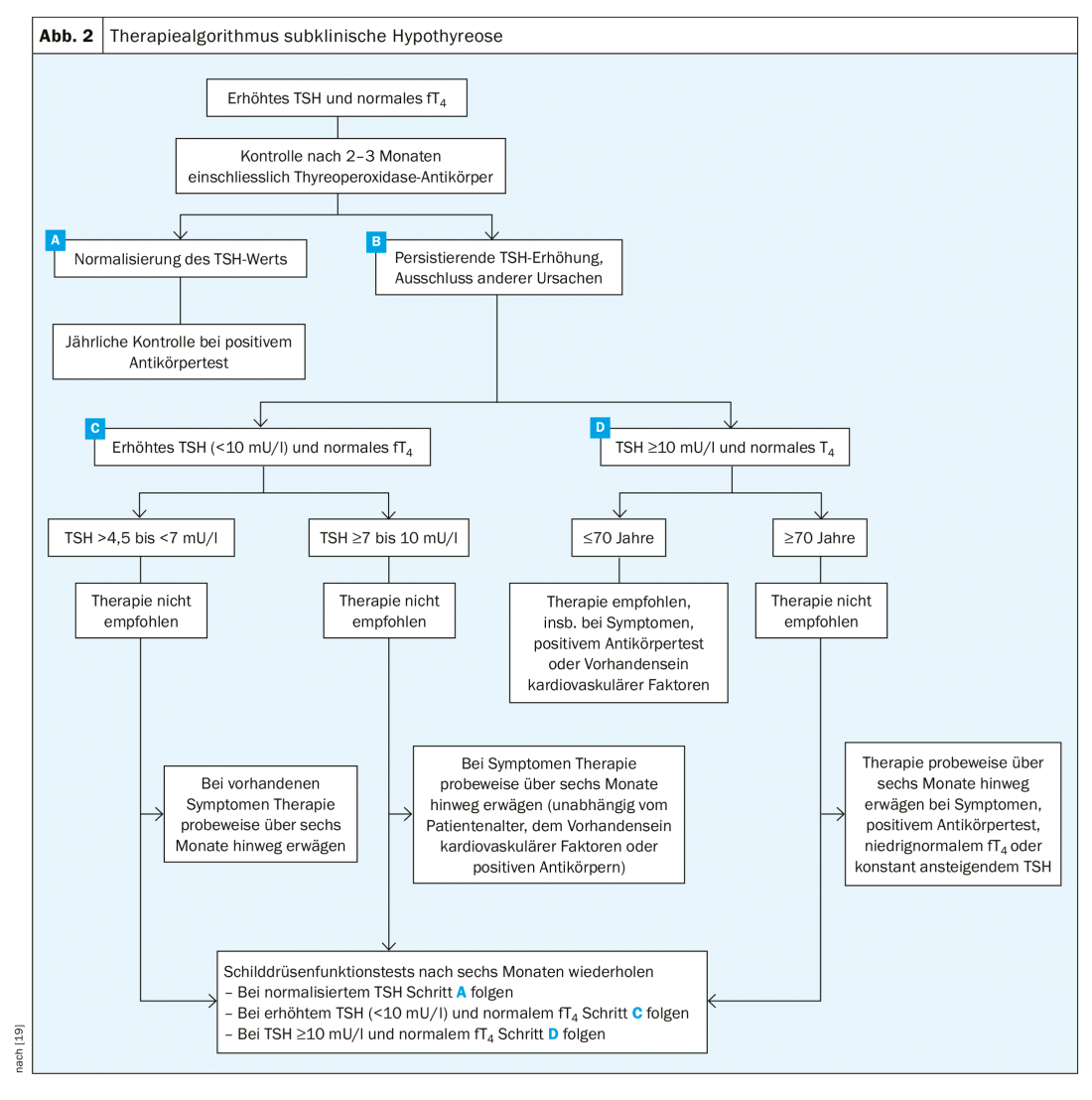
Si les critères d’une hypothyroïdie subclinique sont remplis (TSH élevée, fT4 normale), le patient doit être contrôlé après deux à trois mois. La plupart du temps, la TSH se normalise. En revanche, si elle est encore élevée lors du contrôle, on différencie d’abord <10 mU/l et ≥10 mU/l. L’âge du patient est également pertinent. Si le patient est âgé de moins de 70 ans et a une TSH supérieure à 10 mU/l, l’administration de lévothyroxine est indiquée. Un traitement peut également être envisagé en cas de symptômes graves, d’augmentation de la TSH au fil des ans et de présence d’anticorps. Si un traitement est initié, son évolution doit toujours être contrôlée. Si la TSH est >4,5 à <7 mU/l, un traitement n’est généralement pas indiqué. Un essai de traitement peut être entrepris si le patient présente de graves symptômes d’hypofonctionnement. Pour des valeurs de TSH ≥7 à <10 mU/l, on peut envisager un traitement plus tôt (fig. 2). “Mais dans l’ensemble”, conclut le professeur Bojunga, “il y a peu d’indications. On est devenu plus réticent et c’est justement au niveau des valeurs limites que l’on fait plutôt un contrôle”.
Littérature :
- Völzke H, et al : The prevalence of uniagnosed thyroid disorders in a previously iodine-deficient area. Thyroïde 2003 ; 13(8) :803-810.
- Villar HC, et al : Thyroid hormone replacement for subclinical hypothyroidism. Cochrane database of systematic reviews 2007 : CD003419.
- Biondi B, et al : The 2015 European Thyroid Association Guidelines on Diagnosis and Treatment of Endogenous Subclinical Hyperthyroidism. Eur Thyroid J 2015 ; 4 : 149-163.
- Cappola AR, et al : Thyroid status, cardiovascular risk, and mortality in older adults. JAMA 2006 ; 295(9) : 1033-1041.
- Collet TH, et al : L’hyperthyroïdie subclinique et le risque de maladie cardiaque coronarienne et de mortalité. Arch Intern Med 2012 ; 172(10) : 799-809.
- Biondi B : Mechanisms in endocrinology : Heart failure and thyroid dysfunction. Eur J Endocrinol 2012 ; 167(5) : 609-618.
- Gencer B, et al : Subclinical thyroid dysfunction and the risk of heart failure events : an individual participant data analysis from 6 prospective cohortes. Circulation. 2012 ; 126(9) : 1040-1049.
- Blum MR, et al : Dysfonctionnement thyroïdien subclinique et risque de fractureA Meta-analysis. JAMA 2015 ; 313(20) : 2055-2065.
- Haentjens P, et al : Subclinical thyroid dysfunction and mortality : an estimate of relative and absolute excess all-cause mortality based on time-to-event data from cohort studies. Eur J Endocrinol 2008 ; 159(3) : 329-341.
- Selmer C, et al : Subclinical and overt thyroid dysfunction and risk of all-cause mortality and cardiovascular events : a large population study. J Clin Endocrinol Metab 2014 ; 99(7) : 2372-2382.
- Surks MI, Goswami G, Daniels GH : The Thyrotropin Reference Range Should Remain Unchanged. J Clin Endocrinol Metab 2005 ; 90 : 5489-5496.
- Henze M, et al : Rationalizing Thyroid Function Testing : Which TSH Cutoffs Are Optimal for Testing Free T4 ? J Clin Endocrinol Metab 2017 ; 102 : 4235-4241.
- Atzmon G, et al : L’extrême longévité est associée à une augmentation de la thyrotropine sérique. J Clin Endocrinol Metab 2009 ; 94(4) : 1251-1254.
- Coene KLM, et al : Hypothyroïdie subclinique : une condition “induite par le laboratoire” ? Europ J Endocrinol 2015 ; 173 : 499-505.
- Cooper DS, Biondi B : Maladie thyroïdienne sous-clinique. Lancet. 2012 ; 379(9821) : 1142-1154.
- Floriani C, et al : Subclinical thyroid dysfunction and cardiovascular diseases : 2016 update. Europ Heart J 2017 ; 39 : 503-507.
- Stott DJ, et al : Thyroid Hormone Therapy for Older Adults with Subclinical Hypothyroidism. N Engl J Med 2017 ; 376 : 2534-2544.
- Nygaard Einfeldt M, et al : Résultat à long terme chez les patients atteints d’insuffisance cardiaque traités par la lévothyroxine : An Observational Nationwide Cohort Study. J Clin Endocrinol Metab 2019 ; 104 : 1725-1734.
- Peeters RP : Hypothyroïdie subclinique. N Engl J Med 2017 ; 376 : 2556-2565.
PRATIQUE DU MÉDECIN DE FAMILLE 2019 ; 14(8) : 22-25