Le pronostic du carcinome gastrique avancé reste extrêmement défavorable. De nouvelles approches thérapeutiques sont donc nécessaires de toute urgence. Les connaissances actuelles indiquent que le traitement par inhibiteurs de points de contrôle pourrait prendre une place plus importante dans un avenir proche.
Jusqu’à présent, le traitement par inhibiteur de point de contrôle dans le carcinome gastrique n’est autorisé en Suisse que dans les cas très avancés. Ainsi, l’autorisation de mise sur le marché du nivolumab est limitée au traitement de troisième ligne et celle du pembrolizumab au traitement des tumeurs métastatiques présentant une instabilité élevée des microsatellites (MSI-H) ou une réparation défectueuse des mésappariements de l’ADN (dMMR) sans autres options thérapeutiques [2]. Les résultats de différentes études laissent maintenant espérer une extension prochaine de ces indications.
État des lieux
Jusqu’à présent, le cancer gastrique de stade IV était le domaine de la chimiothérapie (Fig. 1). Celle-ci améliore certes la durée de survie par rapport au traitement de soutien, mais seulement de 6,7 mois environ [3]. Un mois supplémentaire peut être gagné par l’utilisation de combinaisons de chimiothérapie, mais celles-ci entraînent également une toxicité accrue [3]. Les doubles chimiothérapies à base de platine et d’une fluoropyrimidine sont le standard recommandé, l’utilité des triples combinaisons est évaluée de manière controversée [4].
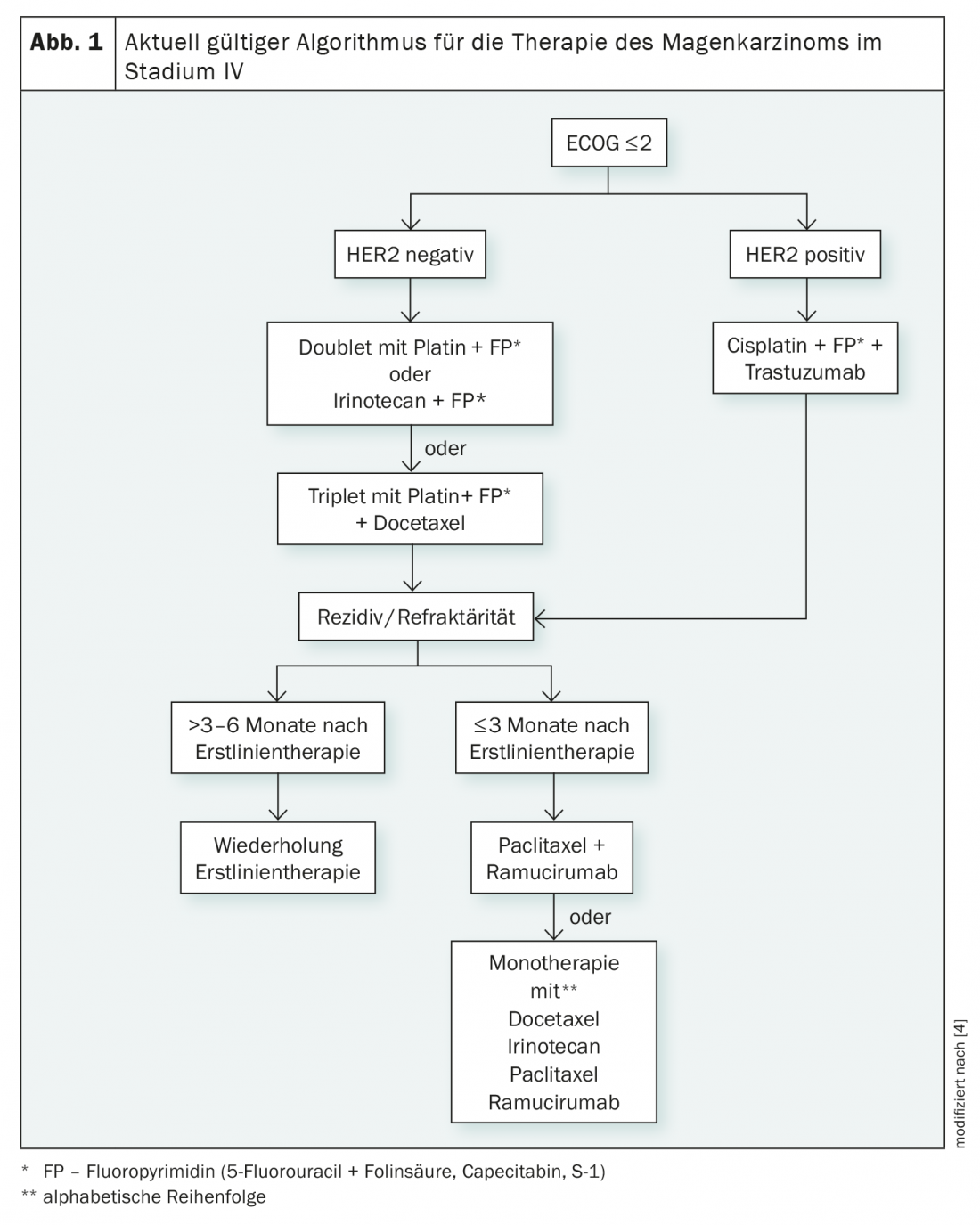
Alors que des thérapies ciblées sont disponibles pour les tumeurs HER2-positives, cette possibilité n’existe pas actuellement pour les cas HER2-négatifs. L’ajout du trastuzumab à la chimiothérapie permet d’augmenter le taux de réponse ainsi que la survie sans progression et la survie globale dans les tumeurs HER2-positives, qui représentent 10 à 15% des cancers gastriques. L’effet est certes démontrable, avec une augmentation de la survie médiane d’un peu plus de deux mois, mais il est faible [5]. Nous sommes donc loin d’une guérison, quel que soit le statut HER2.
En cas d’échec de la chimiothérapie de première ligne avec ou sans trastuzumab, l’anticorps dirigé contre le VEGFR-2 (Vascular Endothelial Growth Factor Receptor 2), le ramucirumab, peut être utilisé. Celui-ci entraîne une prolongation de la survie d’environ 1,5 mois par rapport au placebo [6]. Alternativement, une chimiothérapie est également possible en deuxième ligne. Leurs résultats sont comparables à ceux d’un traitement par ramucirumab. Les meilleurs résultats peuvent être obtenus en combinant le paclitaxel et l’anticorps anti-VEGFR-2 [4].
Il n’existe actuellement aucune ligne directrice claire concernant toutes les autres lignes de traitement. Les traitements envisagés sont le ramucirumab, la chimiothérapie, la trifluridine/tipiracil (TAS-102) et différents inhibiteurs de points de contrôle. Outre l’amélioration des options thérapeutiques pour le traitement de première et deuxième ligne du cancer gastrique de stade IV, il s’agit donc d’établir un standard thérapeutique pour la troisième ligne au cours des prochaines années.
Les inhibiteurs de points de contrôle en option
Les inhibiteurs de points de contrôle pourraient bientôt jouer un rôle important non seulement pour un tel standard de traitement en troisième ligne, mais aussi pour compléter les possibilités dans les phases de traitement antérieures. Diverses études sont actuellement en cours pour tester l’utilisation du nivolumab, du pembrolizumab et autres dans toutes les lignes de traitement (tab. 1). Les résultats indiquent jusqu’à présent que le traitement par les inhibiteurs de points de contrôle n’est pas inférieur à la chimiothérapie. Par exemple, l’étude KEYNOTE-062 a rapporté une efficacité comparable du pembrolizumab, un bloqueur de PD-1, en monothérapie en première ligne, avec une bien meilleure tolérance [7]. Il semble important de prendre en compte différents sous-groupes dans l’analyse de l’efficacité. En cas d’expression élevée de PD-L1, une nette tendance à une survie globale plus longue a été observée sous traitement par pembrolizumab.
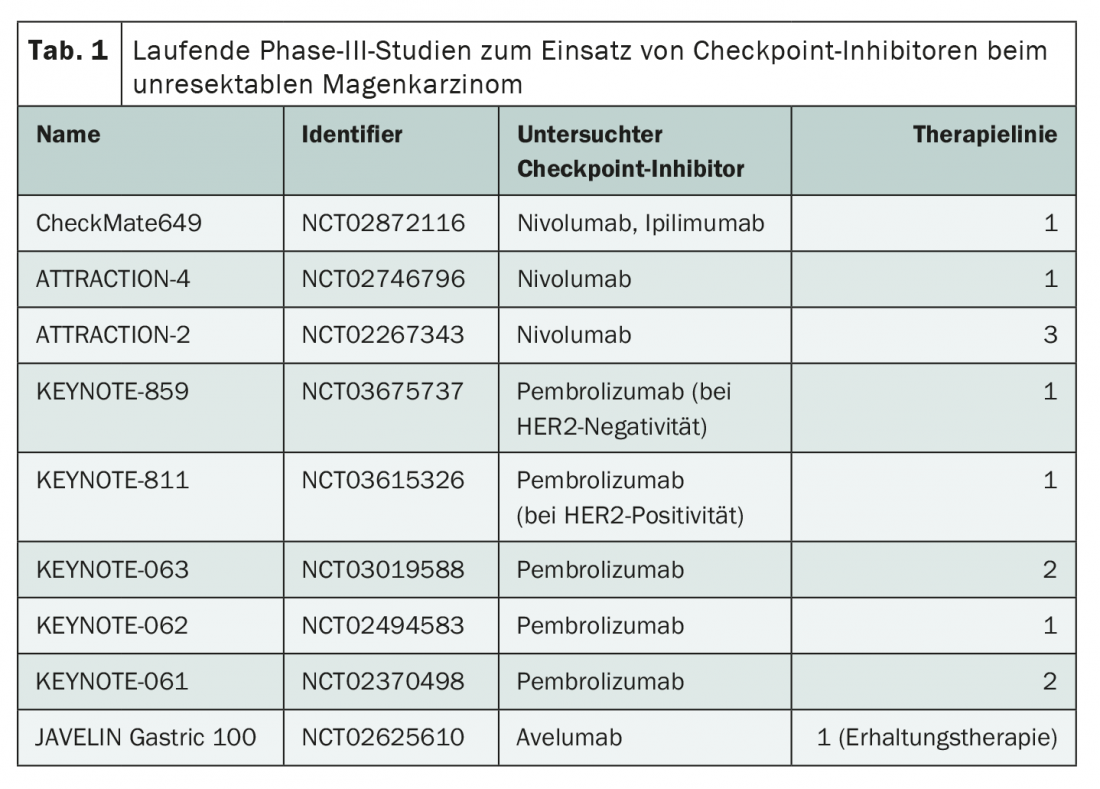
Les résultats de nombreuses autres études sur l’utilisation des inhibiteurs de points de contrôle dans le traitement de première ligne sont attendus, mais des aperçus intéressants ont été donnés lors de différents congrès en 2020. Lors du congrès de l’European Society of Medical Oncology (ESMO), Markus Moehler a présenté les premières données prometteuses de l’étude CheckMate649, qui porte sur 1581 patients [8]. Par rapport à la chimiothérapie seule, l’ajout de nivolumab en cas d’expression de PD-L1 a entraîné une amélioration significative de la survie globale et de la survie sans progression. Un effet plus faible – également significatif – était également présent dans le groupe global.
En outre, les premières conclusions de l’étude ATTRACTION-4 ont été présentées. Cette étude évalue également l’administration supplémentaire de nivolumab en première ligne, mais sur 724 patients exclusivement asiatiques [9]. Narikazu Boku a rapporté une augmentation significative de la survie sans progression et du taux de réponse lorsque le nivolumab est ajouté à la chimiothérapie. Cependant, selon cette première analyse, la survie globale n’a pas été prolongée de manière significative.
Alors que l’ajout d’immunothérapies est généralement étudié en première ligne, le traitement par inhibiteur de point de contrôle seul est également discuté dans les lignes ultérieures. Ainsi, une amélioration significative du pronostic a déjà été observée dans l’étude ATTRACTION-2 grâce à l’utilisation du nivolumab en troisième ligne de traitement. La survie médiane a été augmentée de 4,14 à 5,26 mois [10].
Un regard sur l’avenir
Bien qu’il faille attendre des données à plus long terme, l’utilisation d’immunothérapies dans le cancer gastrique avancé est une option valable. De nombreuses études de grande envergure sont actuellement en cours sur cette approche, dont certains résultats – parfois porteurs d’espoir – sont déjà connus. L’administration d’inhibiteurs de points de contrôle pourrait bientôt devenir une routine dans le traitement de première ligne du carcinome gastrique non résécable, en particulier en cas d’expression de PD-L1 et en complément de la chimiothérapie courante. Dans les lignes de traitement ultérieures, il est également question de l’utilisation exclusive d’agents immunothérapeutiques, dont la supériorité par rapport à l’administration d’un placebo a été démontrée. Dans l’ensemble, la tolérance semble supérieure à celle des chimiothérapies.
L’identification de biomarqueurs appropriés faciliterait la sélection des bons patients pour l’immunothérapie. Ce sujet, qui concerne également de nombreuses pathologies au-delà du cancer de l’estomac, nous accompagnera probablement encore longtemps. Les candidats prometteurs actuels sont l’expression de PD-L1 dans la tumeur et le stroma (score de positivité combiné), l’association du virus Epstein-Barr et l’instabilité des microsatellites [11,12]. Plusieurs études sont également en cours à ce sujet.
De nombreuses questions restent certes en suspens, notamment sur l’application exacte, la sélection idéale des patients et l’efficacité elle-même. Néanmoins, si l’autorisation de mise sur le marché est étendue, l’immunothérapie pourrait bientôt devenir un traitement incontournable du cancer de l’estomac. Les données disponibles à ce jour ne permettent pas d’envisager une percée majeure, mais de petits pas dans la bonne direction sont à portée de main.
Littérature :
- Smyth EC, et al : Gastric cancer : ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annales d’Oncologie. 2016 ; 27 : v38-v49.
- swissmedic Information sur les médicaments. www.swissmedicinfo.ch (dernier accès le 17.01.2021)
- Wagner AD, et al : Chemotherapy for advanced gastric cancer. Cochrane Database Syst Rev. 2017 ; 8 : CD004064.
- Lordick F, et al. : Onkopedia – Carcinome gastrique. www.onkopedia.com/de/onkopedia/guidelines/magenkarzinom (dernier accès le 17.01.2021)
- Bang YJ, et al. : Trastuzumab en association avec la chimiothérapie versus chimiothérapie seule pour le traitement du cancer de la jonction gastrique ou gastro-œsophagienne avancé (ToGA) HER2-positif : un essai contrôlé randomisé de phase 3, en ouvert. Lancet . 2010 ; 376(9742) : 687-697.
- Fuchs CS, et al : Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (REGARD) : an international, randomised, multicentre, placebo-controlled, phase 3 trial. Lancet . 2014 ; 383(9911) : 31-39.
- Shitara K, et al : Efficacité et sécurité du pembrolizumab ou du pembrolizumab plus chimiothérapie contre la chimiothérapie seule pour les patients atteints de cancer gastrique avancé de première ligne : l’essai clinique randomisé KEYNOTE-062 de phase 3. JAMA Oncol. 2020 ; 6(10) : 1571-80.
- Moehler M, et al. : Nivolumab (nivo) plus chimiothérapie (chimio) versus chimio en première ligne (1L) pour le cancer gastrique avancé/le cancer de la jonction gastro-œsophagienne (GC/GEJC)/l’adénocarcinome de l’œsophage (EAC) : Premiers résultats de l’étude CheckMate 649. Annales d’oncologie. 2020 ; 31 : S1142-1215.
- Boku N, et al. : Nivolumab plus chimiothérapie versus chimiothérapie seule chez les patients atteints d’un cancer de la jonction gastrique/gastro-œsophagienne (G/GEJ) avancé ou récurrent non traité auparavant : étude ATTRACTION-4 (ONO-4538-37). Annales d’oncologie. 2020 ; 31 : S1142-1215.
- Chen L-T, et al : A phase 3 study of nivolumab in previously treated advanced gastric or gastroesophageal junction cancer (ATTRACTION-2) : 2 year update data. Gastric cancer : journal officiel de l’Association internationale du cancer gastrique et de l’Association japonaise du cancer gastrique. 2020 ; 23(3) : 510-519.
- Shitara K, et al. : Pembrolizumab versus paclitaxel pour le cancer de la jonction gastrique ou gastro-oesophagienne en phase avancée précédemment traité (KEYNOTE-061) : un essai randomisé, en ouvert, contrôlé, de phase 3. Lancet . 2018 ; 392(10142) : 123-133.
- Kim ST, et al. : Caractérisation moléculaire complète des réponses cliniques à l’inhibition du PD-1 dans le cancer gastrique métastatique. Nat Med. 2018 ; 24(9) : 1449-1458.
- ClinicalTrials.gov. www.clinicaltrials.gov (dernier accès le 17.01.2021)
InFo ONKOLOGIE & HÉMATOLOGIE 2021 ; 9(1) : 18-19