L’hypoxémie se caractérise par une baisse de la pression partielle d’oxygène ou de la teneur en oxygène dans le sang artériel, tandis que l’hypoxie se caractérise par un apport insuffisant d’oxygène aux tissus et aux organes. L’hypoxie tissulaire peut être distinguée en hypoxémique, anémique, stagnante et histotoxique (par exemple, l’empoisonnement au cyanure). L’hypoxémie est généralement définie chez l’adulte pour une pression partielle d’oxygène, PaO2 <60 mmHg et une SaO 2 <90%.
L’hypoxémie se caractérise par une baisse de la pression partielle d’oxygène ou de la teneur en oxygène dans le sang artériel, tandis que l’hypoxie se caractérise par un apport insuffisant d’oxygène aux tissus et aux organes. L’hypoxie tissulaire peut être distinguée en hypoxémique, anémique, stagnante et histotoxique (par exemple, l’empoisonnement au cyanure). L’hypoxémie est habituellement définie chez l’adulte pour une pression partielle d’oxygène, PaO2 <60 mmHg et une SaO2 <90% [1].
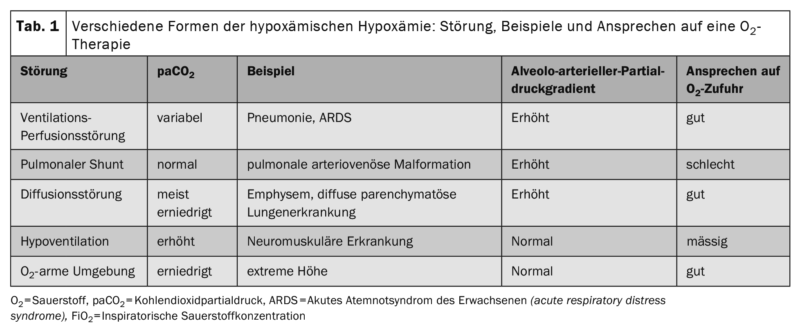
L’oxygénothérapie sert à corriger l’hypoxie hypoxémique, qui se produit lorsque la pression partielle d’oxygène dans le sang est réduite. Cela peut être dû à un séjour en haute altitude, à un shunt droite/gauche, à des inhomogénéités prononcées de ventilation/perfusion dans les poumons, à des troubles de la diffusion ou à une hypoventilation alvéolaire (tableau 1).
L'”insuffisance respiratoire de type 1″, caractérisée par une pression partielle d’oxygène (PaO2) abaissée et une pression partielle de dioxyde de carbone (PaCO2) normale ou abaissée, est due à une hypoxie hypoxémique au sens d’une insuffisance respiratoire hypoxémique. On parle d’insuffisance respiratoire hypercapnique (type 2 de l’insuffisance respiratoire) lorsque la paCO2 est ≥45 mmHg, avec éventuellement des valeurs de SaO2 et de pO2 consécutivement abaissées.
Important : les causes sous-jacentes de l’hypoxémie doivent être identifiées et traitées. L’oxygène doit être administré pour traiter l’hypoxémie et non l’insuffisance respiratoire.
Pour la pratique
- En plus de l’oxygénothérapie, des mesures générales telles que le positionnement pour améliorer l’oxygénation sont utiles en cas d’hypoxémie aiguë. Chez certains patients, la position verticale du haut du corps peut améliorer l’oxygénation. Chez les personnes souffrant d’obésité morbide (IMC >50 kg/m2), une insuffisance respiratoire aiguë a été décrite en cas de position à plat [2].
- Il n’existe pas d’ECR pour un effet positif de la position ventrale chez les patients hypoxémiques éveillés et respirant spontanément. Jusqu’à la rédaction de cette ligne directrice, il existait des séries de cas isolés pour les patients COVID-19 qui décrivaient un effet positif (“self-proning”).
- Pour traiter et prévenir le syndrome de compression de la veine cave, les femmes enceintes souffrant d’hypoxémie doivent être placées sur le côté gauche.
- En cas de détresse respiratoire sans hypoxémie, les soins palliatifs font d’abord appel à des mesures non médicamenteuses : exercices de relaxation, refroidissement du visage, courant d’air à l’aide d’un ventilateur manuel et aide à la marche.
- L’utilisation d’opioïdes en cas de détresse respiratoire a été bien étudiée et constitue une mesure médicamenteuse dont l’efficacité a été démontrée en cas de détresse respiratoire sans hypoxémie.
Oxygénothérapie
L’oxygène est un médicament et ne doit être prescrit que s’il est indiqué. Il n’existe pas encore de données précises sur la fréquence d’utilisation de l’oxygène dans les services d’urgence et de soins aigus en Allemagne [3]. De nombreuses études randomisées contrôlées et des revues systématiques ont été publiées à ce jour sur les domaines ciblés par l’oxygénothérapie. La plupart des études randomisées ont comparé la normoxémie aux zones cibles normales d’oxygène (hypoxémie). Il n’existe pas d’études randomisées sur les études d’hypoxémie permissive Me chez l’adulte, de sorte qu’il n’est pas possible de déterminer clairement à partir de quel seuil d’hypoxie l’oxygénothérapie est cliniquement utile. En Allemagne, en l’absence de lignes directrices, l’oxygène est utilisé jusqu’à présent de manière plutôt non critique en médecine aiguë, par exemple chez les patients présentant une détresse respiratoire sans présence d’hypoxémie. Alors qu’il existe déjà depuis de nombreuses années un guide S3 sur l’oxygénothérapie de longue durée, un guide S3 en langue allemande sur l’oxygène en situation aiguë chez l’adulte a été publié pour la première fois cette année [4].
Évaluation clinique de l’hypoxémie
Lors de l’évaluation des patients en détresse respiratoire, il convient de déterminer, outre la saturation en oxygène, la fréquence respiratoire, la fréquence du pouls, la pression artérielle, la température et l’état de conscience.
L’examen clinique du patient en état critique doit notamment s’inspirer de l'”ABC” de la médecine d’urgence (A pour les voies respiratoires [airway], B pour la ventilation [breathing], C pour la circulation [circulation]) [5]. Les variables physiologiques suivantes doivent être recueillies lors de l’évaluation initiale des patients souffrant d’insuffisance respiratoire et dans le cadre de l’observation ultérieure des patients sous oxygène :
- Saturation en oxygène
- Fréquence respiratoire
- état de conscience (par exemple, classé comme ACVPU : alert, confused, verbal responsive, pain responsive, unresponsive)
- Pression artérielle systolique
- Température
- Fréquence cardiaque
Ces systèmes dits “track and trigger” sont des scores de points de signes vitaux qui servent de système d’alerte précoce pour signaler des changements naissants ou pertinents. Un exemple est le National Early warning score (NEWS2) [6]. Dans le système NEWS2, des points sont attribués aux 6 signes vitaux susmentionnés, auxquels s’ajoute la présence d’une oxygénothérapie. Le score total de NEWS2 peut varier entre 0 et 20 points, les patients cliniquement stables étant définis par un score inférieur à 5. Outre l’évaluation de la stabilité des patients, les systèmes de suivi et de déclenchement n’ont pas montré de supériorité sur les critères cliniques pertinents pour les patients dans les revues systématiques.
Important : l’oxymétrie de pouls doit être disponible dans toutes les situations cliniques où l’oxygène est utilisé à des fins médicales et doit être utilisée régulièrement pour surveiller l’oxygénothérapie.
Pour la pratique : en pratique clinique quotidienne, lors d’analyses des gaz du sang artériels ou capillaires, il est utile de relever la saturation pulsoxymétrique au moment du prélèvement, parallèlement à la saturation artérielle. En cas d’écarts importants entre la SpO2 et la SaO2, il est recommandé de procéder à un contrôle de plausibilité. Si la saturation en oxygène d’un patient est inférieure à la plage cible prescrite, il faut d’abord vérifier que le système d’oxygène et l’oxymétrie de pouls ne présentent pas d’erreurs (par exemple, signal du capteur). Pour évaluer l’oxymétrie de pouls, il est utile d’utiliser des appareils avec représentation de la courbe de pouls (pléthysmographie) ou affichage de la qualité du signal. La détermination de la SpO2 est utile de manière répétitive chez tous les patients sous traitement par O2. Chez les patients présentant des facteurs de risque, une surveillance pulsoxymétrique continue peut également être indiquée. L’oxymétrie de pouls peut surestimer la saturation en oxygène chez les patients en raison de l’influence de la couleur de peau foncée ou en cas de crise drépanocytaire. Le seuil de déclenchement pour la réalisation d’analyses des gaz du sang doit être plus bas chez les patients à la peau foncée. Une formation du personnel médical sur l’interprétation et les limites de l’oxymétrie de pouls est utile. En combinaison avec d’autres signes vitaux (en particulier la fréquence respiratoire), l’oxymétrie de pouls fournit une évaluation pronostique importante, en particulier chez les patients hospitalisés (par exemple, le score NEWS2) et sous oxygénothérapie (par exemple, l’indice ROX).
Les analyses des gaz du sang pour le suivi d’une oxygénothérapie doivent être effectuées dans des conditions d’hospitalisation chez les groupes de patients suivants :
- les patients en état critique, par exemple en état de choc ou souffrant de troubles métaboliques
- patients ventilés
- Patients présentant une hypoxémie sévère (plus de 6 l O2/min, ou FiO2 supérieure à 0,4)
- Patients présentant un risque d’hypercapnie (par ex. BPCO, asthme sévère, obésité avec IMC >40 kg/m2)
- Patients sans signal d’oxymétrie de pouls fiable
Pour les patients stables en dehors des indications mentionnées, les gaz du sang ne doivent pas être déterminés en routine.
Important :
- Il n’est pas nécessaire d’effectuer des analyses de gaz du sang de routine chez les patients stables, sans maladie critique et sans risque d’hypercapnie. Ceci est valable tant qu’un débit d’oxygène de 6 l/min (ou FiO2 >0,4) n’est pas dépassée.
- Chez les patients présentant un risque d’hypercapnie, les analyses des gaz du sang artériel ou artérialisé sont indiquées dans les conditions d’hospitalisation.
- Les analyses des gaz du sang à partir de sang capillaire artérialisé prélevé au lobe de l’oreille peuvent être utilisées en milieu hospitalier pour évaluer les patients en dehors des unités de soins intensifs.
Conseil pratique
Un standard pour la détermination des gaz du sang capillaires est recommandé. Pour préparer les analyses des gaz du sang par voie capillaire, il faut au moins 5 minutes de débit d’O2 constant, au moins 10 minutes d’hyperémie et au moins 15 minutes de repos physique [7].
Les analyses capillaires des gaz du sang et l’oxymétrie de pouls peuvent toutes deux sous-estimer la saturation artérielle en oxygène. Si la SpO2 et la SaO2 sont mesurées en même temps, l’oxygénothérapie doit être basée sur la valeur la plus élevée des deux ou une analyse des gaz du sang artériel doit être effectuée.
Les analyses des gaz du sang par voie veineuse ne doivent pas être utilisées pour le suivi de l’oxygénothérapie. Les analyses des gaz du sang par voie veineuse ne peuvent exclure une hypercapnie que si la pvCO2 <est de 45 mmHg.
Prescription d’oxygène
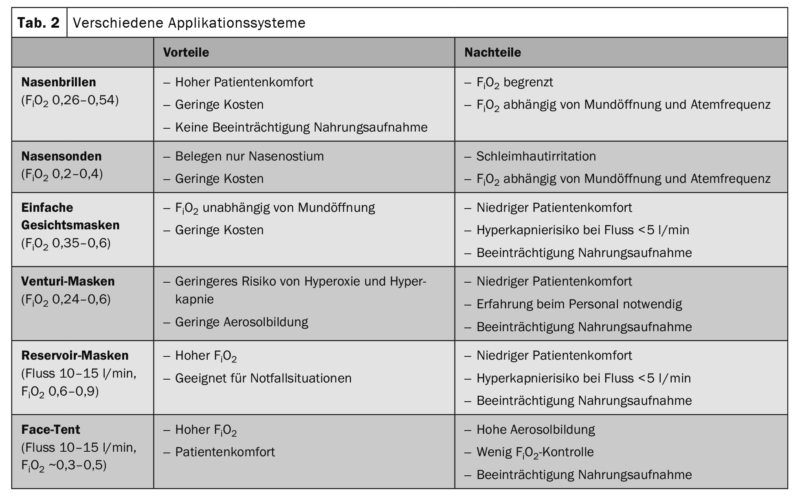
L’oxygène doit être utilisé, surveillé et contrôlé par un personnel formé à l’oxygénothérapie. Les patients doivent être informés sur l’oxygénothérapie. Les lunettes nasales doivent être utilisées en priorité lorsque le débit d’O2 est faible (c.-à-d. <6 l/min), ou bien des masques Venturi à faible débit d’oxygène. Les lunettes/sondes nasales et les masques Venturi sont préférables pour l’application d’oxygène dans les soins aigus. Lors de l’utilisation de masques Venturi, les débits minimaux d’O2 doivent être respectés conformément aux informations du fabricant. Ne pas utiliser de masque facial simple ou de masque à réservoir en cas de risque d’hypercapnie et lorsque le débit d’oxygène est inférieur à 5 l/min.
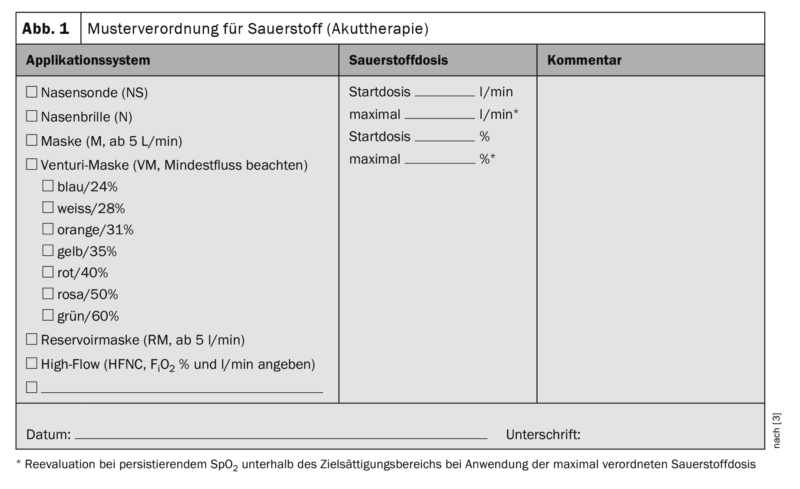
L’oxygène doit être prescrit par un médecin pour chaque patient hospitalisé, en indiquant une plage cible de saturation en oxygène (tableau 2). Lors de la prescription du système d’administration (sonde/lunettes nasales, masque, masque Venturi, masque à réservoir, haut débit, etc.), il convient de tenir compte des besoins en O2, du schéma respiratoire, c’est-à-dire de la fréquence et de la profondeur de la respiration, de l’ouverture de la bouche et du risque d’hypercapnie [8]. Un traitement par oxygène doit être prescrit par un médecin. Il est utile que la prescription mentionne le mode d’administration, la quantité d’oxygène, les zones cibles de saturation et les intervalles de surveillance (figure 1). Dans une situation d’urgence, l’oxygène devrait être administré sans prescription formelle et être ensuite documenté par écrit. Toute prescription d’oxygène doit faire l’objet d’une réévaluation par des médecins ou un personnel spécialement formé. Sous oxygénothérapie, un contrôle des signes vitaux est indiqué au moins toutes les 6 heures. Pour des débits supérieurs à 6 l/min et sous oxygène à haut débit (HFNC), il est recommandé de surveiller en permanence la SpO2, le pouls et la fréquence respiratoire, ainsi que de contrôler étroitement les autres signes vitaux (état de conscience, pression artérielle, température corporelle).
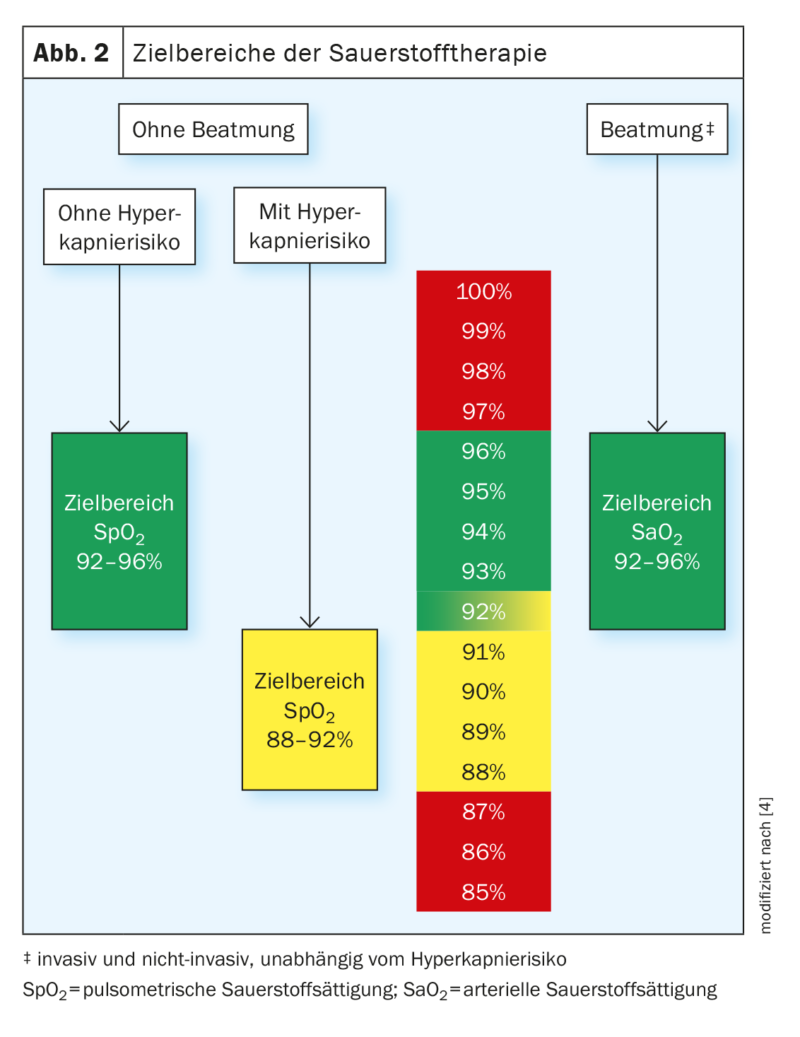
Oxygénothérapie Zone cible
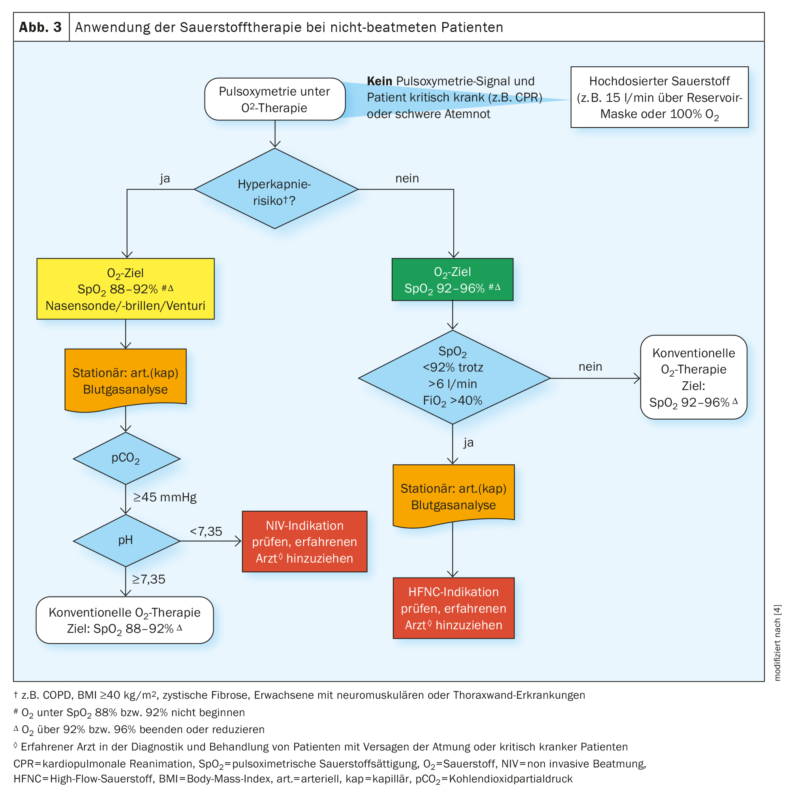
La plage cible de l’oxygénothérapie aiguë pour les patients non ventilés et sans risque d’hypercapnie doit se situer entre 92% et 96% de saturation pulsoxymétrique (figures 2 et 3). Dans le cas d’une saturation en oxygène inférieure à 92%, il est judicieux de commencer ou d’augmenter l’oxygénothérapie chez les patients sans risque d’hypercapnie. Au-delà d’une saturation de 96%, l’arrêt ou la réduction de l’oxygénothérapie est indiqué chez ces patients. Les valeurs cibles de saturation en oxygène mentionnées sont valables au repos. Chez les personnes souffrant de maladies aiguës, des valeurs inférieures à la plage cible peuvent être tolérées pendant une courte période lors d’un effort ou d’une toux, à condition que la saturation en oxygène revienne rapidement à la plage cible après l’événement (en général en moins d’une minute). Pour tous les patients sous oxygénothérapie, il est utile de disposer de cartes d’oxygène pour marquer la zone cible de SpO2 au lit du patient.
L’oxygénothérapie pour les patients en phase aiguë non ventilés présentant un risque d’hypercapnie (par ex. BPCO) doit être effectuée avec une saturation pulsoxymétrique cible de 88-92%. Dans cette situation, l’oxygénothérapie ne doit pas être effectuée ou doit être réduite si la saturation est supérieure à 92% et ne doit être commencée que si elle est inférieure à 88%.
Chez les patients ventilés, il faut viser une saturation artérielle en oxygène de 92% à 96%. Outre les mesures des gaz du sang artériel, la mesure de la saturation en oxygène par oxymètre de pouls doit être utilisée pour contrôler l’apport d’oxygène si la concordance est acceptable (écart inférieur ou égal à 2%) et dans le domaine préclinique.
Les patients qui n’atteignent pas une SpO2 de 92% malgré des débits supérieurs à 6 litres d’oxygène par minute doivent être évalués immédiatement par un médecin expérimenté dans le diagnostic et le traitement de patients souffrant d’insuffisance respiratoire aiguë ou de patients en état critique.
Conseil pratique
La VNI est une option thérapeutique importante dans le traitement aigu des patients BPCO en exacerbation hypercapnique et hypoxémique prononcée. En cas d’œdème pulmonaire cardiaque avec hypoxémie sévère (FiO2 >0,4 ou >6 l/min) sous oxygénothérapie conventionnelle, la VNI, la PPC et l’HFNC sont des alternatives thérapeutiques raisonnables. L’HFNC ne semble pas être inférieure à la VNI en cas d’hypercapnie modérée.
Oxygénothérapie pour des groupes de patients particuliers
Monoxyde de carbone : En cas d’intoxication au monoxyde de carbone, une administration d’oxygène à 100% ou une ventilation avec 100% d’O2 doit être effectuée immédiatement et pendant une durée maximale de 6 heures, indépendamment de la saturation en oxygène (SpO2). En cas d’intoxication grave au monoxyde de carbone (par exemple, avec une perte de conscience persistante), une oxygénothérapie hyperbare peut être administrée. Une analyse des gaz du sang est utile pour évaluer une intoxication au monoxyde de carbone et déterminer le monoxyde de carbone lié à l’hémoglobine (CO-Hb). Pour cela, il importe peu que cet échantillon de sang soit veineux, artériel ou capillaire. En cas d’intoxication au monoxyde de carbone, un traitement immédiat par de fortes doses d’oxygène est utile, quel que soit le niveau de saturation en oxygène, pendant une durée pouvant aller jusqu’à 6 heures. 80 Retour à la table des matières L’O2 à haute dose peut également être administré par VNI/CPAP, au masque, ou par HFNC, et pas seulement par le tube. A l’exception de l’intoxication au monoxyde de carbone, les plages cibles habituelles de saturation en oxygène (92 à 96% ou 88 à 92% en cas de risque d’hypercapnie) sont utiles pour les autres intoxications sous application d’oxygène [3].
Phase préhospitalière : en phase préhospitalière, l’oxygène doit être administré avec une plage cible de SpO2 de 92 à 96% (ou de 88 à 92% pour les patients présentant un risque d’hypercapnie). Ce n’est que si, en dehors de l’hôpital, une saturation en O2 ne peut pas être déduite de manière fiable par oxymétrie de pouls et que le patient est dans un état critique (par exemple en cas de réanimation) que l’oxygène doit être administré à haute dose (100% ou 15 l/min).
Si le signal de la mesure de la SpO2 n’est pas fiable ou n’est pas disponible, l’oxygène doit être administré comme si aucun oxymètre de pouls n’était disponible. Avant d’administrer de l’oxygène, l’oxymétrie de pouls est également utile pour l’évaluation dans le domaine pré-hospitalier, à l’exception de situations critiques (par ex. lors d’une réanimation). La nébulisation de médicaments avec de l’oxygène comme gaz propulseur en phase préhospitalière doit être évitée ou limitée dans le temps chez les patients présentant un risque d’hypercapnie (C3). Il est recommandé de disposer des dispositifs d’administration d’O2 suivants dans l’environnement préhospitalier : Masque réservoir d’O2 (pour l’oxygénothérapie à haute concentration) ; lunettes nasales, masques Venturi et, le cas échéant, systèmes d’administration d’O2 pour les patients ayant subi une trachéotomie ou une laryngectomie. Un oxymètre de pouls portable pour l’évaluation de l’hypoxémie et la première estimation est indispensable dans le domaine préhospitalier et une source d’oxygène portable est une partie utile de l’équipement d’urgence pour les patients en état critique ou ceux qui ont des difficultés à respirer. Dans le domaine préhospitalier, il n’y a généralement pas de possibilité d’analyse des gaz du sang, l’identification clinique des patients à risque d’hypercapnie est donc importante.
Réanimation cardio-pulmonaire : pendant la réanimation cardio-pulmonaire, le débit d’oxygène le plus élevé possible doit être utilisé. Lorsque la circulation spontanée reprend et que la saturation en oxygène peut être surveillée de manière fiable, il convient de viser une plage de saturation cible de 92 à 96%.
Lors de la ventilation dans le cadre de la réanimation cardio-pulmonaire, une FiO2 de 1,0 doit être utilisée.
Patients infectieux : L’oxygénothérapie des patients adultes atteints de maladies infectieuses transmissibles par aérosols (par ex. SRAS-CoV-2) doit suivre les mêmes principes et les mêmes zones cibles que pour les autres patients souffrant d’hypoxémie.
Céphalées en grappe : chez les patients souffrant de céphalées en grappe, l’oxygène doit être administré à un débit d’au moins 12 l/min pendant au moins 15 minutes via un masque à réservoir.
Procédures de sédation avec respiration spontanée : pour toutes les procédures avec sédation visant à maintenir la respiration spontanée, la saturation en oxygène doit être surveillée en continu par oxymètre de pouls avant et pendant l’intervention et pendant la phase de réveil. Pour toutes les procédures avec sédation et dans le but de préserver la respiration spontanée, la présence d’une hypoxémie (SpO2 <92% ou 88% en cas de risque d’insuffisance respiratoire hypercapnique) doit être vérifiée et de l’oxygène doit être administré dans le cadre d’une approche multimodale.
Conseil pratique
Pour détecter les hypoxémies fréquentes, une surveillance pulsoxymétrique continue est utile pour toutes les procédures avec sédation. En cas d’hypoxémie sous sédation, une hypoventilation en est souvent la cause. L’oxygénothérapie dans les procédures avec sédation a les mêmes plages cibles (SpO2 92 à 96% ou 88 à 92% pour les patients présentant un risque d’hypercapnie) que pour les autres maladies. La seule administration d’oxygène est souvent insuffisamment efficace en cas d’hypoxémie sous sédation et des mesures supplémentaires sont utiles pour remédier à l’hypoventilation.
Oxygénothérapie à haut débit : chez les patients hospitalisés présentant une insuffisance respiratoire aiguë hypoxique sans hypercapnie, une oxygénothérapie par oxygène à haut débit doit être initiée à 6 l d’O2/min via des lunettes/masque nasal et une saturation en oxygène de <92%. Les patients sous oxygénothérapie à haut débit doivent être réévalués de manière étroite et des critères d’arrêt de l’HFNC doivent être définis.
Résumé
L’oxygène est un médicament et ne doit être prescrit par un médecin que si cela est indiqué. Une oxygénothérapie doit être documentée par écrit, surveillée et réévaluée régulièrement. Les plages cibles de saturation en oxygène dépendent du risque d’hypercapnie et de l’état de la ventilation. Plus d’un quart des patients hospitalisés en soins aigus et souffrant d’hypoxémie présentent simultanément une hypercapnie lors de l’analyse des gaz du sang. La plage cible d’oxygène doit être définie pour chaque patient atteint d’une maladie aiguë. Pour les patients respirant spontanément sans risque d’hypercancémie, la plage cible est de 92 à 96% de SpO2 (saturation mesurée en périphérie). Pour les patients présentant un risque d’hypercapnie, la plage cible de SpO2 se situe entre 88 et 92%. Pour les patients sous respiration artificielle, une saturation artérielle en oxygène comprise entre 92 et 96% est recommandée. Les plages cibles s’appliquent, à quelques exceptions près (intoxication au CO, réanimation, céphalées en grappe), à tous les patients adultes sous oxygénothérapie pour hypoxémie aiguë et ne diffèrent pas entre les différents diagnostics.
La nouvelle ligne directrice S3 “Oxygénothérapie en cas d’hypoxémie aiguë chez l’adulte” est la première ligne directrice en langue allemande sur ce sujet. La ligne directrice donne un aperçu des systèmes d’administration d’oxygène existants et contient des recommandations pour le choix basées sur la sécurité et le confort du patient. L’oxygène à haut débit est proposé aux patients qui ont besoin de plus de 6 l d’O2 par minute pour atteindre la zone cible. Les patients sous oxygène à haut débit doivent alors être surveillés en permanence.
L’oxygénothérapie à court terme et à faible dose ne nécessite pas d’humidification. Lors de l’arrêt de l’oxygénothérapie, le risque d’hypercapnie joue un rôle en raison d’une éventuelle hypoxémie de rebond. Une réévaluation dans les semaines suivant la sortie est recommandée pour les patients qui ne peuvent pas être sevrés de l’oxygène dans le cadre d’une hospitalisation et pour lesquels une prescription d’O2 à domicile est effectuée. Dans ce cas, il convient de vérifier si l’indication d’une oxygénothérapie de longue durée persiste.
Messages Take-Home
- L’oxygène doit être prescrit par un médecin pour chaque patient hospitalisé, avec indication d’une plage cible de saturation en oxygène.
- L’oxygénothérapie doit être documentée par écrit.
- Pour les patients stables et sans facteurs de risque, les gaz du sang ne doivent pas être déterminés en routine.
- La zone cible de l’oxygénothérapie aiguë pour les patients non ventilés sans risque d’hypercapnie doit être une saturation pulsoxymétrique
se situent entre 92% et 96%. - Chez les patients présentant un risque d’hypercapnie, une plage cible plus basse de
88-92% de la saturation en oxygène sous traitement O2 médicalement utile.
Littérature :
- Holmberg MJ, Nicholson T, Nolan JP, et al : Oxygenation and ventilation targets after cardiac arrest : A systematic review and meta-analysis. Resuscitation 2020 ; 152 : 107-115.
- Rudolf M, Turner JA, Harrison BD, et al. : Changes in arterial blood gases during and after a period of oxygen breathing in patients with chronic hypercapnic respiratory failure and in patients with asthma. Clin Sci (Lond) 1979 ; 57(5) : 389-396.
- Joean O, Klooster MPV, Kayser MZ, et al : A cross-sectional study in three German hospitals regarding oxygen therapy characteristics. J Pneumologie 2022 ; 76(10) : 697-704.
- Gottlieb J, Capetian P, Fühner T, et al : S3 Leitlinie : Sauerstoff in der Akuttherapie beim Erwachsenen. Numéro de registre AWMF 020-021 ; www.awmf.org/uploads/tx_szleitlinien/020-021l_S3_Sauerstoff-in-der-Akuttherapie-beim-Erwachsenen_2021-06.pdf (dernier accès : 12.07.2023).
- Cranston JM, Crockett A, Currow D : Oxygen therapy for dyspnoea in adults. Cochrane Database Syst Rev 2008 ; 3 : CD004769.
- Physicians RCo. National Early Warning Score (NEWS) 2 : Standardisation de l’évaluation de la sévérité des crises aiguës dans le NHS. Rapport de mise à jour d’un groupe de travail : RCP, Londres ; 2017.
- Directives relatives à la transplantation d’organes conformément à l’art. § 16 TPG : Bundesärztekammer ; 2017 (Disponible à partir de : www.bundesaerztekammer.de/fileadmin/user_upload/downloads/pdf-Ordner/RL/RiliOrgaWlOvLungeTx-ab20171107.pdf ; dernier accès : 12.07.2023)
- O’Reilly Nugent A, Kelly PT, Stanton J, et al. : Measurement of oxygen concentration delivered via nasal cannulae by tracheal sampling. Respirology 2014 ; 19(4) : 538-543.
PRATIQUE DU MÉDECIN DE FAMILLE 2023 ; 18(8) : 7-13