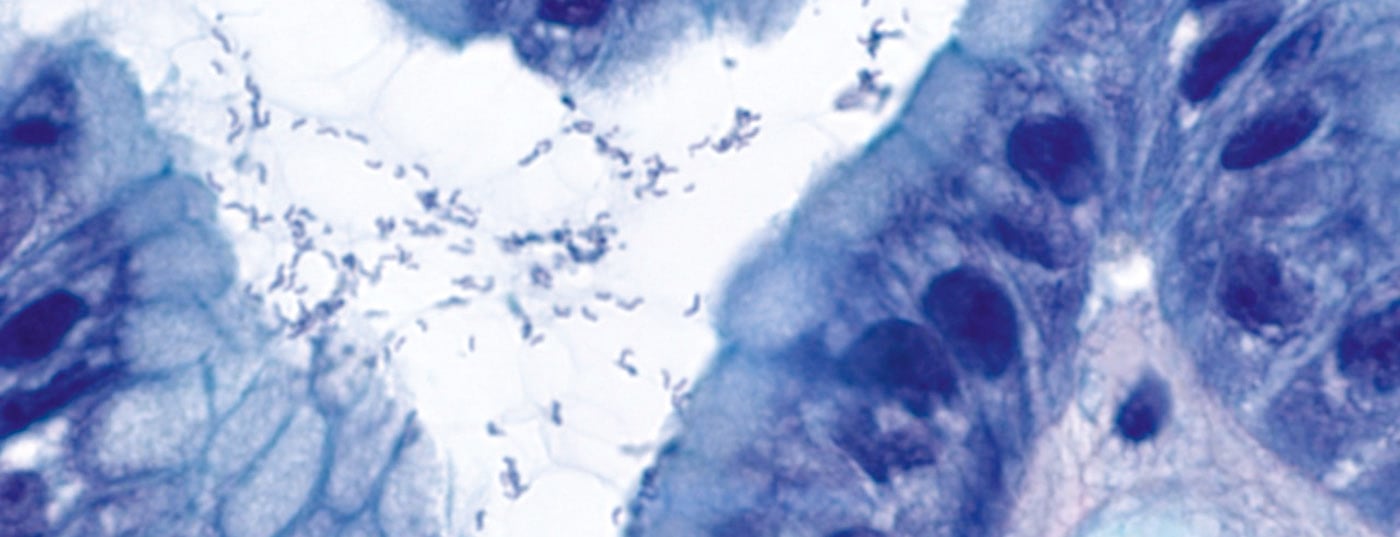
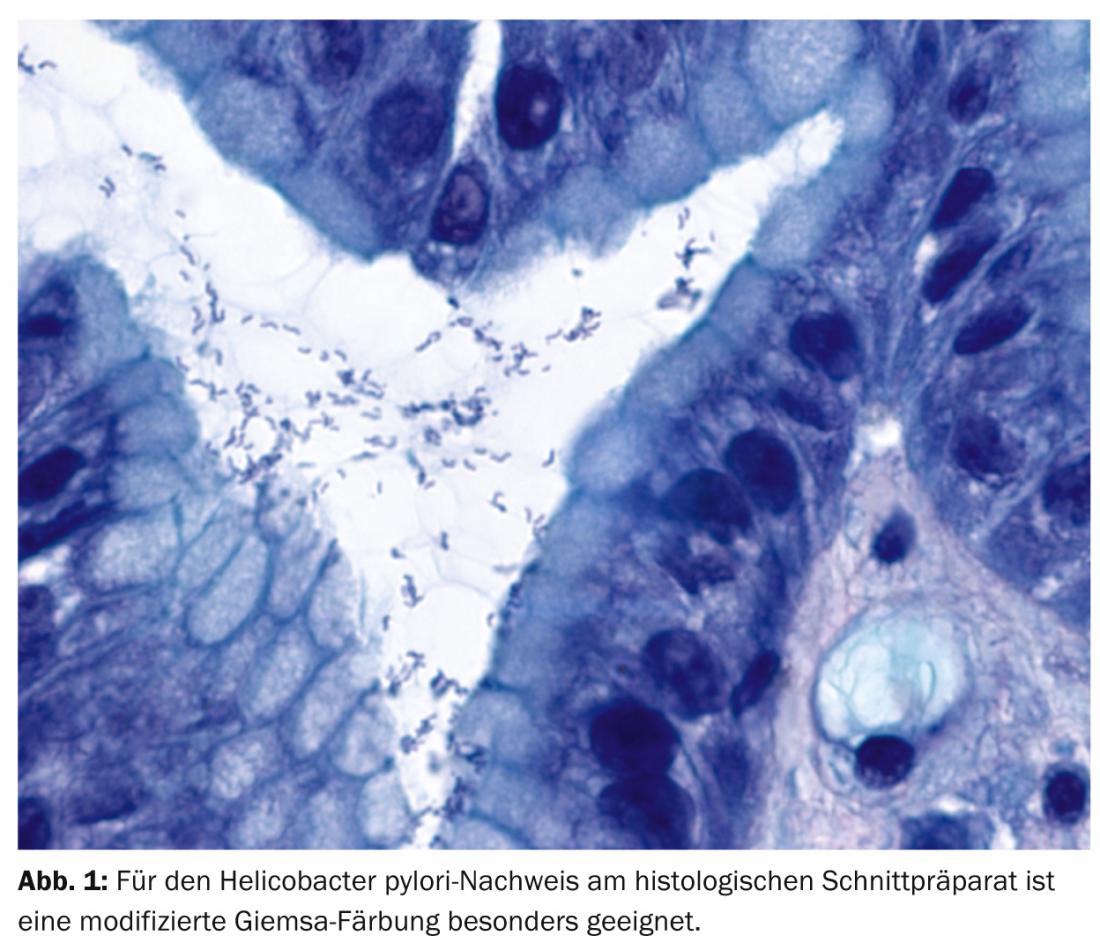
Les lymphomes du MALT affectent le plus souvent l’estomac. Il existe une forte association avec une gastrite à Helicobacter pylori (Hp) (plus de 90% des patients). Une antibiothérapie adéquate permet d’éradiquer Hp, ce qui entraîne une rémission complète chez près de 80% des patients atteints d’un lymphome MALT au stade précoce. Le diagnostic du lymphome du MALT relève en grande partie du domaine de l’évaluation morphologique par le pathologiste. La translocation spécifique t(11;18)(q21;q21) revêt ici une importance conceptuelle, physiopathologique, pronostique, prédictive et, de plus en plus, thérapeutique.
Le tissu lymphatique associé à la muqueuse (MALT) est, en plus du tissu lymphatique somatique nodal, un deuxième compartiment qui se comporte biologiquement de manière différente. L’importance conceptuelle et une meilleure compréhension des lymphomes d’origine extranodale par rapport à leurs équivalents nodaux trouvent leur origine dans le travail d’Isaacson et Wright il y a 30 ans avec la première description du lymphome MALT (MALTL) dans l’estomac, les poumons, la glande salivaire et la thyroïde [1]. La reconnaissance de fréquences variables d’aberrations génétiques dans les MALTL de différentes provenances donne une importance croissante à la spécificité d’organe. L’estomac reste cependant l’organe le plus fréquemment touché par le MALTL, parmi de nombreux autres.
Le concept d’infection
En toute rigueur, le développement du concept de MALT commence en fait encore 20 ans plus tôt avec la description du “lymphome méditerranéen” dans l’intestin grêle, caractérisé par une malabsorption et la formation d’immunoglobulines (Ig) abortives, composées de chaînes lourdes α défectueuses sans chaînes légères, pour lesquelles le terme “α-chain disease” a été inventé [2].
Dans le cas du lymphome connu plus tard sous le nom de “maladie immunoproliférative des petits intestins” (IPSID), les stades précoces pouvaient être mis en rémission sous antibiothérapie, ce qui a donné naissance à l’idée de tumeur sensible aux antibiotiques et déclenchée par l’antigène (Ag) [3]. Avec une association documentée avec une gastrite à Helicobacter pylori (Hp) chez plus de 90% des patients atteints de MALTL, le lien de causalité entre l’infection Hp antérieure et le développement ultérieur de la tumeur a été rapidement établi.
a été établi [4].
Helicobacter pylori
La première description de Hp (Fig. 1) comme “bacilles incurvés non identifiés dans l’estomac de patients atteints de gastrite et d’ulcération peptique” par Barry Marshall et John Robin Warren remonte également à 30 ans [5]. Ils ont reçu le prix Nobel de médecine en 2005 pour cette découverte. En particulier, l’infection à Hp provoque une gastrite chronique et entraîne l’acquisition de tissu lymphatique associé à la muqueuse, qui peut donner naissance à un MALTL par sélection clonale.
La stimulation Ag indirecte et directe des lymphocytes B, déclenchée par Hp, est médiée par les cellules présentatrices d’Ag et les lymphocytes T intratumoraux spécifiques d’Hp. La réponse immunitaire, c’est-à-dire la production d’anticorps anti-Hp et d’Ig idiotypiques, ne peut pas éliminer efficacement l’Ag. Au contraire, une antibiothérapie adéquate permet d’éradiquer l’Hp et d’obtenir une rémission complète du lymphome chez près de 80% des patients au stade précoce du MALTL [6].
Une meilleure compréhension du changement de paradigme thérapeutique révolutionnaire consistant à traiter avec succès une tumeur avec des antibiotiques résulte du continuum biologique des infiltrations lymphoprolifératives dans l’estomac, qui commence par la gastrite Hp et se termine par le lymphome à cellules B transformées hautement malin.
Hp-positif/Hp-négatif
En l’absence de gold standard, les patients symptomatiques sont soumis à un test combiné de détection de l’Hp, qui se révèle souvent faussement négatif en cas de traitement continu par des bloqueurs H2. Cliniquement, les différents types d’Hp se distinguent par leur virulence, les souches Cag-A+ étant associées à une morbidité significativement plus élevée chez les patients.
Environ 10% des patients atteints de MALTL sont Hp négatifs ; ils ont probablement un moins bon pronostic en termes de survie globale. Il est compréhensible que le traitement d’éradication seul ne donne que rarement des résultats positifs, de sorte qu’un traitement antitumoral est nécessaire. Helicobacter heilmannii n’est impliqué que dans environ un pour mille des infections à Hp chez l’homme.
Vaccination Hp
Avec une incidence moyenne de 30% d’infection à Hp et le risque associé de développer une gastrite B, un ulcère gastrique, un MALTL ou même un carcinome gastrique, on comprend l’urgence d’une prophylaxie. Les vaccins Hp ne sont toutefois utilisés à ce jour que sur des souris en laboratoire. L’expérience a tout de même permis d’obtenir une réduction significative de la colonisation bactérienne, ce qui prouve que les vaccins déclenchent une réponse immunitaire chez l’hôte et que celui-ci dispose donc d’un potentiel d’éradication. La réponse immunitaire naturelle reste cependant liée aux lymphocytes T régulateurs, ce qui limite à son tour l’élimination de l’Hp. On peut s’attendre à davantage de concepts de vaccination futurs qui pourraient contourner ou masquer la régulation immunitaire liée à l’hôte [7].
Morphologie
Dans l’entrée de routine du pathologiste, le diagnostic du MALTL relève en grande partie du domaine de la morphologie. Ainsi, la biopsie gastrique montre une lymphoprolifération diffuse dans la muqueuse et la sous-muqueuse avec des foyers d’infiltration très circonscrits dans l’épithélium de surface et le corps glandulaire, appelés lésions lymphoépithéliales (Fig. 2).
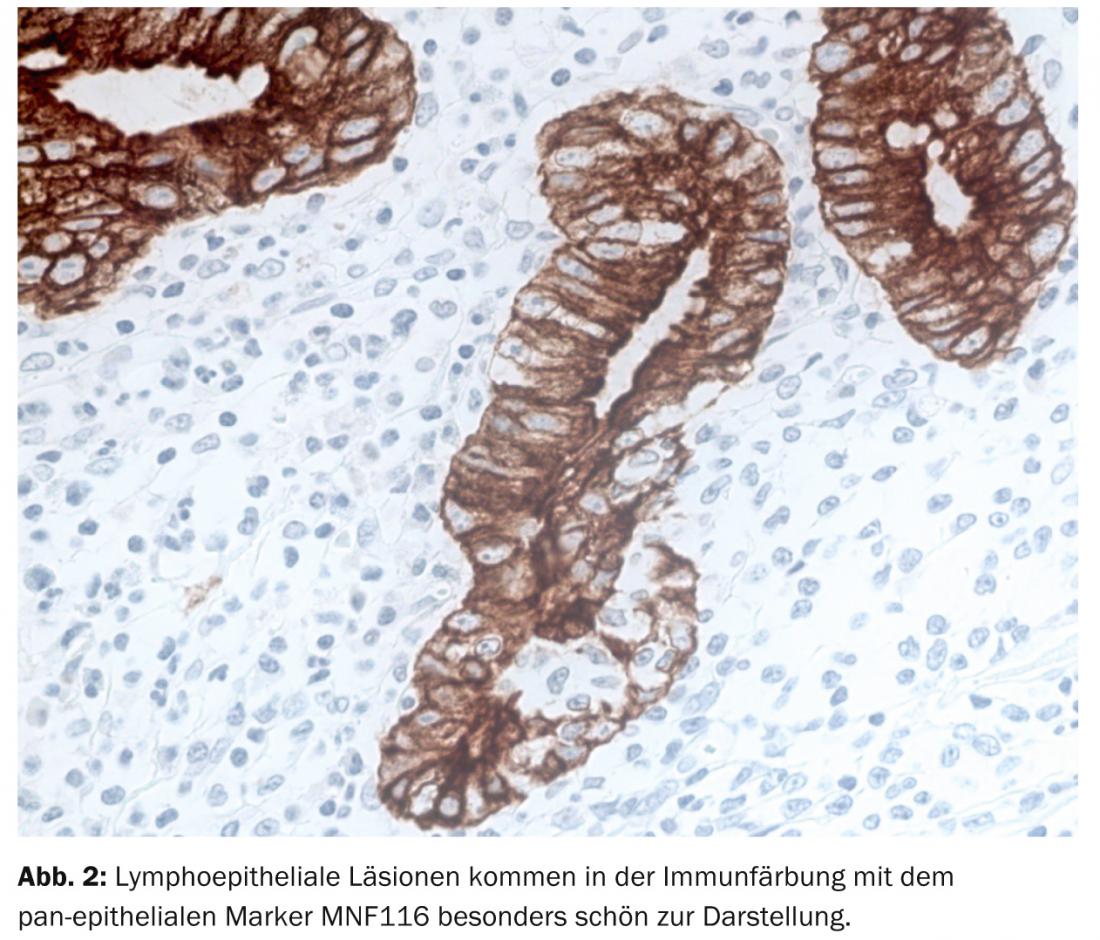
Les follicules lymphatiques réactifs résiduels se trouvent dans la région intratumorale, d’abord épargnés par la tumeur, puis colonisés par celle-ci. Sur le plan cytomorphologique, les cellules tumorales sont de taille petite à moyenne et de forme variable, centrocytoïde, lymphocytoïde ou monocytoïde. De plus, le MALTL présente une différenciation plasmocytaire typiquement dirigée contre l’épithélium de surface. Comme pour d’autres lymphomes de faible malignité, le MALTL peut se transformer en lymphome blastique.
Profil immunitaire
Selon la classification de l’OMS en vigueur en 2008, le MALTL n’a pas de profil immunitaire spécifique et ne peut donc pas être défini de manière affirmative sur le plan immunophénotypique. Il s’agit plutôt d’un diagnostic différentiel par rapport à d’autres lymphomes à cellules B de faible malignité, qui reste simplement la dernière option, quasiment per exclusionem. La positivité est obligatoire pour CD20 et, en tant qu’expression de la différenciation des plasmocytes, généralement un peu plus prononcée pour CD79a, tandis que la détectabilité des Ig monotypiques dépend fortement de la qualité de la biopsie. On trouve typiquement une positivité pour CD21, CD35, CD43, Bcl-10, IRTA-1 et T-bet, mais tous ces marqueurs non spécifiques peuvent également être exprimés dans d’autres sous-types de lymphomes. L’élément le plus utile pour le diagnostic est sans doute l’absence de détection de CD10 ou de la cycline D-1 et de SOX-11 pour distinguer le lymphome folliculaire du lymphome des cellules du manteau.
Marqueurs moléculaires
Lors de l’interprétation d’infiltrations lymphoprolifératives ambiguës de cellules B dans l’estomac, l’analyse de clonalité en PCR a certes une valeur de diagnostic différentiel. En effet, la gastrite polyclonale à Hp et la MALTL monoclonale sont toutes deux traitées par éradication antibiotique de l’Hp au stade précoce Ag-dépendant. En guise d’aparté, il convient de noter que la “gastrite clonale” est bien plus souvent diagnostiquée par les gastroentérologues qu’elle ne le serait par les hématopathologues [8].
La détection d’une cassure du gène MALT-1 ne joue pas non plus un rôle dans le diagnostic de routine du MALTL, et je reviendrai plus tard sur la signification plus précise de la translocation t(11;18)(q21;q21) dans le MALTL gastrique.
Biologie moléculaire spécifique au MALTL
Sur le plan diagnostique, la translocation récurrente réciproque t(11;18)(q21;q21), qui conduit à l’hybride de fusion chimérique BIRC3(API2)-MALT1, est l’aberration structurelle la plus spécifique du MALTL gastrique [9], qui peut être détectée par analyse FISH chez 30 à 50 % des patients (Fig. 3).
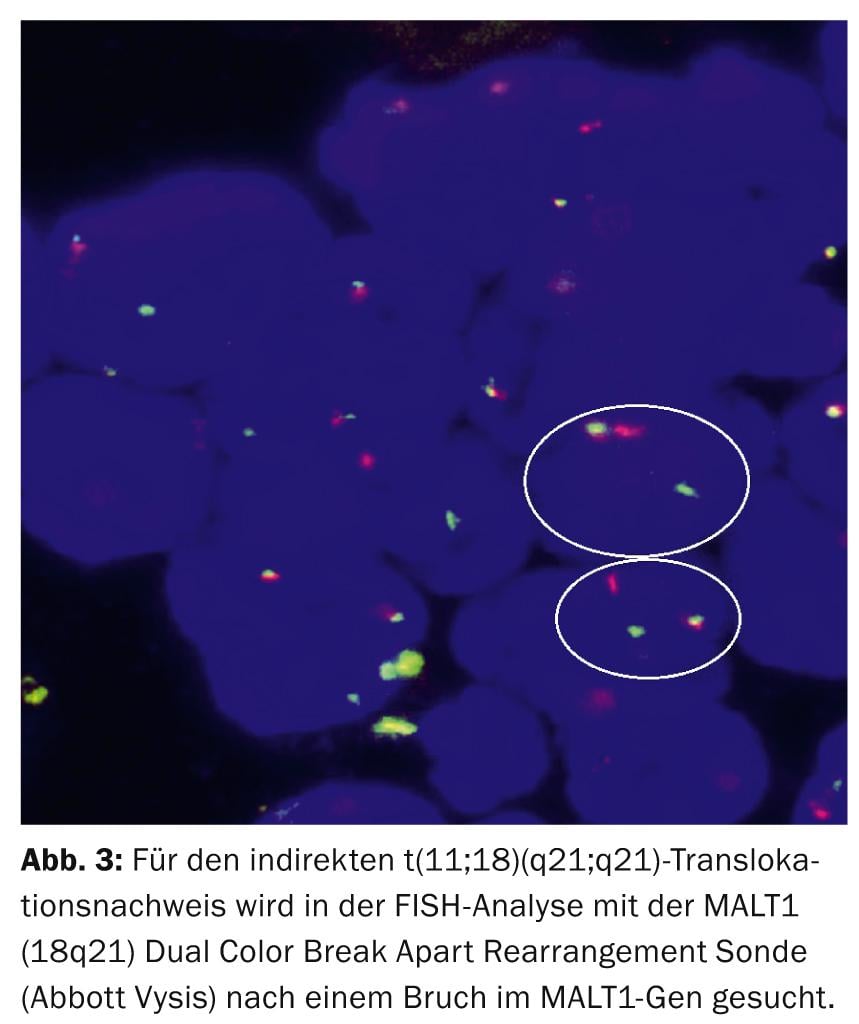
Sur le plan pathophysiologique, t(11;18)/BIRC3(API2)-MALT1, en synergie avec les translocations t(1;14)/BCL10-IGH et t(14;18)/IGH-MALT1 et la mutation TNFAIP3, entraîne une inhibition synchrone de l’apoptose et une activation de NF-κB via l’interaction oncogénique de MALT1 et BCL10.
Sur le plan pronostique, t(11;18) caractérise typiquement, en tant qu’aberration génétique unique, les cas présentant une grande stabilité caryotypique et a un effet protecteur contre une transformation blastique potentielle. La translocation t(11;18) est plus souvent détectée dans les MALTL avec un stade initialement avancé et une évolution plus agressive, une progression tumorale et une dissémination vers d’autres organes, et est plus souvent associée aux souches Cag-A+-Hp.
Dans le cas du MALTL t(11;18)-positif, le développement de la tumeur n’est pas déclenché par l’Hp et, par conséquent, 78% de ces patients sont réfractaires au traitement sous la seule éradication de l’Hp. Cependant, l’échec supposé du traitement le plus fréquent est dû à un intervalle de contrôle trop court et donc à l’impatience du patient ou de l’oncologue. Il est également important de différencier clairement s’il s’agit d’une colonisation Hp persistante de la muqueuse gastrique, de la détection histologique d’infiltrats lymphoïdes résiduels dans la biopsie gastrique répétée ou simplement d’un clone de cellules B persistant dans la PCR.
Sur le plan thérapeutique, des inhibiteurs de MALT1 ont récemment été testés directement in vitro pour leur activité antitumorale [10].
Biologie moléculaire non spécifique MALTL
En revanche, les translocations t(3;14)/FOX-P1-IGH, t(3;14)/BCL6-IGH et t(8;14)/C-MYC-IGH sont des aberrations génétiques structurelles non spécifiques que l’on trouve exclusivement dans le MALTL transformé par blast. Les anomalies numériques fréquentes, telles qu’une trisomie 3 associée dans 80% des cas à des trisomies 11, 12 ou 18, une instabilité des microsatellites/un déséquilibre allélique, une inactivité TP53 ou une délétion p16 restent enfin à mentionner pour être complet.
Take home messages
- Le lymphome à cellules B hautement malin de l’estomac peut être considéré comme une transformation vésiculaire en cas de réarrangement isoclonal des Ig prouvé et de signature d’expression génique identique à celle du MALTL, même si les mécanismes moléculaires de cette transformation ne sont pas encore totalement élucidés.
- Helicobacter heilmannii (Hh, Gastrospirillium hominis) ne joue un rôle que dans environ un pour mille des infections à Helicobacter chez l’homme. Les rares cas de lymphome MALT associé à Hh peuvent être mis en rémission complète sous traitement antibiotique d’éradication, comme pour Hp.
- “Tumor is a genetic diease” : la translocation t(11;18)(q21;q21)/BIRC3(API2)-MALT1 est le principal biomarqueur moléculaire du lymphome gastrique MALT et a une importance diagnostique, conceptuelle, physiopathologique, pronostique, prédictive et thérapeutique.
PD Dr. med. Sergio B. Cogliatti
Littérature :
- Isaacson PG, Wright DH : Lymphome malin extranodal issu du tissu lymphoïde associé à la muqueuse. Cancer 1984 ; 53 : 2515-2524.
- Frand U, et al : Lymphome malin en Israël – une étude épidémiologique sur 399 cas. Harefua 1963 ; 65 : 83-86.
- Galian A, et al : Etude pathologique de la maladie des chaînes alpha avec un accent particulier sur l’évolution. Cancer 1977 ; 39 : 2081-2101.
- Doglioni C, et al : Forte incidence du lymphome gastrique primaire dans le nord-est de l’Italie. Lancet 1992 ; 339 : 834-835.
- Marshall BJ, Warren JR : Bacillus curvilignes non identifiés dans l’estomac de patients atteints de gastrite et d’ulcération peptique. Lancet 1984 ; 323 : 1311-1315.
- Wotherspoon AC, et al : Regression of primary low-grade B-cell gastric lymphoma of mucosa-associated lymphoid tissue type after eradication of Helicobater pylori. Lancet 1993 ; 342 : 575-577.
- Czinn SJ, Blanchard T : Vaccination contre l’infection à Helicobater pylori. Nat Rev Gastroenterol Hepatol 2011 ; 8 : 133-140.
- Hummel M, et al : Le critère de Wotherspoon combiné à l’analyse de clonalité des cellules B par une technologie avancée de réaction en chaîne de la polymérase permet de distinguer le lymphome de la zone marginale gastrique couverte de la gastrite chronique. Gut 2006 ; 55 : 782-787.
- Mathijs B, Marynen P : t(11 ;18)(q21 ;q21) BIRC3/MALT1. Atlas Genet Cytogenet Oncol Haematol 2002 ; 6 : 34-36.
- Burgess DJ : Assault on MALT1. Nature Reviews Cancer 2013 ; 13 : 80-81.
InFo ONKOLOGIE & HÄMATOLOGIE 2015 ; 3(1) : 22-26