Les maladies cardiovasculaires, en particulier la maladie coronarienne (MC) et l’insuffisance cardiaque (IC), sont très répandues dans la population vieillissante et constituent l’une des principales causes de décès dans le monde. Avec l’âge, la capacité du cœur à se remettre du stress d’un infarctus du myocarde (IDM) diminue, ce qui entraîne des modifications importantes du métabolisme énergétique et contribue finalement à l’insuffisance cardiaque. Comprendre les mécanismes qui sous-tendent ces processus est essentiel pour développer de nouvelles thérapies ciblées.
Modifications métaboliques après un infarctus du myocarde
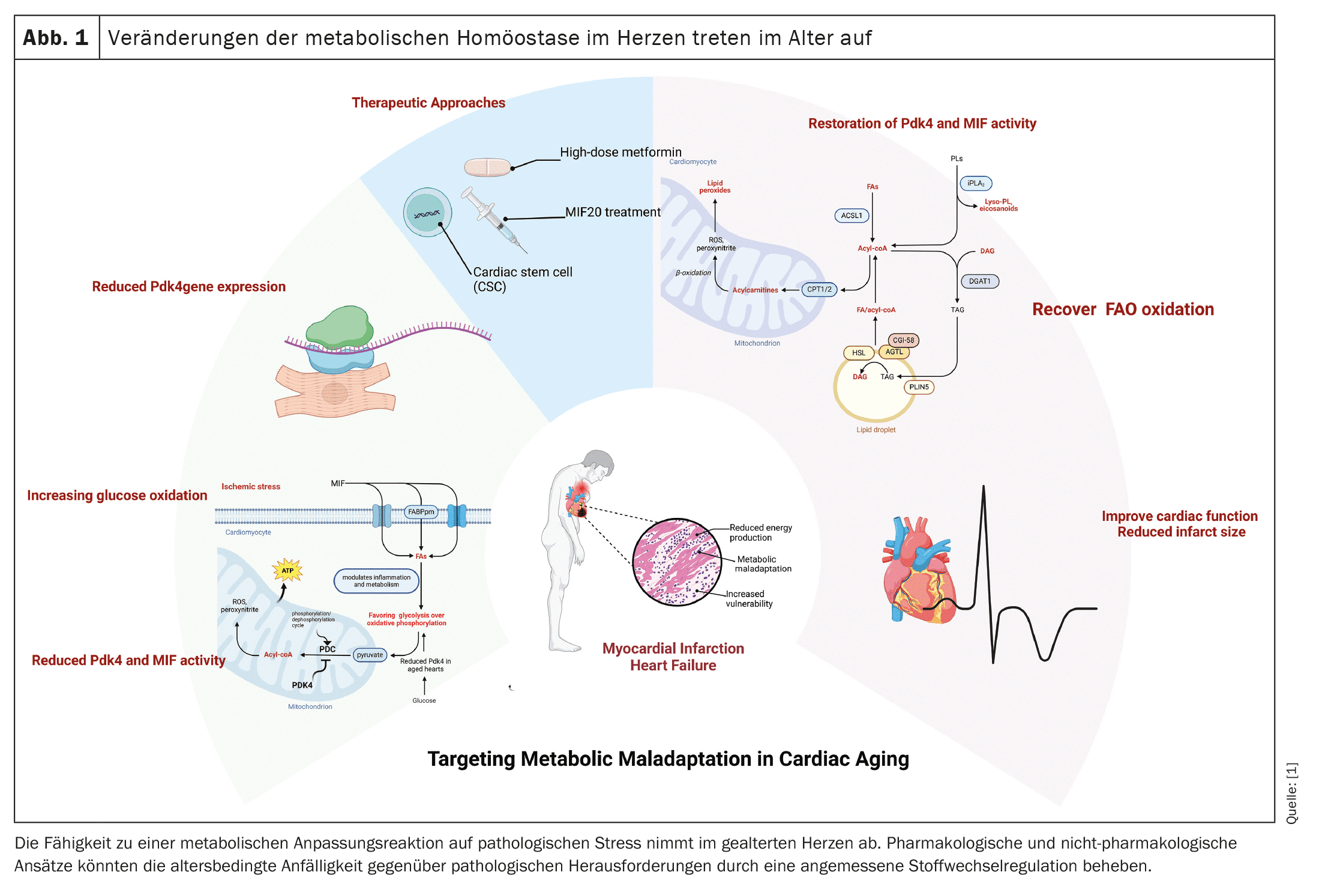
(red) Après un infarctus du myocarde, le cœur vieillissant subit des changements métaboliques significatifs qui affectent sa capacité à se contracter et à fournir un débit cardiaque suffisant. Pendant les conditions anaérobies d’un infarctus du myocarde, le cœur passe de l’oxydation des acides gras (FAO) à l’oxydation du glucose, moins efficace. Nos études sur des modèles murins ont montré qu’après un infarctus du myocarde, le tissu ventriculaire gauche des animaux âgés continue à dépendre de l’oxydation du glucose, qui est régulée par la pyruvate déshydrogénase kinase 4 (Pdk4). Cette désadaptation dans les cardiomyocytes du ventricule gauche après un infarctus du myocarde signale une diminution de la capacité du cœur âgé à rétablir le débit cardiaque, ce qui conduit finalement à une insuffisance cardiaque.
Pdk4 joue un rôle clé dans le métabolisme énergétique cellulaire en régulant le complexe pyruvate déshydrogénase (PDC), qui convertit le pyruvate en acétyl-CoA, reliant ainsi la glycolyse au cycle des acides tricarboxyliques (TCA) et à la phosphorylation oxydative. Dans un cœur vieilli, la diminution de l’expression de Pdk4 entraîne un déplacement de l’oxydation des acides gras vers l’oxydation chronique du glucose, qui est moins efficace dans la production d’ATP. Ce changement métabolique est particulièrement dommageable après un infarctus du myocarde, car les besoins énergétiques du cœur ne sont pas satisfaits, ce qui affecte davantage la fonction cardiaque et contribue à l’insuffisance cardiaque.
Le rôle du facteur d’inhibition de la migration des macrophages (MIF)
En plus de Pdk4, le facteur inhibiteur de la migration des macrophages (MIF), qui module l’inflammation et le métabolisme, est également diminué dans le cœur âgé et affaiblit la réponse adaptative au stress ischémique. Des études ont montré que la régulation à la hausse de Pdk4 améliore l’oxydation des acides gras et la performance cardiaque dans le myocarde vieilli, ce qui fait de Pdk4 une cible thérapeutique potentielle dans les dysfonctionnements cardiaques post-IM. Une thérapie prometteuse est l’utilisation d’agonistes MIF comme le MIF20, qui rétablissent la signalisation MIF après une ischémie, minimisent l’infarctus et revitalisent le métabolisme des cardiomyocytes en modulant Pdk4. Le MIF20 pourrait contribuer à corriger la réponse maladaptée de Pdk4, permettant ainsi aux cardiomyocytes vieillis de revenir à l’oxydation des acides gras et d’améliorer la performance cardiaque.
Taille de l’infarctus et son importance pour l’état cardiométabolique
Outre le rééquilibrage métabolique après un infarctus du myocarde, la taille de l’infarctus est un facteur important pour la récupération de la fonction cardiaque. Des études ont montré qu’il existe une forte corrélation entre la perturbation de la fonction des cardiomyocytes et la taille de l’infarctus. Ainsi, l’administration d’une dose élevée de metformine pendant la phase de reperfusion a permis de réduire la taille de l’infarctus, d’améliorer la contractilité et d’influencer positivement le métabolisme des cardiomyocytes, tant chez la souris que chez l’homme. Des approches de traitement non invasives, telles que la thérapie par cellules souches cardiaques (CSC), ont également montré des résultats prometteurs en termes de réduction de la taille de l’infarctus et d’amélioration de la performance cardiaque.
Progrès dans la réparation cardiaque : des thérapies protéiques à CRISPR et aux exosomes
Le développement d’approches thérapeutiques innovantes pour le traitement de l’insuffisance cardiaque post-IM progresse régulièrement. Outre les thérapies protéiques telles que le MIF20, de nouvelles approches telles que l’édition de gènes CRISPR pour corriger les gènes responsables de l’insuffisance cardiaque et les thérapies exosomales pour favoriser la réparation des tissus font l’objet de recherches actives. En outre, des essais cliniques sont en cours sur la thérapie par cellules souches, dont l’objectif est de régénérer les tissus cardiaques endommagés.
Limiter les conséquences de l’infarctus est essentiel pour améliorer les résultats en matière de santé chez les patients atteints de CAD. La dysfonction systolique du ventricule gauche (DSVG) et l’insuffisance cardiaque sont des conséquences fréquentes de l’infarctus du myocarde. Alors que les traitements invasifs tels que le pontage coronarien peuvent améliorer la dysfonction ventriculaire gauche, la fonction ventriculaire droite continue souvent à se détériorer, ce qui contribue à aggraver l’insuffisance cardiaque. C’est pourquoi les approches non invasives, qui permettent à la fois de réduire la taille de l’infarctus et d’améliorer le métabolisme du cœur, sont particulièrement importantes.
Perspectives futures et pertinence clinique
Compte tenu de l’augmentation de l’incidence de la CAO dans le monde, il reste essentiel de prévenir la progression vers l’insuffisance cardiaque. La compréhension des désadaptations métaboliques après un infarctus du myocarde et le développement de nouvelles thérapies visant à rétablir la régulation énergétique du cœur pourraient améliorer considérablement la qualité de vie des patients. Dans ce contexte, les thérapies protéiques et les interventions pharmacologiques qui optimisent le métabolisme énergétique du cœur constituent des approches prometteuses.
Dans l’ensemble, les connaissances mécanistiques détaillées sur le rôle de Pdk4 et de MIF dans le métabolisme cardiaque chez les personnes âgées offrent des approches thérapeutiques prometteuses pour améliorer la fonction cardiaque chez les patients âgés après un infarctus du myocarde. Les études futures devraient se concentrer sur le raffinement de ces thérapies et sur l’évaluation de leur efficacité dans des applications cliniques.
Source :
- Fatmi MK, Rouhi N, Lozonschi L, Li J : Cardiac metabolism in the elderly : effects and consequences. Aging (Albany NY). 2024 Aug 19 ; 16(16) : 11773-11775. doi : 10.18632/aging.206071. Epub 2024 Aug 19. PMID : 39167437 ; PMCID : PMC11386932.
CARDIOVASC 2024 ; 23(3) : 38-39