Les nouveaux systèmes TAVI transfémoraux, qu’ils soient en cours de développement ou déjà certifiés, s’attaquent aux points faibles et aux limitations possibles, comme l’insuffisance paravalvulaire ou le risque de complication vasculaire. Cet article, basé sur une présentation faite lors du 4e symposium bernois sur les valves cardiaques, donne un aperçu des derniers développements.
Depuis sa première implantation en 2002, l’implantation valvulaire aortique percutanée par transcathéter (TAVI) est devenue une méthode reconnue et éprouvée dans le traitement du rétrécissement valvulaire aortique sévère. L’approche mini-invasive a été constamment améliorée au cours des dernières années. Différentes voies d’accès et différents systèmes de valves à ballon ou auto-expansibles ont été testés ou développés. Sur la base des données cliniques issues d’études randomisées et de registres, le TAVI est supérieur au traitement médicamenteux et égal à la chirurgie cardiaque conventionnelle chez les patients à haut risque. La voie transfémorale offre l’avantage d’une intervention sous anesthésie locale sans anesthésie générale et est utilisée dans la majorité des cas lorsque l’anatomie est appropriée. Sur la base des résultats cliniques, le traitement par TAVI a été intégré en 2012 dans les directives de la Société européenne de cardiologie, avec une recommandation de classe I B pour les patients inopérables et une recommandation de classe IIa B pour les patients à haut risque présentant une sténose valvulaire aortique sévère. L’expérience clinique des procédures TAVI est basée sur l’utilisation des bioprothèses Edwards Sapien et Medtronic Corevalve, qui se sont imposées comme dispositifs principaux dans la pratique clinique quotidienne des procédures transfémorales. Le nombre total d’interventions a augmenté rapidement dans le monde entier, mais aussi en Suisse. Depuis le premier TAVI en 2007 à Berne, environ 650 interventions sont réalisées chaque année en Suisse.
Nouveaux systèmes certifiés CE
Edwards Sapien 3 : La prothèse Edwards Sapien 3 (Edwards Lifesciences Inc., CA, États-Unis) représente l’évolution de la prothèse Edwards Sapien XT et, comme son prédécesseur, elle comporte un cadre de stent en alliage cobalt-chrome et une valve cardiaque en péricarde bovin. Alors que le Sapien 3, inchangé par rapport aux modèles précédents, est fixé par un ballonnet dans le canal valvulaire aortique natif, il apporte pour la première fois, en tant que nouveauté spéciale, un ourlet d’étanchéité en polyéthylène téréphtalate (PET) dans la partie inférieure extérieure de la valve cardiaque (Fig. 1a).
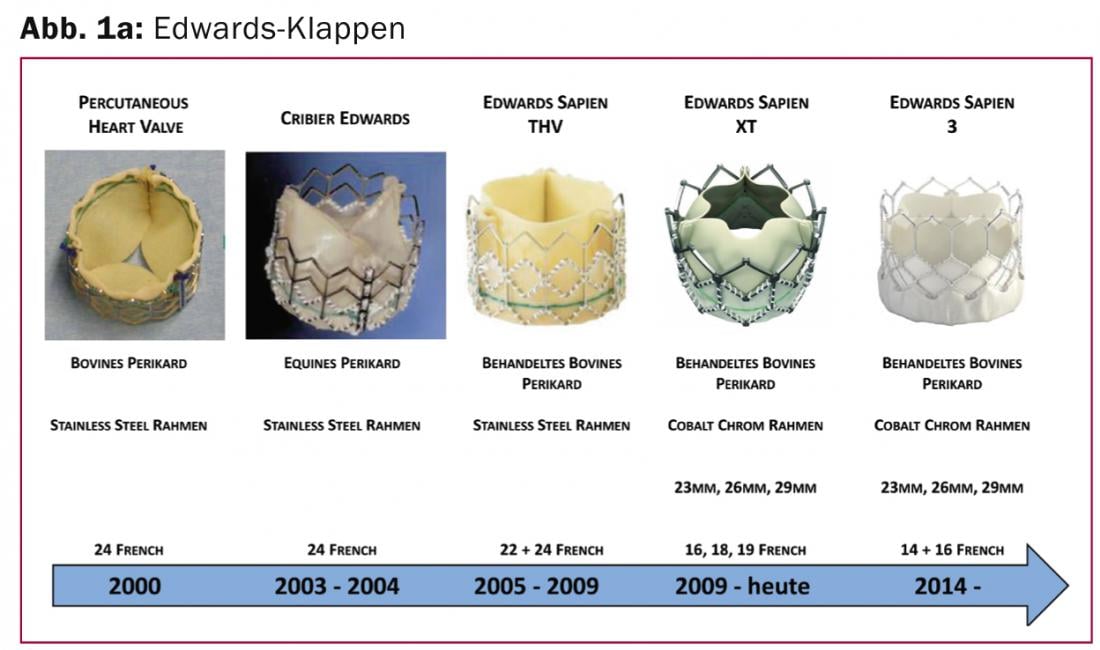
Ce bourrelet d’étanchéité a été conçu pour remplir les espaces entre la prothèse et la valve native dégénérative, empêchant ainsi les fuites paravalvulaires. Une modification de la conception du stent valvulaire permet également l’implantation via des sas de plus petite taille et un accès plus facile aux artères coronaires. Outre le développement de la prothèse valvulaire, le cathéter d’implantation fémoral a été fondamentalement revu et son diamètre réduit. Actuellement, seule une gaine de 14 French (diamètre intérieur) est nécessaire pour l’implantation d’une valve de 23 et 26 mm, et une gaine de 16 French pour la valve de 29 mm. Le système a récemment reçu l’approbation CE et peut être utilisé commercialement.
Valve Lotus de Boston Scientific : Le système de valve Lotus auto-expansible (Boston Scientific, Natick, MA, États-Unis) se compose d’une valve péricardique bovine insérée dans un treillis métallique en nitinol allongé. Pendant l’implantation de cette prothèse valvulaire, le stent se raccourcit et s’ancre ainsi dans le canal valvulaire aortique natif. Outre l’absence de compromis hémodynamique pendant l’implantation, la libération contrôlée et lente présente notamment l’avantage de pouvoir positionner le système avec une grande précision et, si nécessaire, de le recharger complètement dans le corps, même après son déploiement complet. Autre particularité, la valve Lotus dispose d’un matériau d’étanchéité adaptatif dans la partie inférieure de la prothèse, ce qui entraîne une réduction de l’insuffisance valvulaire aortique paravalvulaire. La valve Lotus est implantée via un cathéter de 18 ou 20 French, elle est certifiée CE et est disponible commercialement depuis octobre 2013 dans les tailles 23 mm et 27 mm.
Jude Medical Portico : La valve cardiaque Portico™ (St Jude Medical, St Paul, MN, États-Unis) est une prothèse TAVI auto-expansible composée d’un cadre de stent en nitinol dans lequel est cousue une valve péricardique bovine avec une bordure péricardique porcin. Visuellement, la valve ressemble à la bioprothèse Medtronic Corevalve, mais sa forme diffère principalement au niveau de la partie distale et annulaire. En outre, les cellules du cadre du stent sont plus grandes et la force radiale est plus faible. Le concept repose sur le fait que cela devrait réduire le risque de perturbation de la conduction électrique et améliorer l’adaptation de la prothèse à l’anatomie native. Le plan de la valve est en outre intra-annulaire. Le Portico™ récemment approuvé (tailles de prothèses de 23 à 25 mm) est introduit via un cathéter 18-French et peut être partiellement repositionné.
Direct Flow Medical : La prothèse de valve cardiaque Direct Flow Medical (Santa Rosa, CA, États-Unis), récemment certifiée CE, se caractérise par une structure complètement différente de celle des autres bioprothèses TAVI. Il ne comporte pas de parties métalliques, dispose d’un anneau aortique et ventriculaire qui prévient les insuffisances paravalvulaires et peut être vérifié en termes de position et d’étanchéité et repositionné le cas échéant après sa libération complète. L’expérience clinique avec cette valve péricardique bovine est encore limitée, des dimensions d’annulus allant jusqu’à 28 mm peuvent être traitées avec cette valve.
Nouveaux systèmes non certifiés CE utilisés dans des essais cliniques
Edwards Centera : L’Edwards Centera (Edwards Lifesciences Inc., CA, États-Unis) est une prothèse valvulaire auto-expansible composée d’un cadre de stent en nitinol avec une valve péricardique bovine. La forme spéciale du stent valvulaire vise à simplifier l’auto-alignement et le centrage de la prothèse valvulaire dans le canal valvulaire natif et utilise une gaine de polyéthylène téréphtalate (PET) dans la partie inférieure pour assurer l’étanchéité et éviter les fuites paravalvulaires. La libération très contrôlée est commandée par un mécanisme électrique motorisé. Malgré une force radiale élevée, il est également possible de repositionner et de retirer la prothèse valvulaire pendant l’implantation si le positionnement n’est pas optimal. Le Centera d’Edwards est testé dans le cadre d’études cliniques dans les tailles 23 mm, 26 mm et 29 mm et peut être inséré via un cathéter guide de 14 French. Les premiers résultats de cette prothèse valvulaire ont été bien accueillis.
Medtronic CoreValve Evolut R : Le système Medtronic CoreValve Revalving (Medtronic, Minneapolis, MN, États-Unis) (Fig. 1b) a été le deuxième système à être introduit avec succès en tant que système de transcathéter pour le traitement du rétrécissement aortique sévère.
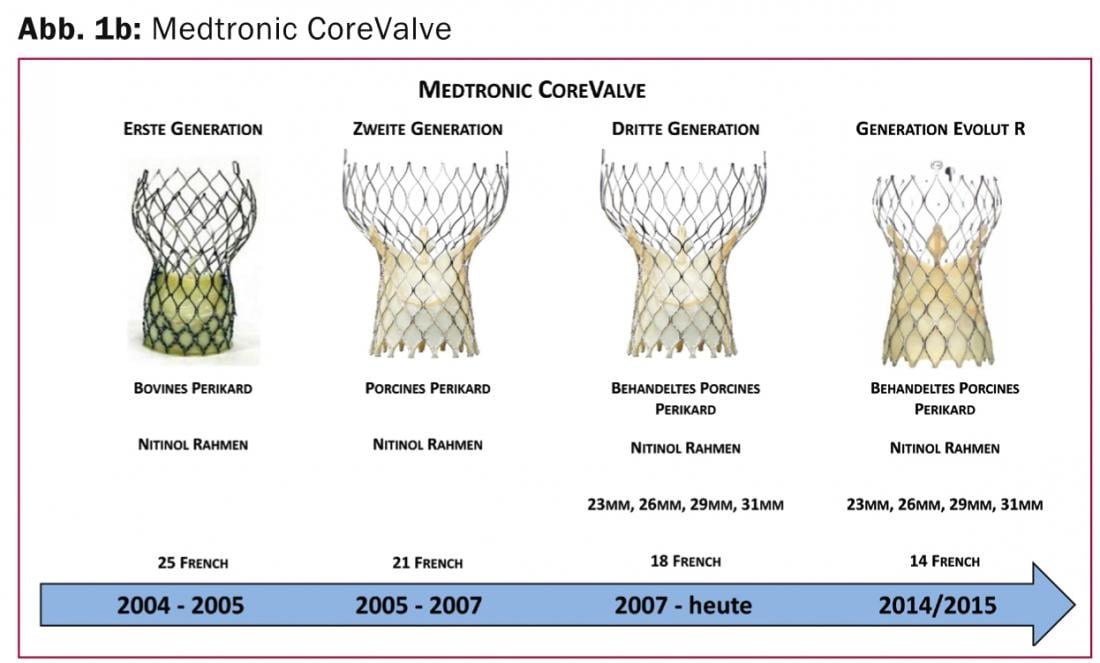
Depuis l’obtention du marquage CE en 2007, il est régulièrement utilisé dans le monde entier et se caractérise par une position supra-annulaire de la valve et une technologie d’implantation auto-expansible. La prochaine génération (Evolut R) vise à simplifier et à répéter le positionnement de la prothèse, c’est-à-dire que le système peut être rétracté dans le cathéter et repositionné en cas de position non optimale. Cette nouvelle technologie a déjà fait l’objet d’études cliniques et consiste en un alliage de nickel et de titane légèrement modifié (Nitinol) avec une géométrie cellulaire améliorée ainsi qu’une nouvelle structure de la zone d’écoulement et une réduction de 10% de la taille de la prothèse. Le design modifié devrait permettre une meilleure adaptation et un meilleur alignement de la prothèse valvulaire, même dans les anatomies de la racine aortique spécialement angulées, et couvre la plus grande plage de tailles d’annulus (18 -29 mm). L’autorisation de mise sur le marché de ce système amélioré, qui utilise du péricarde porcin, est attendue pour 2014 / 2015.
Autres systèmes de valves transfémorales de nouvelle génération : dans un avenir proche, d’autres systèmes TAVI viendront compléter l’offre (Fig. 2).
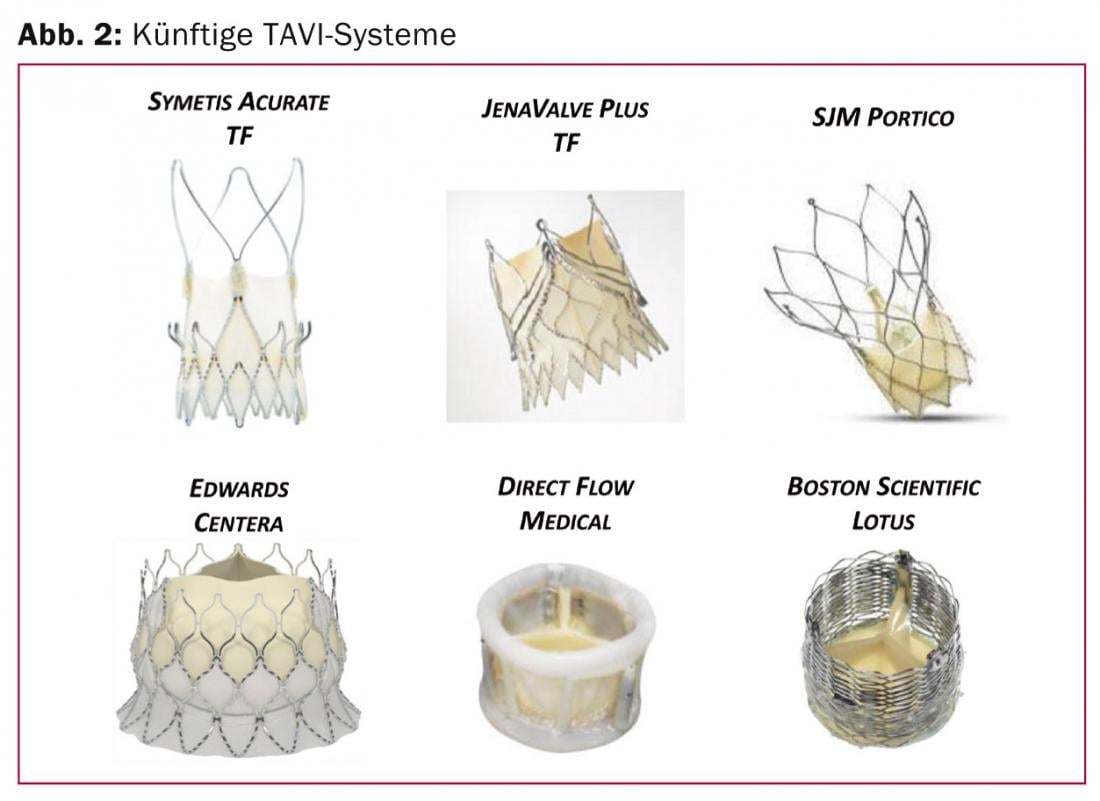
On développe principalement des systèmes auto-expansibles qui, selon l’anatomie, peuvent être insérés directement dans l’annulus natif sans prédilatation. Il s’agit de systèmes tels que Symetis Acurate TF (Symetis Inc, Ecublens, Suisse) ou JenaValve Plus (Munich, Allemagne), qui sont déjà approuvés par voie transapicale et font maintenant l’objet d’essais cliniques pour la voie transfémorale. Ils se caractérisent par une technique d’ancrage alternative et des mécanismes d’autocentrage et de stabilisation innovants. Les mécanismes d’ancrage à l’aide des feuillets valvulaires natifs et des poches valvulaires évitent le contact avec la région sous-valvulaire, ce qui minimise également le risque de troubles de la conduction électrique et la nécessité d’implanter un stimulateur cardiaque définitif. Cette dernière est un inconvénient pour les systèmes auto-expansibles qui se placent partiellement dans la voie d’écoulement du ventricule gauche.
Le registre Swiss TAVI
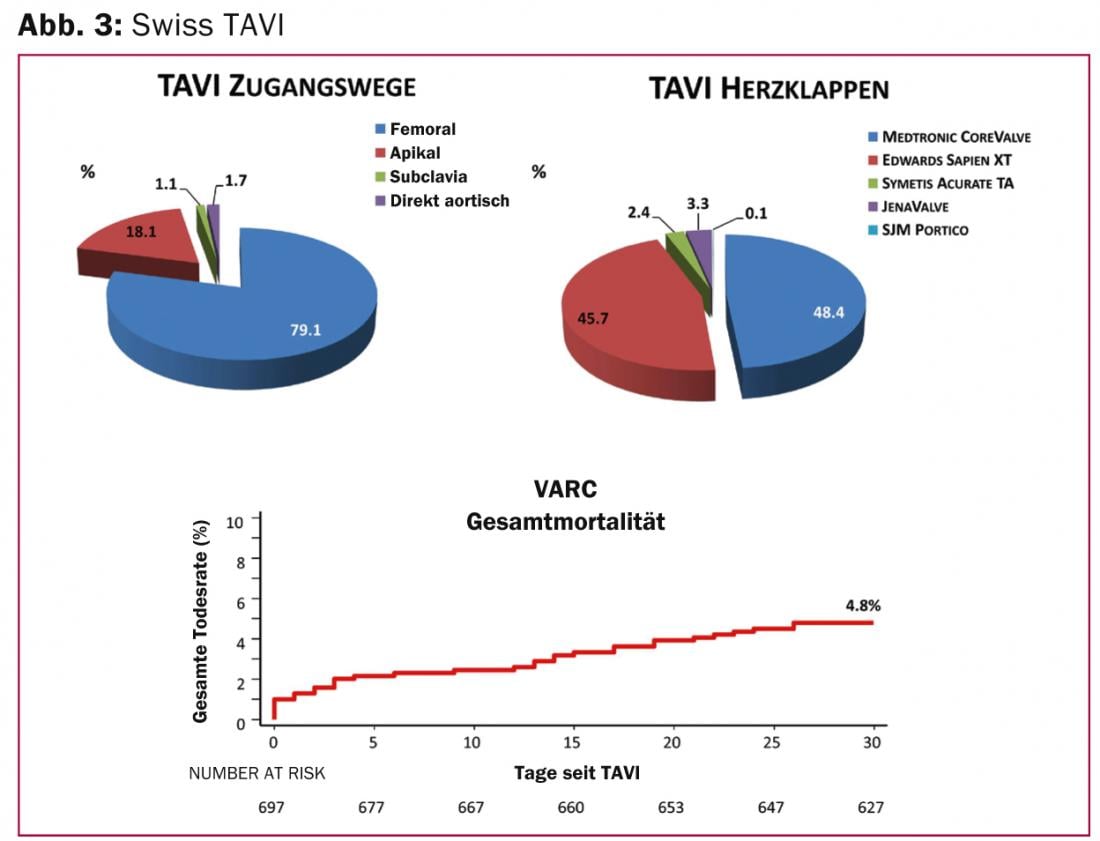
Le registre Swiss TAVI est un projet national interdisciplinaire du Groupe de travail suisse de cardiologie interventionnelle et de la Société suisse de chirurgie cardiaque. Il a été lancé en 2011 afin de définir un standard de qualité national pour le traitement TAVI et de pouvoir le proposer de manière uniforme en Suisse. Actuellement, environ 50 à 60 interventions TAVI sont réalisées chaque mois en Suisse. Les patients sont des patients à haut risque (risque de mortalité calculé à 30 jours selon le score STS de 8,2%), sévèrement symptomatiques (73% NYHA III et IV) et âgés en moyenne de 82 ans. Dans la plupart des cas, une voie d’implantation fémorale est utilisée (79%), plus rarement la voie transapicale, la voie directement aortique ou l’accès par l’artère sous-clavière (Fig. 3). Le taux de mortalité relevé à 30 jours (4,8%) était inférieur au taux attendu. 3,3% ont présenté des événements cérébrovasculaires (2,5% avec des déficits permanents) et 0,4% un infarctus du myocarde dans les 30 jours suivant l’intervention. Les complications les plus fréquentes étaient d’ordre vasculaire (11,8%), ainsi que les hémorragies locales (16,6%) et l’implantation d’un stimulateur cardiaque (20,5%).
Résumé
Le traitement par cathéter mini-invasif de la sténose valvulaire aortique sévère s’est imposé comme une alternative au remplacement valvulaire aortique chirurgical et correspond aujourd’hui à un traitement établi chez des patients sélectionnés. Les innovations techniques et les développements continus permettent de répondre aux limites actuelles, telles que l’insuffisance aortique paravalvulaire et les complications d’accès, ou de les minimiser. La nouvelle génération de prothèses valvulaires TAVI et de systèmes d’implantation promet ainsi une amélioration supplémentaire des critères cliniques grâce à une réduction significative des complications périprocédurales. Les études cliniques en cours montreront si ces attentes élevées peuvent être satisfaites. Il en dépendra également si, dans un avenir plus lointain, les indications d’utilisation des bioprothèses TAVI peuvent être élargies.
Pr Dr. med. Peter Wenaweser
Dr. med. Stefan Stortecky
Source : “Neue transfemorale TAVI Systeme und Swiss TAVI Registry”, présentation au 4e symposium bernois sur les valves cardiaques, 13 février 2014, Berne
Littérature :
- Wenaweser P, et al. : Short-term clinical outcomes among patients undergoing transcatheter aortic valve implantation in Switzerland : the Swiss TAVI registry. EuroIntervention 2014 (March [epub ehead of print]).
- Blumenstein J, et al : Avancées récentes dans l’implantation de valves aortiques transcathéter : nouveaux dispositifs et raccourcissements potentiels. Current Cardiology Reviews 2013 ; 9 : 274-280.
- Leon MB, et al : Implantation aortique-valvulaire par transcathéter pour la sténose aortique chez les patients qui ne peuvent pas subir d’opération. N Engl J Med 2010 ; 363(17) : 1597-1607.
- Smith CR, et al : Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med 2011 ; 364(23) : 2187-2198.
- Wenaweser P, et al : Résultats cliniques des patients atteints de sténose aortique sévère avec un risque chirurgical accru selon la modalité de traitement. J Am Coll Cardiol 2011 ; 58(21) : 2151-2162.
CARDIOVASC 2014 ; 13(2) : 39-42