Dans le cas du cancer du sein métastatique HR-positif, il existe plusieurs nouvelles options thérapeutiques. L’objectif de la conférence annuelle d’oncologie de Saint-Gall était de classer et d’évaluer ces substances. A quoi pourrait ressembler un algorithme thérapeutique moderne ?
“Lorsque nous parlons de nouveaux traitements dans ce domaine, nous faisons surtout référence à l’évérolimus (Afinitor®), au palbociclib (Ibrance®), au ribociclib (Kisqali®) et à l’abemaciclib (pas encore autorisé en Suisse) – et, dans une certaine mesure, au fulvestrant, qui est apparu sur le marché dès le début des années 2000″, explique le Dr Müller. “Les études sur les inhibiteurs de l’aromatase létrozole et anastrozole sont exemplaires de ce que nous avons obtenu avec les anciens médicaments en postménopause en première ligne : Par rapport au tamoxifène, ils ont significativement prolongé la survie sans progression et ont entraîné une réponse comparable ou supérieure [1–3].”
Dans l’étude FALCON [4], le fulvestrant s’est révélé supérieur à l’anastrozole en première ligne. Après environ six mois, les courbes de PFS divergeaient. La réponse était comparable. Une analyse de sous-groupe a montré que les patientes sans atteinte viscérale, en particulier, ont vécu plus longtemps sans progression (HR 0,59), tandis que celles avec atteinte viscérale n’ont pas bénéficié de l’anastrozole (HR 0,99).
Actuellement, le traitement endocrinien est l’option privilégiée pour les cancers du sein avancés avec récepteurs d’œstrogènes positifs, même en cas de métastases viscérales (sauf en cas de “crise viscérale” ou de résistance endocrinienne présumée – pour ces cas, une chimiothérapie primaire doit être choisie). Mais de quels principes actifs et de quelles combinaisons la thérapie endocrinienne moderne se compose-t-elle de préférence ?
Problème : Résistance
“Le développement d’une résistance aux traitements endocriniens est inéluctable en situation métastatique”, a déclaré le conférencier. On parle de “résistance primaire” lorsque la tumeur progresse en moins de six mois sous traitement endocrinien, mais de “résistance secondaire” lorsqu’elle ne progresse qu’après cette période. Ceci est valable pour les situations métastatiques primaires.
En situation adjuvante initiale, “primairement résistant” signifie une récidive précoce jusqu’à deux ans après le début du traitement endocrinien adjuvant. Les tumeurs “secondairement résistantes” sont celles qui ne récidivent qu’après deux à environ six ans (sous traitement adjuvant étendu) et celles qui ne récidivent qu’au moins un an après la fin du traitement adjuvant sont considérées comme “sensibles”.
Les mécanismes de résistance sont multiples. Les mutations ER (mutation activatrice ESR-1), par exemple, sont fréquentes. Celles-ci sont acquises et surviennent chez 15 à 30 % des personnes préalablement traitées par un traitement endocrinien et entraînent une résistance au tamoxifène, aux inhibiteurs de l’aromatase et au fulvestrant (éventuellement pas au fulvestrant-HD [5]). D’autres mécanismes de résistance sont des voies de signalisation cellulaires de dérivation.
Solution : de nouvelles substances actives
Pour certaines de ces voies de contournement, il existe désormais les nouveaux médicaments mentionnés.
L’évérolimus, par exemple, cible la dérivation via la voie PI3K/AKT/mTOR en inhibant mTOR. En tant que sérine-thréonine kinase, mTOR possède une fonction clé dans cette voie de signalisation, dont on sait qu’elle est perturbée dans de nombreuses tumeurs malignes humaines. BOLERO-2 [6] a montré une supériorité significative sur le critère d’évaluation primaire de la PFS en deuxième ligne en association avec l’exémestane par rapport à l’exémestane seul. Les courbes se sont écartées au bout d’un mois et demi environ et le bénéfice s’est également reflété dans la réponse. Aucun effet significatif n’a été mis en évidence pour le critère d’évaluation secondaire, la survie globale, l’étude étant bien entendu principalement axée sur la PFS. Une toxicité gênante et fréquente de la substance active est la stomatite, qui – comme l’a montré l’essai SWISH – peut être contrôlée, du moins dans une certaine mesure, par un bain de bouche à la dexaméthasone quatre fois par jour. En outre, une pneumonie peut survenir et nécessiter l’interruption du traitement en cas de symptômes modérés ou graves. Dans l’ensemble, la qualité de vie ne semble pas être affectée de manière significative par la molécule, mais elle n’est pas non plus améliorée par rapport à l’exémestane seul.
Un autre principe d’action est l’inhibition de CDK4/6. Le complexe cycline D-CDK4/6 régule la progression du cycle cellulaire via la phosphorylation de la protéine du rétinoblastome (Rb). La résistance endocrinienne est associée à la persistance de l’expression de la cycline D et à la phosphorylation de Rb. Les inhibiteurs sélectifs de la kinase CDK4/CDK6 interviennent précisément à ce niveau. Dans l’étude PALOMA-3 [7], présentée notamment à l’ASCO 2015, le palbociclib s’est révélé supérieur au fulvestrant seul en deuxième ligne, en association avec le fulvestrant. Là encore, les courbes de SSP se sont séparées très tôt (après environ un mois et demi). Si l’on regarde la toxicité, le profil de neutropénie et d’alopécie peut d’abord nous faire penser à la chimiothérapie. “Cependant, l’alopécie est presque toujours de grade 1 et la neutropénie est clairement différente de celle observée avec la chimiothérapie”, a expliqué l’orateur. Les cellules souches hématopoïétiques et les précurseurs précoces de neutrophiles dépendent de l’activité de la cycline D-CDK4/6 pour entrer dans le cycle cellulaire, le parcourir et proliférer. Ainsi, alors que dans le cas des inhibiteurs de la kinase CDK4/CDK6, la neutropénie est due à l’arrêt du cycle cellulaire, ce qui entraîne généralement une récupération rapide au cours de l’évolution (non cumulative), les dommages causés à l’ADN et l’apoptose des précurseurs proliférants entraînent une récupération retardée en cas de chimiothérapie. Les neutropénies de grade 3/4 avec le palbociclib sont contrôlables dans la mesure où plus des deux tiers des événements surviennent au cours du premier cycle et que le risque de neutropénies sévères est faible après réduction de la dose [8].
Et la première ligne ?
MONALEESA-2 [9] a démontré la supériorité du ribociclib associé au létrozole par rapport au létrozole seul en première ligne (réduction du risque de plus de 40% sur le critère d’évaluation primaire de la PFS et amélioration de la réponse). Les résultats ont été accompagnés de PALOMA-2 (Palbociclib) [10] et MONARCH-3 (Abemaciclib) [11] – l’effet des différents inhibiteurs de la kinase CDK4/CDK6 est comparable. Les différences apparaissent surtout dans le profil de toxicité. Les événements indésirables graves les plus fréquents dans PALOMA-2 et MONALEESA-2 étaient des neutropénies, auxquels s’ajoutaient une alopécie, une fatigue et une anémie dans le cas du palbociclib, ainsi que des nausées dans le cas du ribociclib. Dans MONARCH-3, il s’agissait surtout de diarrhée, en plus de la fatigue et également de neutropénie et d’alopécie.
“Les analyses de sous-groupes correspondantes montrent qu’aucun groupe de patients clinique ou moléculaire clair n’a pu être identifié jusqu’à présent qui ne bénéficie pas des nouveaux médicaments. Il n’existe donc pas non plus de biomarqueurs prédictifs établis”, a expliqué le Dr Müller. “Chez les femmes âgées de plus de 70 ans, l’efficacité semble être la même. Toutefois, la tolérance est ici – comme on peut s’y attendre – nettement moins bonne”. En première ligne, la qualité de vie avec le palbociclib n’est pas pire, mais pas non plus meilleure qu’avec le létrozole seul [12]. En revanche, en deuxième ligne, l’association avec l’inhibiteur de CDK4/6 est supérieure à la monothérapie par fulvestrant en termes de qualité de vie [13].
Comment décider ?
Outre des biomarqueurs valides, il manquait encore, au moment de la présentation, des données sur l’efficacité des nouvelles molécules ciblées dans le cancer du sein métastatique avec récepteurs hormonaux positifs, ainsi que des études sur la séquence optimale.
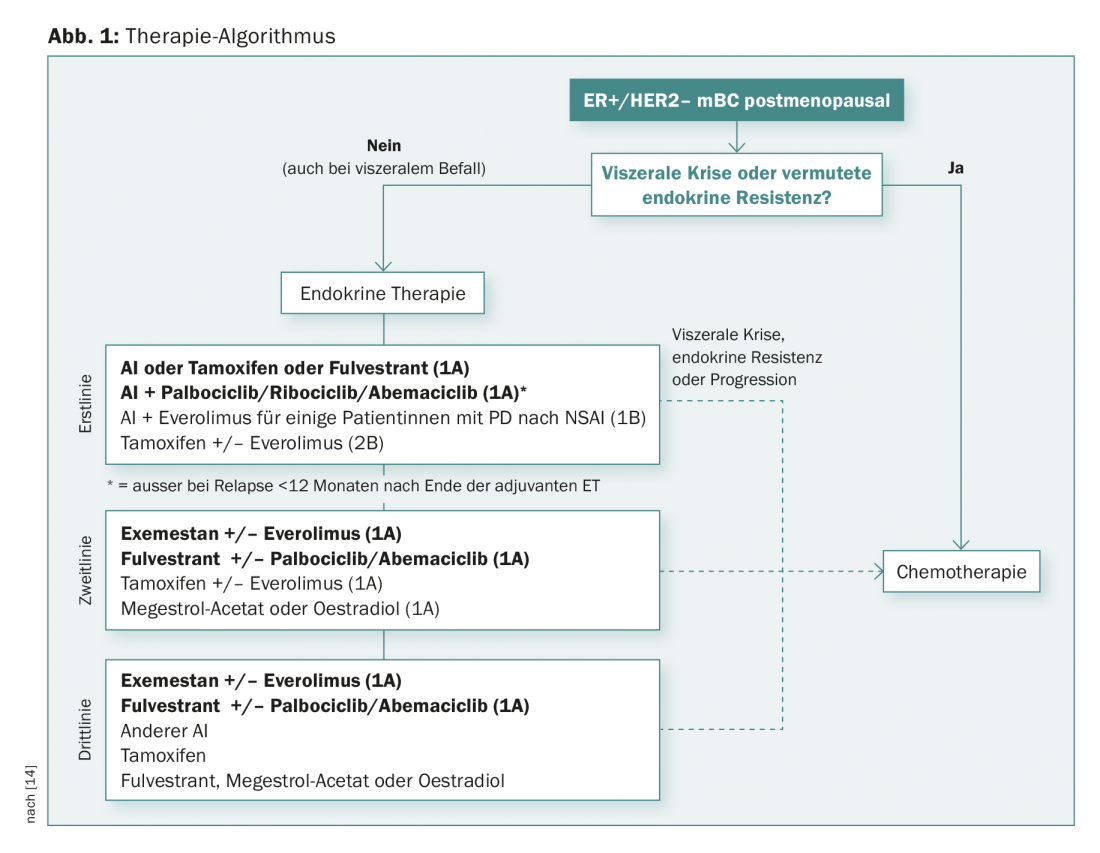
Un algorithme possible pour les patientes ménopausées atteintes d’une maladie métastatique ER+/HER2 est présenté dans la figure 1. “Le traitement endocrinien seul est une bonne option lorsque la pression de rémission est faible. L’association avec l’inhibition de CDK4/CDK6 est efficace en première ligne et même plus tard. C’est une option importante en cas de pression de rémission (également chez les personnes âgées avec toutefois plus de toxicité). L’évérolimus et l’exémestane sont efficaces après l’échec d’un traitement endocrinien. Pour l’instant, “efficace” signifie encore une amélioration de la PFS et de la réponse (et pas encore de l’OS) pour les nouvelles substances”, a résumé le Dr Müller.
Source : 28e cours de formation continue des médecins en oncologie clinique, 22-24 février 2018, Saint-Gall
Littérature :
- Mouridsen H, et al : Étude de phase III du létrozole versus tamoxifène en tant que traitement de première ligne du cancer du sein avancé chez les femmes ménopausées : analyse de la survie et mise à jour de l’efficacité par le Groupe international du cancer du sein au létrozole. J Clin Oncol 2003 juin 1 ; 21(11) : 2101-2109.
- Nabholtz JM, et al : Anastrozole (arimidex) versus tamoxifène en tant que traitement de première ligne du cancer du sein avancé chez les femmes ménopausées : analyse de la survie et résultats de sécurité mis à jour. Eur J Cancer 2003 août ; 39(12) : 1684-1689.
- Nabholtz JM, et al : L’anastrozole est supérieur au tamoxifène en tant que traitement de première ligne du cancer du sein avancé chez les femmes ménopausées : résultats d’un essai randomisé multicentrique nord-américain. Groupe d’étude Arimidex. J Clin Oncol 2000 Nov 15 ; 18(22) : 3758-3767.
- Robertson JFR, et al : Fulvestrant 500 mg versus anastrozole 1 mg pour le cancer du sein avancé avec récepteurs hormonaux positifs (FALCON) : un essai international, randomisé, en double aveugle, phase 3. Lancet 2016 Dec 17 ; 388(10063) : 2997-3005.
- Fribbens C, et al : Mutations ESR1 du plasma et le traitement du cancer du sein avancé positif aux récepteurs des œstrogènes. J Clin Oncol 2016 Sep 1 ; 34(25) : 2961-2968.
- Baselga J, et al : Everolimus in postmenopausal hormone-receptor-positive advanced breast cancer. N Engl J Med 2012 Feb 9 ; 366(6) : 520-529.
- Cristofanilli M, et al : Fulvestrant plus palbociclib versus fulvestrant plus placebo pour le traitement du cancer du sein métastatique HER2-négatif avec récepteurs hormonaux positifs ayant progressé sous traitement endocrinien antérieur (PALOMA-3) : analyse finale de l’essai contrôlé randomisé multicentrique en double aveugle de phase 3. Lancet Oncol 2016 ; 17(4) : 425-439.
- Verma S, et al : Palbociclib en association avec le fulvestrant chez les femmes atteintes d’un cancer du sein métastatique avancé avec récepteurs hormonaux positifs/HER2-négatif : analyse détaillée de la sécurité issue d’une étude multicentrique, randomisée, contrôlée par placebo, de phase III (PALOMA-3). Oncologist 2016 Oct ; 21(10) : 1165-1175.
- Hortobagyi GN, et al : Ribociclib as First-Line Therapy for HR-Positive, Advanced Breast Cancer. N Engl J Med 2016 ; 375 : 1738-1748.
- Finn RS, et al : Palbociclib and Letrozole in Advanced Breast Cancer. N Engl J Med 2016 Nov 17 ; 375(20) : 1925-1936.
- Goetz MP, et al : MONARCH 3 : Abemaciclib As Initial Therapy for Advanced Breast Cancer. J Clin Oncol 2017 Nov 10 ; 35(32) : 3638-3646.
- Rugo HS, et al : Impact of Palbociclib Plus Letrozole on Patient Reported Health-Related Quality of Life : Results From the PALOMA-2 Trial. Ann Oncol 2018 Jan 19. doi : 10.1093/annonc/mdy012 [Epub ahead of print].
- Harbeck N, et al : Quality of life with palbociclib plus fulvestrant in previously treated hormone receptor-positive, HER2-negative metastatic breast cancer : patient-reported outcomes from the PALOMA-3 trial. Ann Oncol 2016 juin ; 27(6) : 1047-1054.
- Cardoso F, et al : 3rd ESO-ESMO International Consensus Guidelines for Advanced Breast Cancer (ABC 3). Ann Oncol 2017 Jan 1 ; 28(1) : 16-33.
InFo ONKOLOGIE & HÄMATOLOGIE 2018 ; 6(2) : 38-40