Les traitements curatifs du carcinome hépatocellulaire sont la résection chirurgicale, l’ablation et la transplantation hépatique. Lors de la conférence de consensus de Zurich en 2010, des recommandations internationales ont été formulées pour les transplantations hépatiques en cas de CHC.
Le carcinome hépatocellulaire (CHC) est la troisième cause de mortalité associée au cancer dans le monde et la sixième en Suisse [1]. L’incidence est croissante au fil des années. Les principales causes sont ici les infections par le virus de l’hépatite B/C (VHB/VHC) et, plus récemment, l’augmentation épidémiologique de la stéatohépatite non alcoolique (NASH). En l’absence de traitement, le CHC présente un pronostic défavorable, avec un taux de survie à 5 ans inférieur à 10%. La majorité des patients développent un CHC dans le cadre d’une cirrhose du foie, ce qui rend les stratégies de traitement optimales beaucoup plus difficiles. Au cours de la dernière décennie, des progrès décisifs ont été réalisés dans la connaissance biomédicale de la maladie et dans le traitement. Les options de traitement reposent principalement sur des approches chirurgicales (résection, transplantation hépatique) et non chirurgicales (chimio-embolisation interventionnelle et radiologique, ablation locorégionale, chimiothérapie). Dans le cas d’un CHC localisé et non multifocal, l’ablation chirurgicale de la tumeur et la transplantation hépatique constituent le gold standard [2,3].
Présentation clinique et diagnostic
Les symptômes et l’aspect clinique dépendent du stade de la maladie tumorale. A un stade avancé, les patients présentent souvent la triade suivante : douleurs abdominales supérieures, tumeur palpable dans la partie supérieure droite de l’abdomen et perte de poids. En outre, on observe une ascite ainsi que des signes cliniques d’hypertension portale et, rarement, un ictère. Dans moins de 5% des cas, les patients se présentent avec une rupture de la tumeur, qui peut également entraîner des hémorragies potentiellement mortelles et un “ensemencement tumoral” intra-abdominal. De nombreuses complications paranéoplasiques ont également été décrites, telles que l’hypoglycémie, l’hypercalcémie, l’érythrocytose et l’ostéoarthropathie pulmonaire hypertrophique. Chez les patients atteints de cirrhose du foie et suivis dans le cadre d’un programme de dépistage, les tumeurs peuvent être détectées à un stade plus précoce.
Le marqueur tumoral α-fœtoprotéine (AFP) est élevé chez jusqu’à 90% des patients atteints de CHC ; cependant, il n’est pas corrélé à l’étendue de la maladie tumorale et sa spécificité et sa sensibilité sont limitées, car des maladies bénignes telles que les hépatites et la cirrhose du foie peuvent également être associées à une augmentation de l’AFP. La règle de base est qu’un taux d’AFP >200 ng/ml, associé à une imagerie appropriée, est hautement sensible à la maladie du CHC.
En ce qui concerne l’imagerie, l’accent est mis sur le scanner, l’IRM et les ultrasons. L’échographie est bien adaptée comme méthode de dépistage peu coûteuse. Cependant, la faible sensibilité et spécificité ainsi que le taux élevé de faux négatifs (plus de 50%) constituent les limites de cet examen.
De manière similaire aux critères BiRAD établis pour le cancer du sein, la société américaine de radiologie a défini des critères LiRAD (notamment l’accumulation de produit de contraste dans la phase artérielle, la taille de la lésion, le “wash out”). Ces critères permettent d’évaluer la malignité d’une lésion ronde du foie.
Grâce à l’amélioration de l’imagerie, la confirmation du diagnostic n’est indiquée que si les résultats ne sont pas clairs. Dans ce cas, la biopsie percutanée à l’aiguille fine guidée par ultrasons est le gold standard, bien qu’une dissémination de la tumeur (“tumor seeding”) le long du canal de biopsie puisse se produire dans <1%.
Staging selon la classification BCLC
Le staging et le choix du traitement sont effectués selon l’algorithme de la classification de la Barcelona Clinic Liver Cancer (BCLC), qui définit cinq stades de la maladie du CHC. Ils dépendent du nombre et de la taille de la tumeur, du stade Child-Pugh et du statut de performance ECOG (Fig. 1) [4].
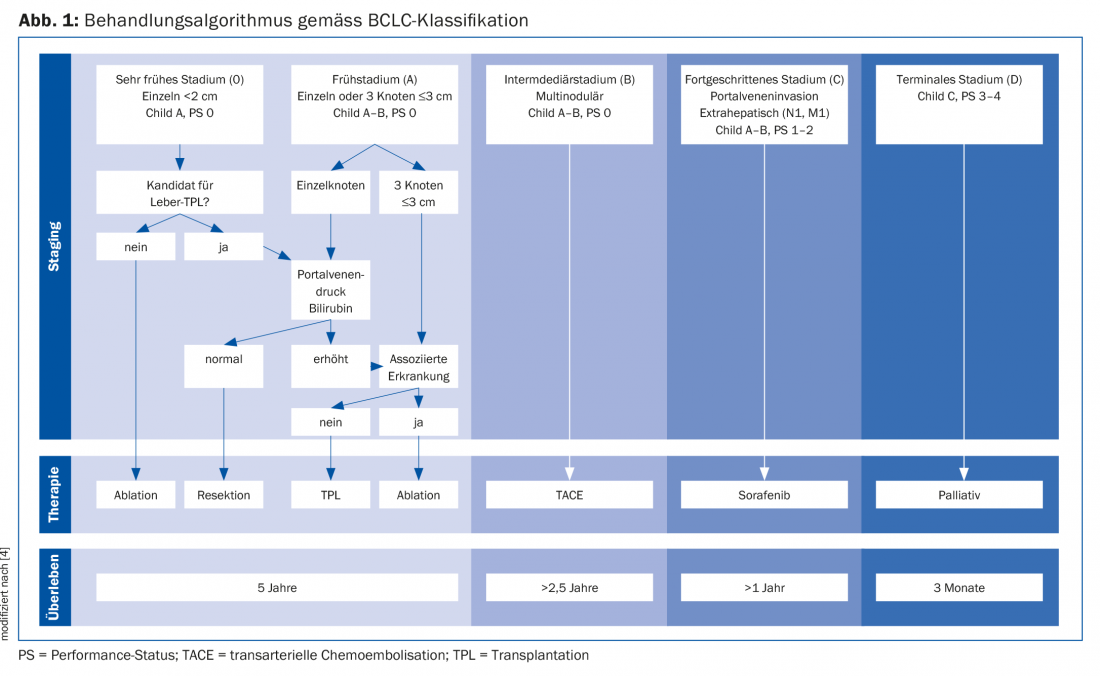
Méthodes thérapeutiques conservatrices : Thérapie systémique vs. thérapies locales
Les méthodes thérapeutiques conservatrices comprennent la thérapie systémique (inhibiteurs de la multikinase et immunothérapie) et les méthodes d’ablation des tumeurs. Le sorafénib, un inhibiteur de protéine kinase, est indiqué comme traitement de première ligne pour le stade C du BCLC. On constate un avantage de survie de 10,7 mois contre 7,9 mois chez les patients traités par sorafenib (contre placebo) [5]. Des inhibiteurs de multikinases plus récents, tels que le lenvatinib, semblent également efficaces selon des études de non-infériorité récentes (non encore publiées : Cheng et al., abstract 4001 à l’ASCO 2017) et seront bientôt autorisés comme traitements systémiques de première ligne. De plus, d’autres inhibiteurs de multikinases (par exemple le regorafenib et le cabozantinib) seront bientôt disponibles comme traitements de deuxième ligne [6].
La place de l’immunothérapie n’est pas encore claire et fait l’objet de recherches actuelles, des études de phase II sur le nivolumab montrant des résultats prometteurs. Nous pouvons donc attendre avec impatience les prochaines études d’efficacité.
Les patients atteints de CHC inscrits sur la liste de transplantation hépatique sont régulièrement réévalués. En cas de progression hépatique de la maladie tumorale en dehors des critères de listing – déterminés par l’imagerie et l’AFP -, le listing est souvent inactif et un downstaging est anticipé. En cas de progression malgré les traitements locorégionaux, le patient doit être “retiré” de la liste d’attente de transplantation. Les centres de transplantation ayant de longues listes d’attente effectuent des thérapies locales de transition pour contrôler la tumeur chez ces patients. Elles comprennent la chimio-embolisation transartérielle (TACE), l’ablation par radiofréquence (RFA) et par micro-ondes (MWA) et l’injection percutanée d’éthanol (PEI) [7]. La TACE est une embolisation sélective de l’afflux artériel de l’hépatome au moyen d’agents chimiothérapeutiques (principalement le cisplatine ou la doxorubicine), ce qui, en combinaison, entraîne une lésion tumorale ischémique et une chimiothérapie locale avec peu d’effets secondaires systémiques. Cette méthode interventionnelle permet d’obtenir une réduction de taille de la tumeur de 50% jusqu’à une nécrose complète de la tumeur. La TACE permet également de réduire le taux d’abandon sur la liste d’attente ainsi que le taux de récidive tumorale après une transplantation hépatique et d’obtenir un downstaging. La RFA/MWA consiste en la mise en place percutanée, assistée par imagerie, d’une sonde RFA dans la tumeur, qui est détruite thermiquement par une énergie électrique alternée à haute fréquence. Les résultats sont satisfaisants et des rapports faisant état d’un taux d’abandon de zéro pour cent et d’une survie à 3 ans allant jusqu’à 83% ont été publiés [8]. L’IPE a été le moins étudié en tant que traitement de transition. L’utilisation d’une aiguille fine la rend théoriquement moins invasive et donc moins exposée au risque de “tumor seeding”. Avec un spectre d’effets secondaires avantageux de l’IPE, des résultats concluants peuvent être obtenus avec jusqu’à 80% de nécrose tumorale. Cependant, comme plusieurs traitements sont nécessaires, cette technique a été majoritairement remplacée par la RFA. De nouvelles techniques d’ablation, telles que la radiothérapie interne sélective (SIRT), donnent des résultats prometteurs en termes de réponse tumorale et de survie [4]. Dans une étude récente, des patients atteints de CHC ont été traités par SIRT versus sorafenib après une TACE frustrante ; aucune différence n’a été observée en termes de survie [9]. La place de la SIRT reste toutefois à définir selon les études actuelles [4].
Si la taille et le nombre de tumeurs sont à la limite de la normale après un traitement de pontage, le patient est listé comme inactif afin de connaître la biologie de la tumeur par IRM, scanner et AFP au cours de l’évolution. Si, après une période d’attente inactive de trois mois, aucune progression de la tumeur n’est observée sur la liste, le patient peut être inscrit sur la liste active.
Traitement chirurgical : résection vs. transplantation hépatique
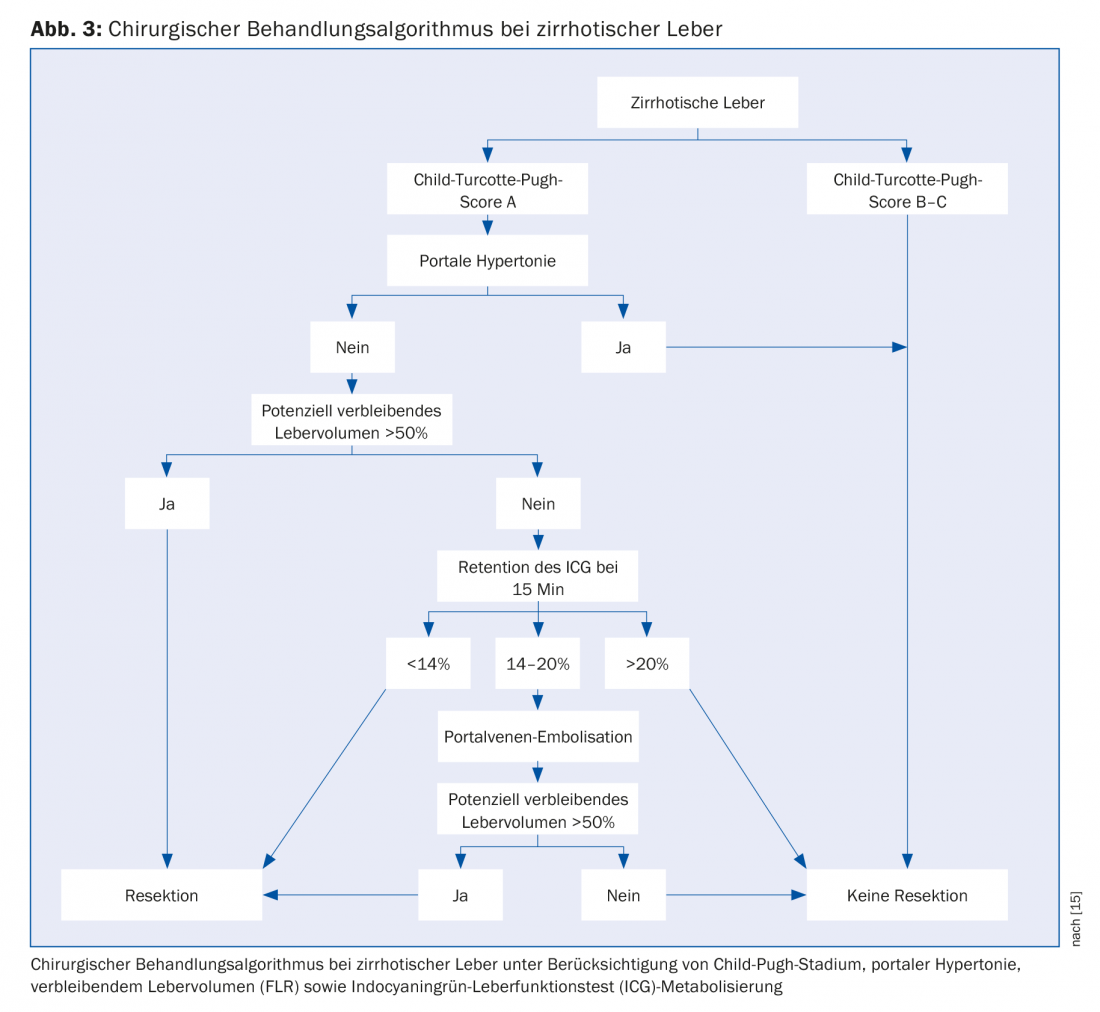
Le gold standard pour le CHC est la résection chirurgicale ou la transplantation hépatique orthotopique. Cependant, seuls 10 à 30% des patients atteints de CHC sont candidats à une résection. Après une laparotomie exploratoire, une résection curative peut être réalisée chez seulement 50 à 70% des patients. La seule contre-indication à la chirurgie est la présence de métastases extra-hépatiques. La résécabilité dépend de la taille de la tumeur, de son nombre, de sa proximité avec les vaisseaux sanguins et de la maladie hépatique sous-jacente. L’objectif de l’opération est une résection complète en milieu sain correspondant à un R0 histopathologique. La résécabilité est également déterminée par le volume du foie restant in situ (“future liver remnant”, FLR) et l’hypertension portale. Conformément à l’algorithme que nous proposons, le volume résiduel du foie restant sans tumeur doit être d’au moins 50%. Si les volumes sont inférieurs à cette valeur, une embolisation de la veine porte peut être effectuée pour induire le volume. L’hypertension portale n’est plus nécessairement une contre-indication absolue à la résection hépatique [10,11]. Lorsqu’une résection est envisagée chez des patients cirrhotiques, il convient d’opter, dans la mesure du possible, pour une procédure chirurgicale peu invasive, car ce groupe de patients en tire un bénéfice particulier [12]. A Zurich, nous proposons à nos patients des procédures de résection laparoscopique et robotique comme opérations mini-invasives [7].
Pour les tumeurs de petite taille (<2-3 cm), l’indication d’une ablation curative est discutée, car une survie équivalente a été postulée par rapport à la résection chirurgicale [13,14]. La valeur de ces études doit cependant être considérée avec réserve, d’une part parce qu’il s’agit d’analyses de sous-groupes issues d’études rétrospectives avec un niveau de preuve limité, et d’autre part parce que les quelques études prospectives n’ont pas encore montré de différence [7].
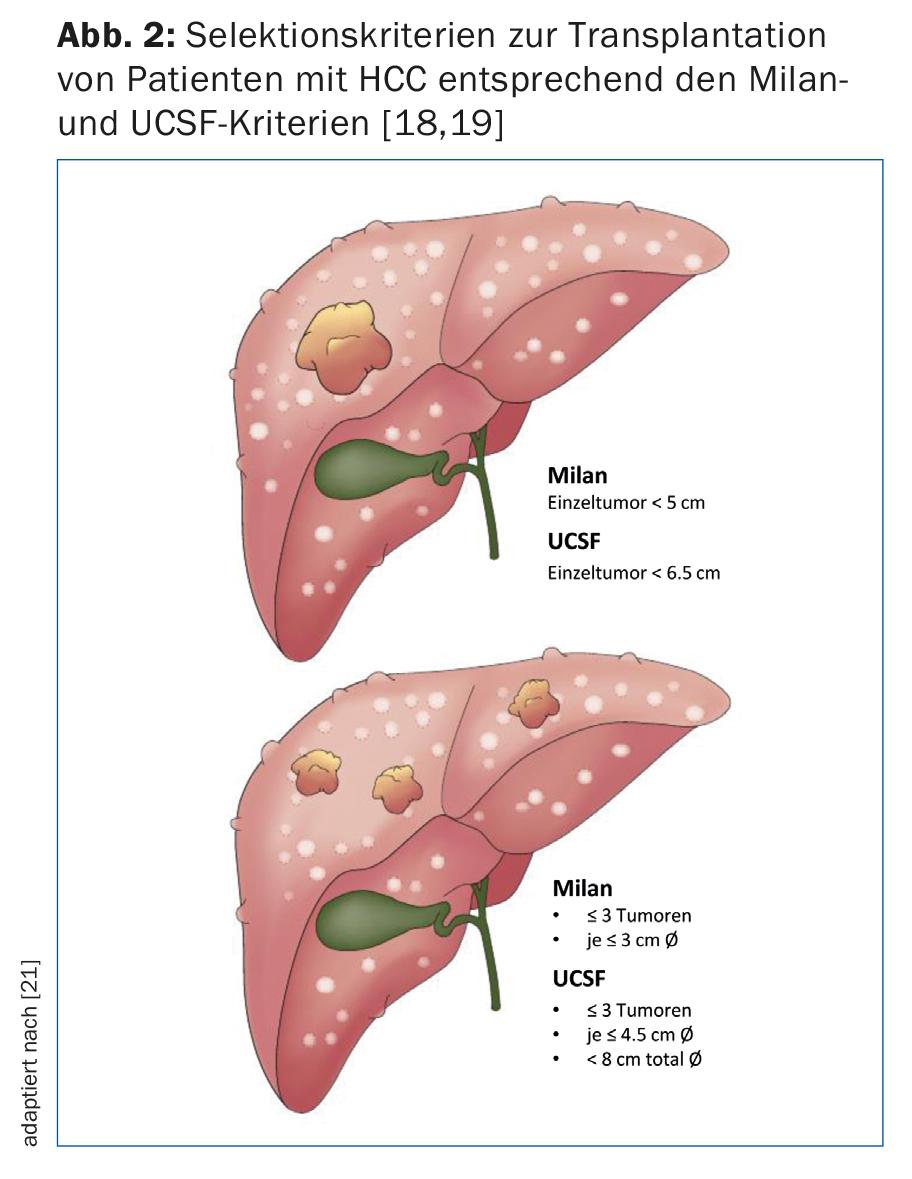
La transplantation hépatique est nettement supérieure à la résection en termes de survie sans récidive à 5 ans et constitue certainement la meilleure option thérapeutique chez les patients cirrhotiques atteints d’un CHC de petite taille. En raison de la pénurie d’organes de donneurs ainsi que du stade souvent avancé de la maladie en dehors des critères acceptés (Fig. 2), la transplantation ne peut être proposée qu’à une population sélective de CHC. Par conséquent, la résection reste le traitement de choix pour les patients cirrhotiques avec une fonction hépatique compensée (stade A de Child-Pugh) sans hypertension portale (figure 3) [15].
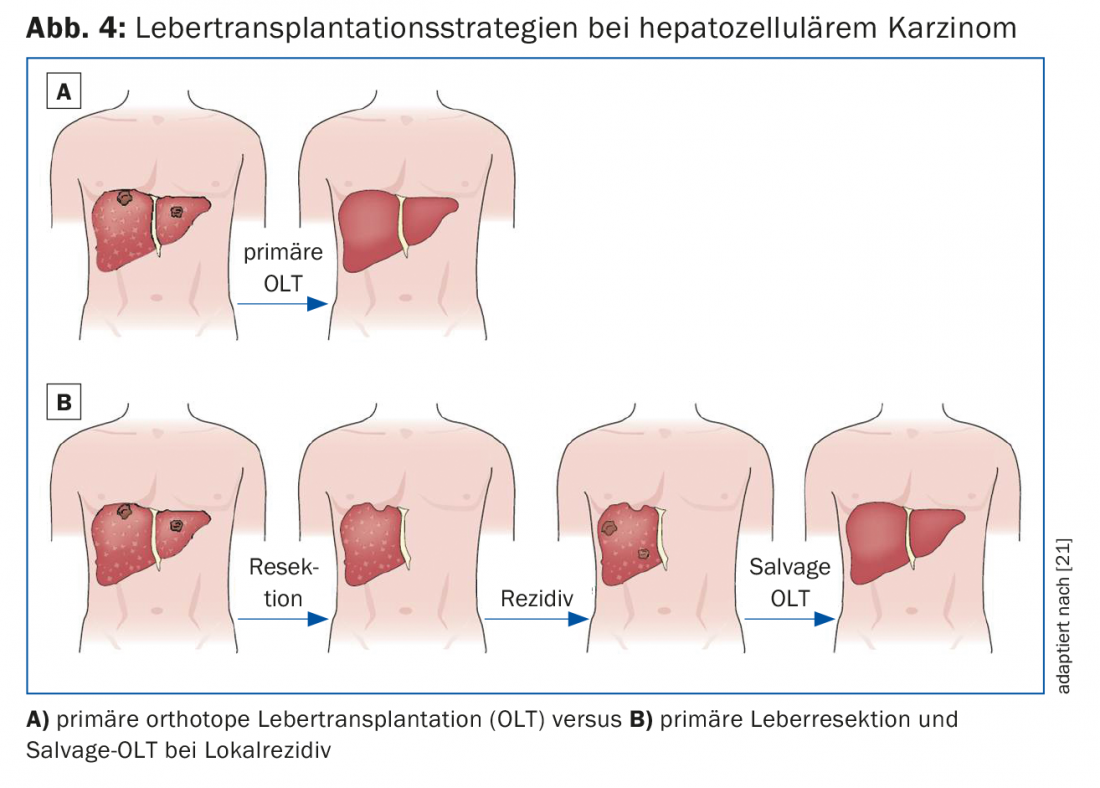
Un traitement combiné de résection hépatique et de transplantation peut être envisagé dans trois scénarios cliniques différents :
- Traitement primaire par une greffe de sauvetage en cas de récidive tumorale (Fig. 4)
- Procédure diagnostique pour l’évaluation histopathologique de la tumeur en termes d’invasion vasculaire et de satellites tumoraux, avec sélection adéquate des candidats à la transplantation.
- Traitement de transition avant la transplantation pour assurer le contrôle de la tumeur dans les limites des critères de Milan ou de l’UCSF (Fig. 2) [16].
Les patients atteints de CHC avec une fonction hépatique non compensée (Child-Pugh B ou C) et/ou une hypertension portale doivent être traités en priorité par une transplantation hépatique, à condition que la tumeur réponde aux critères de transplantation acceptés (Fig. 2).
La transplantation hépatique semble être le traitement idéal du CHC, car l’ablation complète du foie atteint par la tumeur correspond formellement à l’ablation d’une tumeur oncologique avec des marges de résection négatives. Dans le contexte d’une pénurie d’organes de donneurs, la transplantation hépatique n’est envisagée que pour les patients dont la survie est comparable à celle d’un receveur d’organe sans CHC.
A l’origine, l’équipe de Bismuth a rapporté l’étendue de l’atteinte tumorale comme marqueur de substitution de la biologie tumorale. Ils ont montré que les patients atteints de petites tumeurs uni ou binodulaires <3 cm ont une meilleure survie en cas de transplantation par rapport à la résection de la tumeur (83% vs 18%). De plus, les patients présentant un CHC diffus avec plus de deux nodules >3 cm ou un thrombus de la veine porte avaient un taux de récidive plus élevé avec une survie réduite consécutive [17]. Mazzaferro et al. ont étudié des patients atteints de cirrhose et de CHC non résécable traités par transplantation. Ils ont établi des critères spécifiques – la base des critères dits de Milan – définis comme une tumeur unique <5 cm ou ≤3 tumeurs de <3 cm de diamètre chacune (fig. 2). Les patients qui répondaient aux critères de Milan ont montré une amélioration significative de la survie sans récidive et de la survie globale après la transplantation [18]. De nombreuses études ont rapporté d’excellentes données de survie chez les patients atteints de CHC qui ont été transplantés dans le cadre de ces critères. Cela a conduit certains experts à considérer que les critères étaient trop restrictifs. En effet, un groupe de recherche de l’Université de Californie à San Francisco (UCSF) a montré que les patients ne répondant pas aux critères de Milan bénéficient également de manière significative d’une transplantation. Les critères UCSF plus complets sont définis comme une tumeur unique ≤6,5 cm ou ≤3 tumeurs de ≤4,5 cm chacune et la somme des diamètres totaux des tumeurs ≤8 cm (Fig. 2) [19]. La European Liver and Intestine Transplant Association (ELITA) et l’International Liver Transplantation Society (ILTS) ont lancé le projet Metroticket. Sur la base des données pré- et postopératoires du patient (taille maximale de la tumeur, nombre de tumeurs, taux d’AFP), il est possible de prédire la survie “post-transplantation” à l’aide d’un calculateur en ligne sur le site www.hcc-olt-metroticket.org [20] (fig. 5).
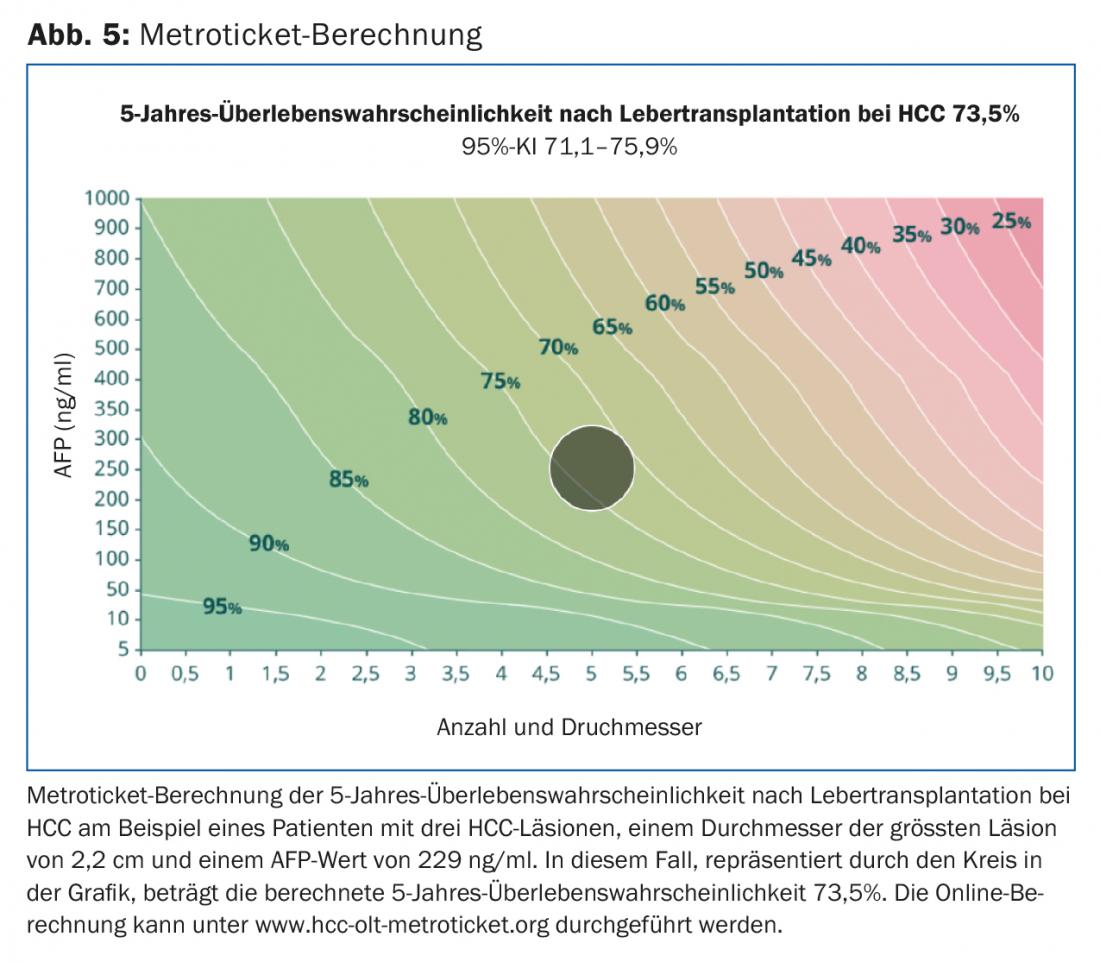
Les patients transplantés dans le cadre des critères de Milan ou de l’UCSF présentent des données de survie similaires (80% contre 75% de survie à 5 ans). Cependant, une transplantation en dehors des critères de l’UCSF est associée à une survie réduite – avec un taux de survie à 5 ans bien inférieur à 50%. Indépendamment de la taille et du nombre de tumeurs, la mise en évidence d’une invasion tumorale macrovasculaire constitue une contre-indication à la transplantation hépatique.
En décembre 2010, une conférence de consensus a été organisée à Zurich avec des experts internationaux. L’objectif était d’établir la pratique actuelle de la transplantation hépatique pour le CHC et de développer des directives reconnues au niveau international. Au total, 37 déclarations et recommandations ont été formulées. Elles concernent les domaines suivants : L’évaluation des candidats à la transplantation hépatique, les critères de référencement des patients cirrhotiques et non cirrhotiques, le rôle de l’élimination des tumeurs, le traitement des patients en liste d’attente, la place du don de foie vivant et le traitement après la transplantation. Les 17 recommandations les plus importantes (“strong statements”) sont résumées dans le tableau 1 [3].
Messages Take-Home
- L’incidence du carcinome hépatocellulaire (CHC) est en augmentation dans le monde entier.
- Les stratégies thérapeutiques curatives comprennent la résection chirurgicale, l’ablation et la transplantation hépatique.
- Après le sorafenib, le lenvatinib peut être utilisé comme traitement de première ligne.
- La transplantation hépatique par don de cadavre ou de vivant est une option thérapeutique possible pour les patients atteints de CHC et de maladie du foie en phase terminale (MLS).
- Les patients sur liste d’attente de transplantation bénéficient de thérapies de relais consistant en une chimio-embolisation transartérielle (TACE), une ablation par radiofréquence (RFA) et une injection percutanée d’éthanol (PEI). Le rôle du SIRT fait l’objet de recherches en cours.
- Lors de la conférence de consensus de Zurich en décembre 2010, des recommandations internationales ont été formulées pour les transplantations hépatiques chez les patients atteints de CHC.
Littérature :
- Parkin DM, et al : Global cancer statistics, 2002. CA Cancer J Clin 2005 ; 55 : 74-108.
- Dutkowski P, et al : Challenges to Liver Transplantation and Strategies to Improve Outcomes. Gastroenterology 2015 Feb ; 148(2) : 307-323.
- Clavien PA, et al : Recommandations pour la transplantation hépatique pour le carcinome hépatocellulaire : un rapport de conférence de consensus international. The Lancet Oncology 2012 ; 13 : e11-22.
- Bruix J, Reig M, Sherman M : Evidence-Based Diagnosis, Staging, and Treatment of Patients With Hepatocellular Carcinoma. Gastroenterology 2016 ; 150 : 835-853.
- Llovet JM, et al : Sorafenib in advanced hepatocellular carcinoma. The New England Journal of Medicine 2008 ; 359 : 378-390.
- Bruix J, et al : Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE) : a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2017 ; 389 : 56-66.
- Petrowsky H, Busuttil RW : Résection ou ablation du petit carcinome hépatocellulaire : quel est le meilleur traitement ? Journal of Hepatology 2008 ; 49 : 502-504.
- Mazzaferro V, et al : Radiofrequency ablation of small hepatocellular carcinoma in cirrhotic patients awaiting liver transplantation : a prospective study. Annals of Surgery 2004 ; 240 : 900-909.
- Vilgrain V, et al : Efficacité et sécurité de la radiothérapie interne sélective avec des microsphères de résine d’yttrium-90 par rapport au sorafénib dans le carcinome hépatocellulaire localement avancé et inopérable (SARAH) : un essai contrôlé randomisé de phase 3 en ouvert. The Lancet Oncology 2017 ; 18 : 1624-1636.
- Capussotti L, et al : Liver resection for hepatocellular carcinoma on cirrhosis : analysis of mortality, morbidity and survival – a European single center experience. European journal of surgical oncology : the journal of the European Society of Surgical Oncology and the British Association of Surgical Oncology 2005 ; 31 : 986-993.
- Cucchetti A, et al : Is portal hypertension a contraindication to hepatic resection ? Annals of surgery 2009 ; 250 : 922-928.
- Abu Hilal M, et al : The Southampton Consensus Guidelines for Laparoscopic Liver Surgery : From Indication to Implementation. Annals of surgery 2017. DOI : 10.1097/SLA.0000000000002524 [Epub ahead of print].
- Vivarelli M, et al : Résection chirurgicale versus ablation percutanée par radiofréquence dans le traitement du carcinome hépatocellulaire sur foie cirrhotique. Annals of Surgery 2004 ; 240 : 102-107.
- Guglielmi A, et al : Ablation par radiofréquence versus résection chirurgicale pour le traitement du carcinome hépatocellulaire dans la cirrhose. Journal of gastrointestinal surgery : official journal of the Society for Surgery of the Alimentary Tract 2008 ; 12 : 192-198.
- Clavien PA, et al : Strategies for safer liver surgery and partial liver transplantation. N Engl J Med 2007 ; 356 : 1545-1559.
- Chua TC, et al : Résection hépatique pour carcinome hépatocellulaire transplantable pour les patients répondant aux critères de Milan et de l’UCSF. Am J Clin Oncol 2012 ; 35 : 141-145.
- Bismuth H, et al : Liver resection versus transplantation for hepatocellular carcinoma in cirrhotic patients. Annals of surgery 1993 ; 218 : 145-151.
- Mazzaferro V, et al : Transplantation hépatique pour le traitement des petits carcinomes hépatocellulaires chez les patients atteints de cirrhose. N Engl J Med 1996 ; 334 : 693-699.
- Yao FY, et al : Transplantation hépatique pour le carcinome hépatocellulaire : l’expansion des limites de taille de la tumeur n’a pas d’impact négatif sur la survie. Hepatology 2001 ; 33 : 1394-1403.
- Mazzaferro V, et al : Predicting survival after liver transplantation in patients with hepatocellular carcinoma beyond the Milan criteria : a retrospective, exploratory analysis. The Lancet Oncology 2009 ; 10 : 35-43.
- Agopian V, Petrowsky H : Transplantation hépatique pour les tumeurs malignes. In : Fong Y, et al. (éd.) : Hepatobiliary cancer. People’s Medical Publishing House 2014 ; 293-316.
PRATIQUE DU MÉDECIN DE FAMILLE 2018 ; 13(1) : 14-19











