Aujourd’hui encore, de nombreux cancers du poumon ne sont diagnostiqués qu’à un stade tardif ou avancé et donc symptomatique. Sur la base de données d’études récentes, plusieurs sociétés savantes ont émis des recommandations positives en faveur d’un dépistage pulmonaire, mais certaines questions restent en suspens quant à sa mise en œuvre. Dans le cas d’un cancer du poumon nouvellement diagnostiqué, un staging préopératoire précis et non invasif devrait être réalisé immédiatement pour une classification TNM correcte, d’autant plus que celui-ci constitue le cadre pour la détermination d’une thérapie ou d’un traitement approprié. la gestion ultérieure des patients. La connaissance des avantages, des inconvénients et des limites des différentes modalités d’imagerie non invasives joue un rôle important à cet égard.
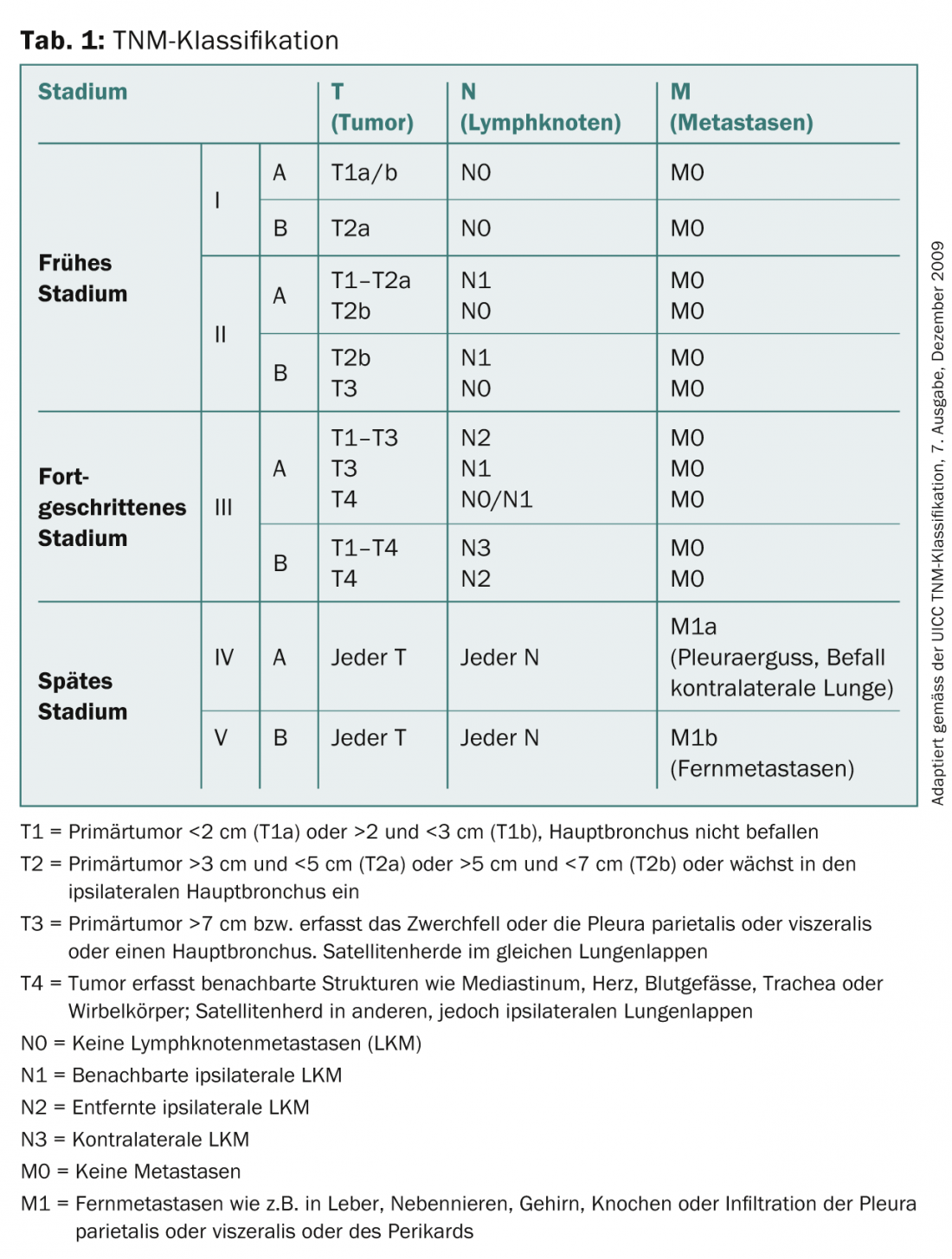
En Suisse, le cancer du poumon est la première cause de décès par cancer chez les hommes et la deuxième chez les femmes. Alors que les taux de nouveaux cas et de mortalité ont diminué ces dernières années chez les hommes, ils continuent d’augmenter chez les femmes. Malgré des progrès importants en matière de diagnostic et de traitement, la survie à 5 ans stagne, quel que soit le stade de la maladie. Il est d’environ 14% pour un cancer du poumon nouvellement diagnostiqué. En cas d’apparition de symptômes cliniques, le diagnostic initial se fait généralement par radiographie conventionnelle et tomodensitométrie (TDM), avant d’être suivi d’une procédure biopsique pour le typage des tissus et le staging. Les techniques d’imagerie telles que le scanner, l’imagerie par résonance magnétique (IRM), la tomographie par émission de positons/tomographie informatisée intégrée (PET/CT) et la scintigraphie osseuse permettent de classer les tumeurs selon la classification TNM (tableau 1), sur la base de laquelle la procédure thérapeutique ultérieure est déterminée. Cet article évalue les différents outils de diagnostic radiologique et de staging, ainsi que leurs avantages, inconvénients et limites.
Depuis la publication des données du “National Lung Screening Trial” [1], qui montrent qu’un programme de dépistage ciblé par scanner permet de réduire le taux de mortalité, diverses sociétés savantes ont émis des recommandations positives en faveur du dépistage pulmonaire. Cependant, certaines préoccupations et questions non résolues subsistent, notamment en ce qui concerne la gestion et les conséquences des faux positifs, la recommandation et la durée des intervalles de contrôle, le risque d’exposition cumulée aux rayonnements, les conséquences économiques pour le système de santé et la réglementation du financement [2].
Diagnostic radiologique et staging
Radiographie du thorax : la radiographie du thorax en deux plans joue un rôle secondaire dans le diagnostic en raison de sa faible sensibilité, car un résultat négatif ne permet pas d’exclure un carcinome pulmonaire. Toutefois, la radiographie permet d’exclure ou de confirmer d’autres causes de douleurs thoraciques. Souvent, l’admission sert également d’examen de base avant une opération ou un traitement et est donc utile pour délimiter les complications du traitement ou les maladies non tumorales dans le cadre du suivi (Fig. 1).

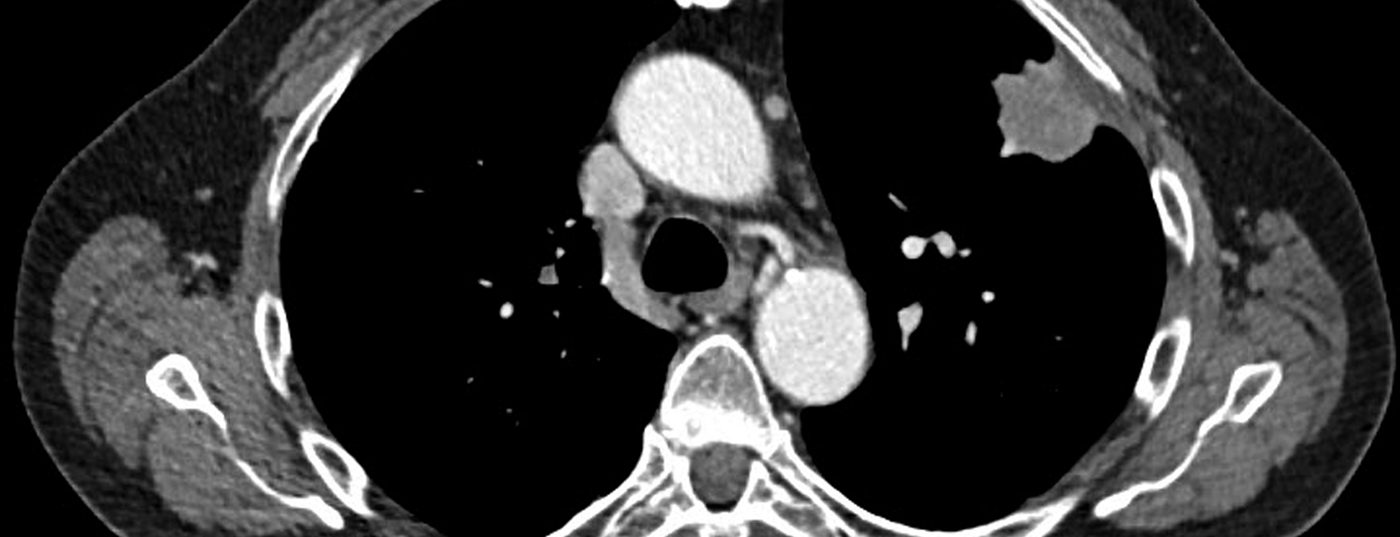
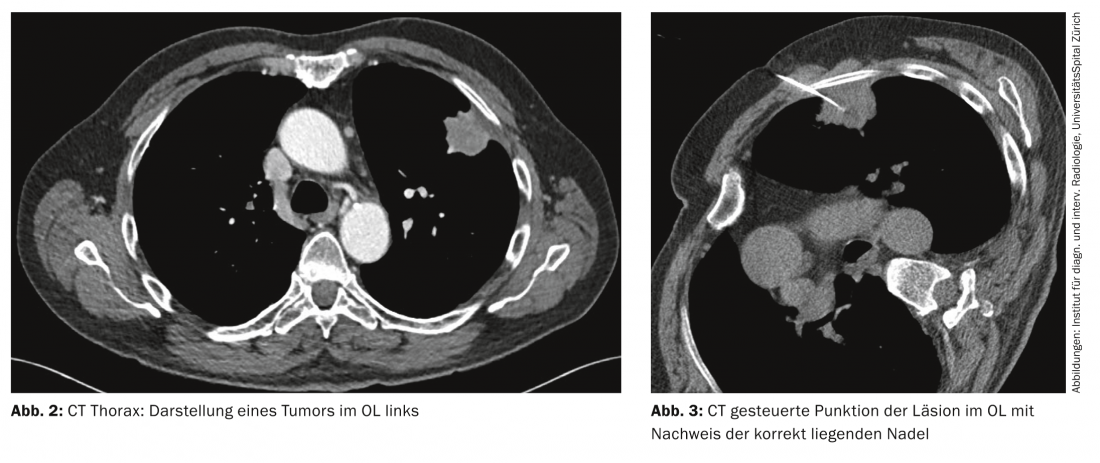
Tomodensitométrie : la tomodensitométrie thoracique à haute résolution est aujourd’hui la modalité d’imagerie de choix pour le diagnostic primaire d’un cancer du poumon présumé, notamment en raison de sa disponibilité rapide (Fig. 2).
La différenciation entre un stade tumoral T1 et T2, basée principalement sur la taille de la tumeur, est facilement réalisable par scanner, mais n’influence guère la stratégie thérapeutique ultérieure, alors que la précision pour différencier un stade T3 opérable d’un stade T4 non opérable n’est que faible [3].
Pour le staging ganglionnaire, la TDM a une précision diagnostique limitée avec une sensibilité de 51% et une spécificité de 86% [4], d’autant plus qu’elle se base uniquement sur des critères morphologiques tels que la forme et la taille, un ganglion lymphatique avec un diamètre de l’axe court >1 cm étant considéré comme métastatique. Ainsi, les critères purement morphologiques tels que la taille et la forme peuvent être appliqués aux métastases ganglionnaires, bien qu’ils ne soient finalement pas suffisants pour un diagnostic précis des métastases ganglionnaires médiastinales et nécessitent d’autres techniques d’imagerie plus sensibles telles que la TEP/TDM.
En cas de suspicion de cancer du poumon, il est recommandé, dans le cadre de l’imagerie primaire par scanner thoracique avec prise de contraste, d’ajouter un examen tomodensitométrique de la partie supérieure de l’abdomen pour évaluer la présence de métastases surrénaliennes ou hépatiques [4].
La biopsie guidée par scanner permet d’obtenir du matériel tumoral pour un traitement histologique et immunohistochimique. Elle est particulièrement adaptée aux tumeurs situées plutôt en périphérie (Fig. 3).
Imagerie par résonance magnétique : l’IRM peut être utilisée en conjonction avec le scanner pour faire le bilan de l’extension locale de la tumeur ou de la présence d’un cancer. être utilisé dans l’infiltration tumorale du médiastin, de la paroi thoracique, du diaphragme, des neuroforamens et du canal rachidien, ainsi que du plexus brachial dans les tumeurs de Pancoast. La technique de diffusion RM permet également de caractériser davantage le cancer du poumon et de distinguer les tumeurs centrales des atélectasies ou consolidations pulmonaires post-sténotiques.
L’IRM joue un rôle secondaire dans le staging ganglionnaire du médiastin et des hiles pulmonaires et est principalement utilisée pour résoudre les problèmes dans les cas incertains [5].
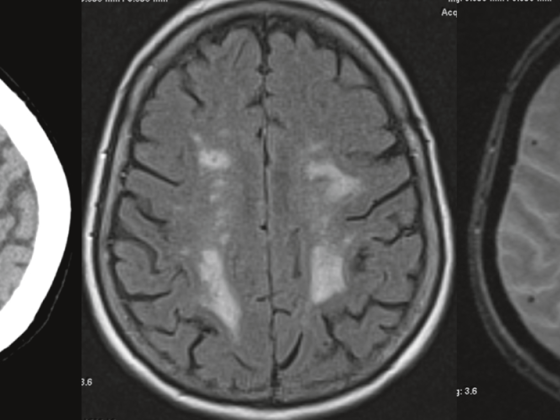
L’IRM est toutefois une modalité d’imagerie efficace pour l’évaluation des métastases cérébrales ou hépatiques [6]. L’IRM cérébrale est recommandée chez les patients présentant des symptômes neurologiques ou, selon les directives du NCCN [7], déjà chez les patients atteints d’une tumeur T2 (stade Ib) qui sont prévus pour un traitement curatif, mais devrait être effectuée en toute sécurité à partir d’un stade IIIA.
Tomographie par émission de positons/tomographie assistée par ordinateur intégrée : le PET/CT avec le traceur-18-fluoro-déoxy-glucose (FDG) fournit des informations supplémentaires importantes lors du staging préopératoire du cancer du poumon grâce à ses informations métaboliques, fonctionnelles et anatomiques. L’utilisation du PET/CT permet d’une part de confirmer le staging initial par tomodensitométrie et d’autre part de détecter des métastases ganglionnaires thoraciques faussement négatives en tomodensitométrie ou des métastases thoraco-abdominales occultes à distance (Fig. 4).
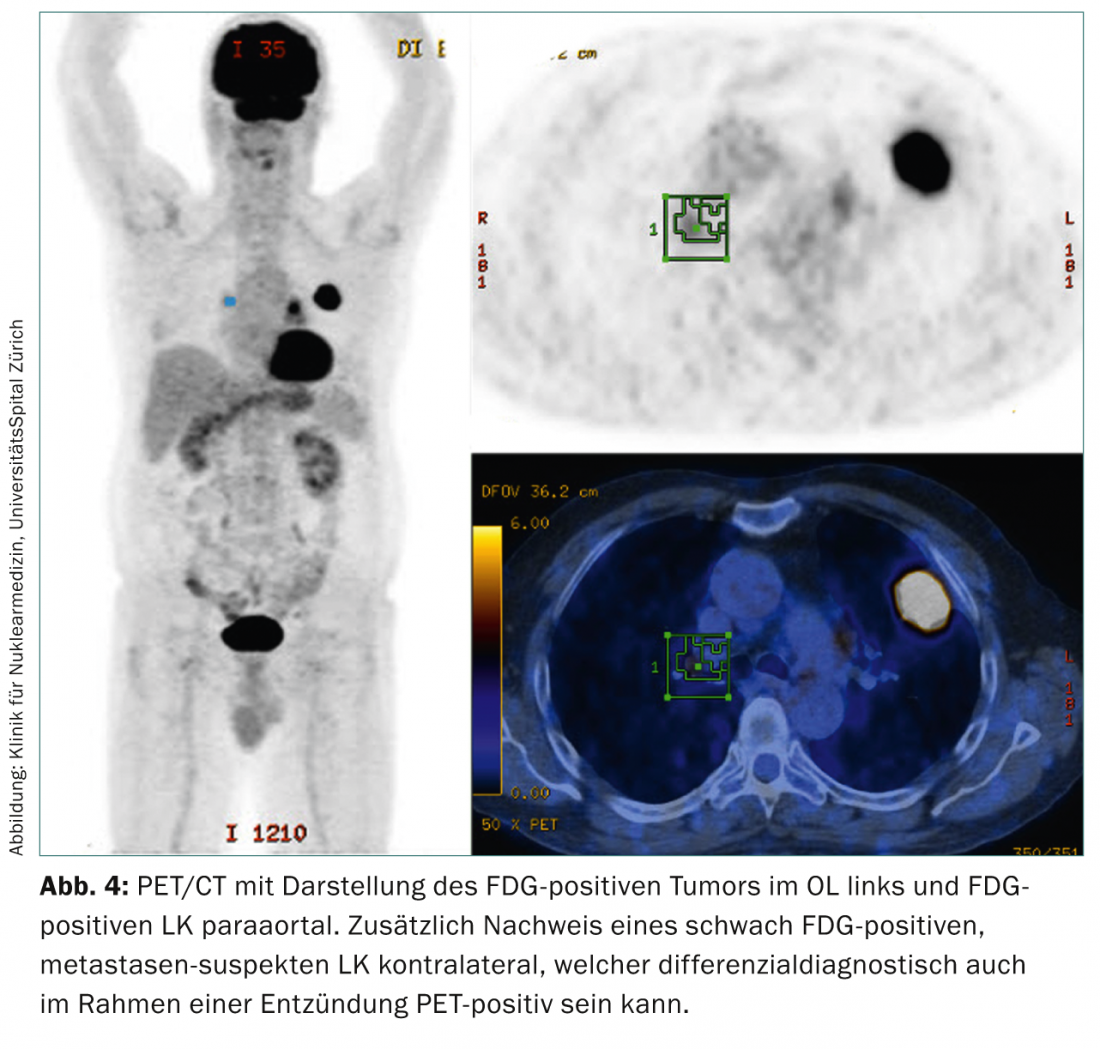
Avec sa valeur prédictive négative élevée ( >90% [8]), elle permet un staging ganglionnaire plus précis que le scanner ou le PET seul. Toutefois, les faux positifs peuvent être causés par une inflammation, une infection ou un infarctus. Il peut également y avoir des résultats faussement négatifs, qui doivent alors être explorés plus avant par un diagnostic invasif afin de confirmer le staging tomodensitométrique en cas de ganglions lymphatiques thoraciques hypertrophiés.
Dans le cadre de la recherche de métastases, la TEP/TDM permet de détecter les métastases thoraco-abdominales à distance inattendues et peut ainsi réduire le taux de métastases inutiles ou non détectées. jusqu’à 20% des thoracotomies non indiquées sur le plan thérapeutique [9]. Dans le cadre de l’examen d’éventuelles métastases cérébrales, la TEP/TDM au FDG n’est pas appropriée en raison du métabolisme physiologique élevé du glucose dans le cerveau et est ici clairement inférieure à l’IRM.
Scintigraphie osseuse : les études actuelles montrent que la TEP/TDM au FDG a une sensibilité et une précision comparables à celles de la scintigraphie osseuse, mais qu’elle apporte une meilleure spécificité en raison d’un taux de faux positifs nettement plus faible, qui peut atteindre 40% avec la scintigraphie osseuse. Ainsi, la scintigraphie osseuse ne joue qu’un rôle mineur dans le staging préopératoire du cancer du poumon.
Staging non invasif
Stade T : Le scanner est la méthode utilisée en premier lieu. Elle permet une différenciation claire entre T1 et T2, mais présente des faiblesses pour la différenciation entre T3 et T4. Dans ce cas, l’IRM doit être envisagée comme méthode alternative.
Stade N : Le PET/CT est la méthode de choix. Elle présente une sensibilité élevée, mais ne peut pas différencier les tumeurs des inflammations/infections. Le scanner a une spécificité élevée, mais une faible sensibilité.
Stade M : à ce stade, le PET/CT est la méthode de choix. A partir d’un stade tumoral T3, il est recommandé de réaliser une IRM du cerveau pour exclure la présence de métastases cérébrales. La scintigraphie osseuse joue un rôle mineur dans la détection des métastases osseuses.
Suivi des patients
Actuellement, il n’existe toujours pas de procédure claire pour le suivi des tumeurs traitées à titre curatif. Les directives de l’ACCP (“American College of Chest Physician”) prévoient, en cas de cancer bronchique non à petites cellules, un suivi par scanner thoracique tous les six mois pendant les deux premières années, puis un suivi annuel [10]. Pour les patients dont la tumeur n’a pas fait l’objet d’un traitement curatif primaire, les recommandations dépendent du type de thérapies, mais prévoient généralement une évolution de trois mois.
PD Dr. med. Thomas Frauenfelder
Dr. med. Stephan Baumüller
Littérature :
- Aberle DR, et al : National Lung Screening Trial Research T : Reduced lung-cancer mortality with low-dose computed tomographic screening. N Engl J Med 2011 ; 365(5) : 395-409.
- Bach PB, et al : Benefits and harms of CT screening for lung cancer : a systematic review. JAMA 2012 ; 307(22) : 2418-2429.
- Quint LE, et al : Stadification préopératoire du carcinome non à cellules malignes du poumon : méthodes d’imagerie. AJR Am J Roentgenol 1995 ; 164(6) : 1349-1359.
- Ravenel JG, et al : ACR Appropriateness Criteria(R) noninvasive clinical staging of bronchogenic carcinoma. J Thorac Imaging 2010 ; 25(4) : W107-111.
- Imai K, et al : Imagerie diagnostique dans la gestion préopératoire du cancer du poumon. Surg Today 2013.
- Tsim S, et al : Staging of non-small cell lung cancer (NSCLC) : a review. Respir Med 2010 ; 104(12) : 1767-1774.
- National Comprehensive Cancer Network Clinical Practice Guidelines in Oncology. Non-small Cell Lung Cancer, version 1.20142014. Disponible à l’adresse suivante : www.nccn.org/professionals/physician_gls/pdf/nscl.pdf.
- Vansteenkiste J, et al : La tomographie par émission de positrons dans l’évaluation pronostique et thérapeutique du cancer du poumon : revue systématique. Lancet Oncol 2004 ; 5(9) : 531-540.
- van Tinteren H, et al : Efficacité de la tomographie par émission de positons dans l’évaluation préopératoire des patients suspectés de cancer du poumon non à petites cellules : l’essai randomisé multicentrique PLUS. Lancet 2002 ; 359(9315) : 1388-1393.
- Rubins J, et al : Suivi et surveillance du patient atteint d’un cancer du poumon après un traitement curatif par intenta : ACCP evidence-based clinical practice guideline (2nd edition). Chest 2007 ; 132(3) : 355-367.
InFo ONKOLOGIE HÉMATOLOGIE 2014 ; 2(4) : 6-9