Lors de l’Update Refresher, une conférence a été consacrée à la BPCO et à l’emphysème pulmonaire. Il a montré quelles questions devraient être clarifiées dès le cabinet du médecin généraliste et comment le patient peut être soutenu de manière ciblée par des mesures pharmacologiques et de style de vie. Si les patients atteints d’emphysème restent symptomatiques malgré une prise en charge médicale optimale, la réduction du volume pulmonaire est une option thérapeutique possible. Différentes procédures endoscopiques se sont établies au cours des dernières années.
Six questions en particulier sont importantes pour le médecin généraliste en cas de BPCO, selon le Dr Lukas Schlatter, du cabinet de pneumologie de Wohlen :
- Mon patient est-il vraiment atteint de BPCO ?
- Si oui, de quel phénotype s’agit-il ?
- Mon patient fume-t-il (encore) ?
- Se déplace-t-il ?
- Inhale-t-il ? Si oui, avec quelle préparation et comment ?
- Faut-il faire appel à un pneumologue ?
Pour répondre à la première question, il est important d’établir un diagnostic différentiel précis, ce qui peut s’avérer difficile. Les principaux symptômes de la BPCO – toux, expectoration, obstruction, dyspnée et déficit en O2 – ouvrent un vaste champ de pathologies possibles. En cas de toux, d’expectoration et d’obstruction, on peut citer par exemple l’asthme bronchique, les bronchectasies ou l’insuffisance cardiaque. Cette dernière est également un diagnostic différentiel important en cas de dyspnée et de déficit en O2, tout comme l’hypertension artérielle pulmonaire (HTAP), la maladie coronarienne ou les troubles de la ventilation.
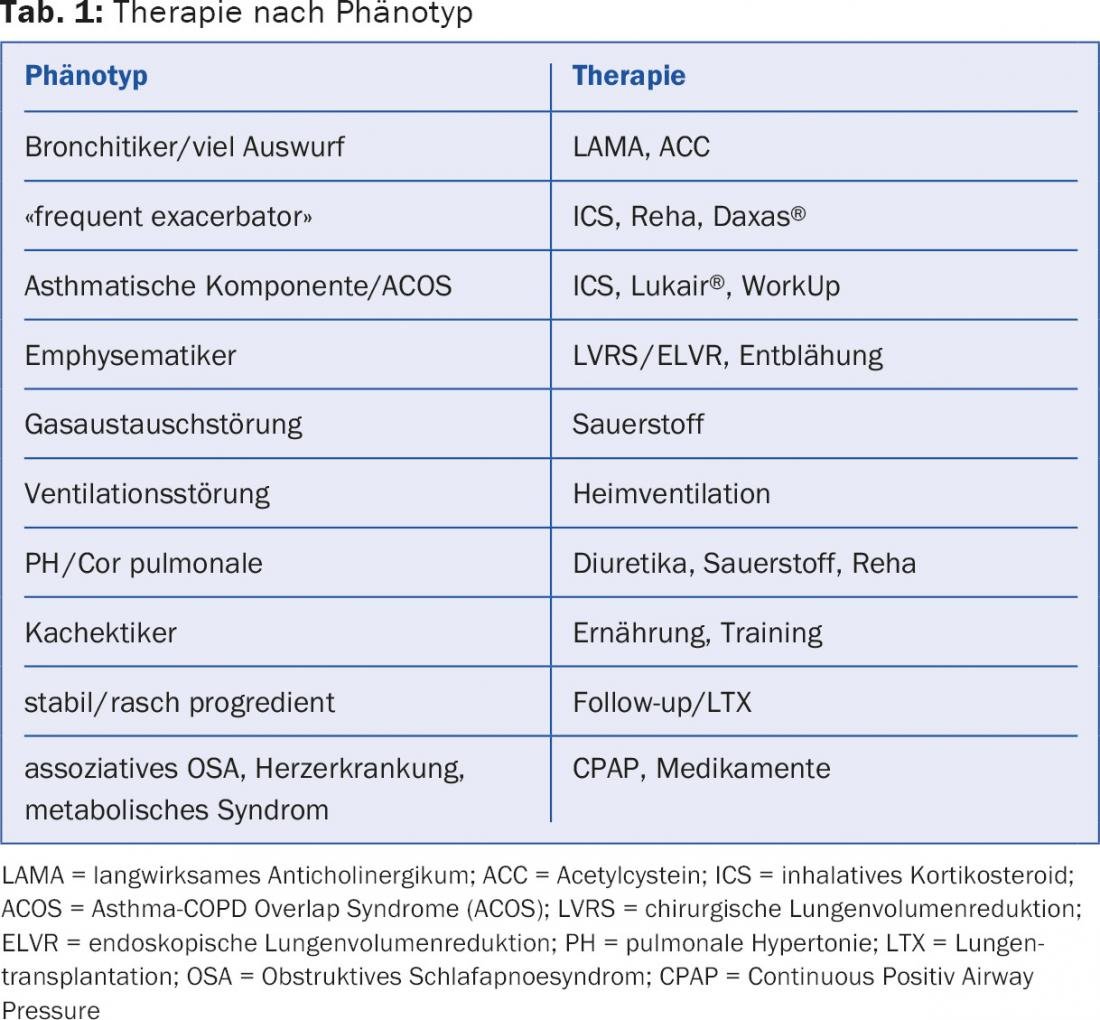
Différents agents et principes actifs sont utilisés en fonction du phénotype. Le tableau 1 en donne un aperçu.
Arrêter de fumer et faire de l’exercice à tout moment
“Arrêter de fumer ne réduit pas seulement le risque de développer une BPCO en premier lieu, c’est aussi la mesure la plus efficace pour tous les stades de la maladie déjà installée”, a déclaré l’orateur. “Cela permet de ralentir le déclin du VEMS et de réduire significativement la mortalité, qu’il s’agisse de celle liée à la BPCO elle-même ou de celle liée aux comorbidités associées [1–3].” Il est important d’aborder l’arrêt du tabac de manière ciblée lors de la consultation. Selon une étude [4], une consultation médicale minimale (“Fumez-vous ? Avez-vous déjà envisagé d’arrêter ?”) permet déjà d’atteindre des taux d’abstinence nettement plus élevés que la consultation standard. Le conseil intensif est encore plus efficace, par exemple via le modèle dit “par étapes du changement de comportement” de Prochaska et al. Mais c’est le conseil intensif combiné à la pharmacothérapie (p. ex. Zyban® ou Champix®) qui a le plus d’effet sur l’abstinence. L’effet impressionnant d’un arrêt du tabac peut être complété par une activité physique. Là encore, les preuves sont claires : l’exercice réduit la mortalité et le risque d’exacerbation [5–7].
Inhalativa
La grande variété d’inhalants ne facilite pas la prise de décision thérapeutique. Selon la nouvelle classification multidimensionnelle de la BPCO (dite règle ABCD), différents traitements de première ligne sont recommandés en fonction du degré de gravité :
- A : anticholinergique de courte durée d’action si nécessaire ou β-2-agoniste de courte durée d’action si nécessaire
- B : anticholinergique à longue durée d’action (LAMA) ou β-2-agoniste à longue durée d’action (LABA)
- C : corticostéroïde inhalé (CSI) + β-2-agoniste à longue durée d’action (LABA) ou anticholinergique à longue durée d’action (LAMA)
- D : corticostéroïde inhalé (CSI) + β-2-agoniste à longue durée d’action (LABA) ou anticholinergique à longue durée d’action (LAMA).
“Les nombreuses options alternatives (en première et deuxième ligne) rendent difficile le choix du meilleur traitement. L’approche individuelle, telle qu’elle est présentée dans le tableau 1 , offre une solution possible”, a conseillé le Dr Schlatter.
Le patient a-t-il besoin d’un pneumologue ?
Les points suivants sont facilement réalisables dans le cabinet du médecin généraliste : établir un diagnostic, évaluer la gravité, arrêter de fumer, établir des inhalants, vacciner, encourager l’activité et assurer le suivi. Dans le meilleur des cas, cela permet de contrôler les symptômes, d’éviter les exacerbations et de stabiliser l’évolution. La qualité de vie et les performances augmentent.
Mais si, après toutes ces mesures, le patient se sent toujours mal, il faut dans tous les cas envisager un concile pneumologique. Cela permet de réaliser des examens et des traitements ultérieurs spécifiques (p. ex. traitement de l’emphysème, transplantation).
Traitement de l’emphysème pulmonaire
Le Dr Peter Grendelmeier, chef de service de pneumologie à l’Hôpital universitaire de Bâle, a parlé de l’une de ces thérapies, à savoir la réduction du volume pulmonaire. Les patients éligibles pour cette thérapie sont principalement ceux que l’on appelle les “tampons roses” – typiquement des patients emphysémateux de faible poids présentant une dyspnée évidente et une toux sèche irritante. “Ce que nous recherchons, ce sont des signes de surgonflement”, a déclaré le Dr Grendelmeier. Dans la pléthysmographie corporelle, cela se traduit par une augmentation du volume résiduel (VR) ou du quotient du volume résiduel par rapport à la capacité pulmonaire totale (CPT) : Dans des poumons normaux, la capacité vitale est d’environ 65% et le volume résiduel de 35% – dans des poumons surgonflés, les valeurs peuvent être d’environ 50% à 50%.
Réduction chirurgicale du volume pulmonaire : la grande étude NETT [8] menée en 2003 a montré que la réduction chirurgicale du volume pulmonaire était particulièrement bénéfique pour les patients qui présentaient principalement un emphysème du lobe supérieur et une faible capacité de base. Dans ce cas, le risque de mortalité était nettement réduit. En revanche, les personnes opérées qui ne souffraient pas d’emphysème accentué par le lobe supérieur et qui étaient très performantes présentaient un taux de mortalité significativement plus élevé que le groupe de comparaison sous traitement médicamenteux. En particulier, les personnes ayant un VEMS <20% cible et une capacité de diffusion du CO (DLCO) <20% cible ou un emphysème homogène ont obtenu des résultats nettement moins bons avec la chirurgie que le groupe témoin non opéré. Les avantages et les risques de la réduction chirurgicale du volume pulmonaire sont présentés dans le tableau 2.

Réduction endoscopique du volume pulmonaire : avec les nouvelles techniques telles que les valves, les coils ou les stents, la question s’est posée de savoir s’il fallait vraiment un scalpel pour réduire le volume pulmonaire ou si un endoscope suffisait. Dans le domaine des coils, une étude de 2012 [9] a montré que le test de marche de 6 minutes et la qualité de vie liée à la maladie pouvaient notamment être améliorés de manière significative. Les effets secondaires potentiellement associés à la procédure ou au dispositif comprenaient, jusqu’à 30 jours après l’opération, un pneumothorax, une pneumonie, des exacerbations, une douleur thoracique et (le plus souvent) une hémoptysie légère <5 ml. Après ce mois, on trouvait encore principalement des pneumonies et des exacerbations de BPCO. Les effets secondaires étaient réversibles sous les mesures de soins standard.
Sélection des patients
Selon le Dr Grendelmeier, la décision sur la possibilité et le type de réduction du volume pulmonaire doit être prise de manière interdisciplinaire. Les questions suivantes peuvent par exemple être utilisées pour la sélection des patients :
- Le patient est-il sous anticoagulant ?
- Existe-t-il une ventilation collatérale ?
- Quelles sont les comorbidités existantes ?
- Existe-t-il, par exemple, une hypertension pulmonaire ?
- S’agit-il d’une st. après réduction chirurgicale du volume pulmonaire ?
- S’agit-il d’un emphysème sévère avec absence de tissu ?
- S’agit-il d’un emphysème homogène ?
- Qu’en est-il de la réversibilité de la thérapie ?
Selon que la réponse à ces questions est oui ou non, on procède à une réduction du volume pulmonaire par voie chirurgicale, endoscopique ou pas du tout. “En principe, il faut penser à une réduction chez les ‘pink puffers’ après un traitement maximal ou optimal (pharmacologique, oxygène à domicile, réadaptation), qui ont un volume résiduel de >175% de consigne et une BPCO GOLD stade III/IV”, a conclu l’orateur.
Source : “Diagnostic et possibilités de traitement de la BPCO et de l’emphysème pulmonaire”, présentation lors de l’Update Refresher Innere Medizin, 16-20 juin 2015, Zurich
Littérature :
- Anthonisen NR, et al. : Effects of smoking intervention and the use of an inhaled anticholinergic bronchodilator on the rate of decline of FEV1. L’étude sur la santé des poumons. JAMA 1994 Nov 16 ; 272(19) : 1497-1505.
- Anthonisen NR1, Connett JE, Murray RP : Smoking and lung function of Lung Health Study participants after 11 years. Am J Respir Crit Care Med 2002 Sep 1 ; 166(5) : 675-679.
- Anthonisen NR, et al : The effects of a smoking cessation intervention on 14.5-year mortality : a randomized clinical trial. Ann Intern Med 2005 Feb 15 ; 142(4) : 233-239.
- Hoogendoorn M, et al : Efficacité à long terme et rentabilité des interventions de cessation du tabagisme chez les patients atteints de BPCO. Thorax 2010 août ; 65(8) : 711-718.
- Garcia-Aymerich J, et al : Regular physical activity reduces hospital admission and mortality in chronic obstructive pulmonary disease : a population based cohort study. Thorax 2006 Sep ; 61(9) : 772-778.
- Waschki B, et al : L’activité physique est le prédicteur le plus fort de la mortalité toutes causes chez les patients atteints de BPCO : une étude de cohorte prospective. Chest 2011 Aug ; 140(2) : 331-342.
- Gimeno-Santos E, et al : Déterminants et résultats de l’activité physique chez les patients atteints de BPCO : une revue systématique. Thorax 2014 Aug ; 69(8) : 731-739.
- Fishman A, et al : A randomized trial comparing lung-volume-reduction surgery with medical therapy for severe emphysema. N Engl J Med 2003 May 22 ; 348(21) : 2059-2073.
- Slebos DJ, et al : Bronchoscopic lung volume reduction coil treatment of patients with severe heterogeneous emphysema. Chest 2012 Sep ; 142(3) : 574-582.
PRATIQUE DU MÉDECIN DE FAMILLE 2015 ; 10(10) : 33-25