La fibrillation auriculaire est le trouble du rythme persistant le plus fréquent. La prévalence dans la population générale est de 1,5 à 2 % [1]. Avec un risque d’AVC multiplié par cinq et un risque de décompensation cardiaque multiplié par trois, la fibrillation auriculaire est une cause fréquente d’hospitalisation et est associée à une morbidité et une mortalité accrues [2]. Comment se déroule le diagnostic et que peut-on obtenir au moyen d’une anticoagulation et d’une rythmicité ? L’article suivant vise à répondre à ces questions.
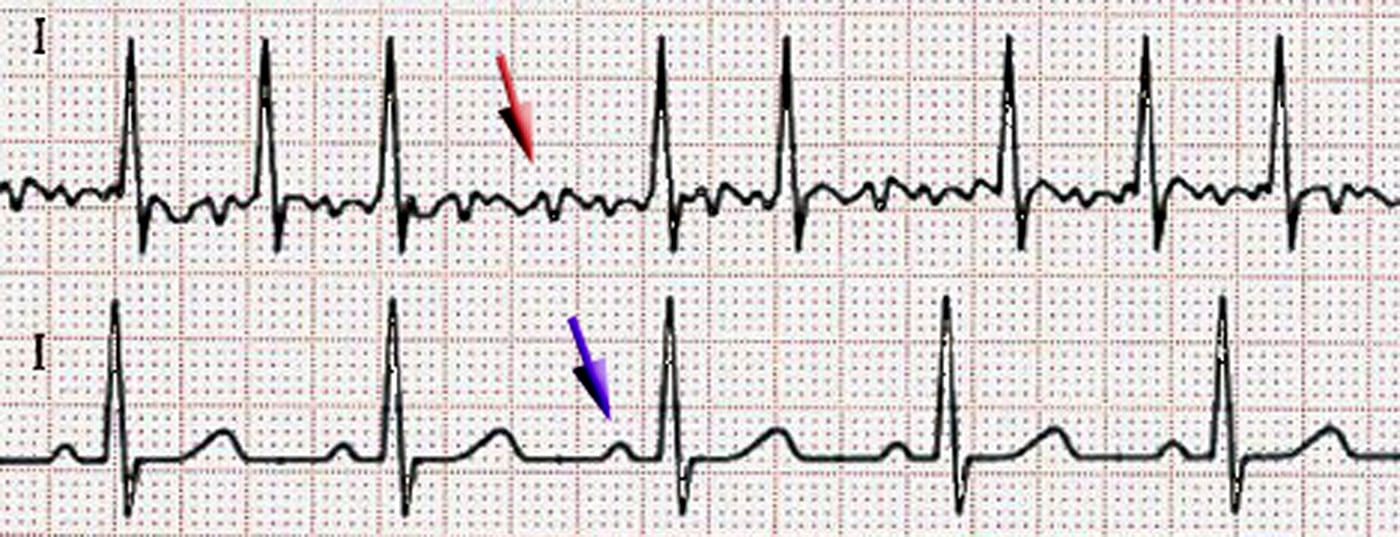
Le diagnostic d’une fibrillation auriculaire nécessite soit la documentation d’une arythmie absolue sans ondes P pendant 30 secondes sur un monitoring ECG, soit sur un ECG 12 dérivations [3], une documentation ECG est donc obligatoire. Selon la durée de l’épisode de fibrillation auriculaire, on parle de fibrillation auriculaire paroxystique, persistante ou permanente. Un diagnostic précoce permet de prévenir les complications de la fibrillation auriculaire. La fibrillation auriculaire devenant de plus en plus fréquente avec l’âge, il est recommandé de procéder à un dépistage par palpation du pouls chez tous les patients de plus de 65 ans. Si un pouls irrégulier est constaté, un ECG de repos doit être effectué pour confirmer le diagnostic ou le traitement. pour les différencier des autres arythmies (par ex. extrasystolie ou flutter auriculaire) [2].
Anticoagulation
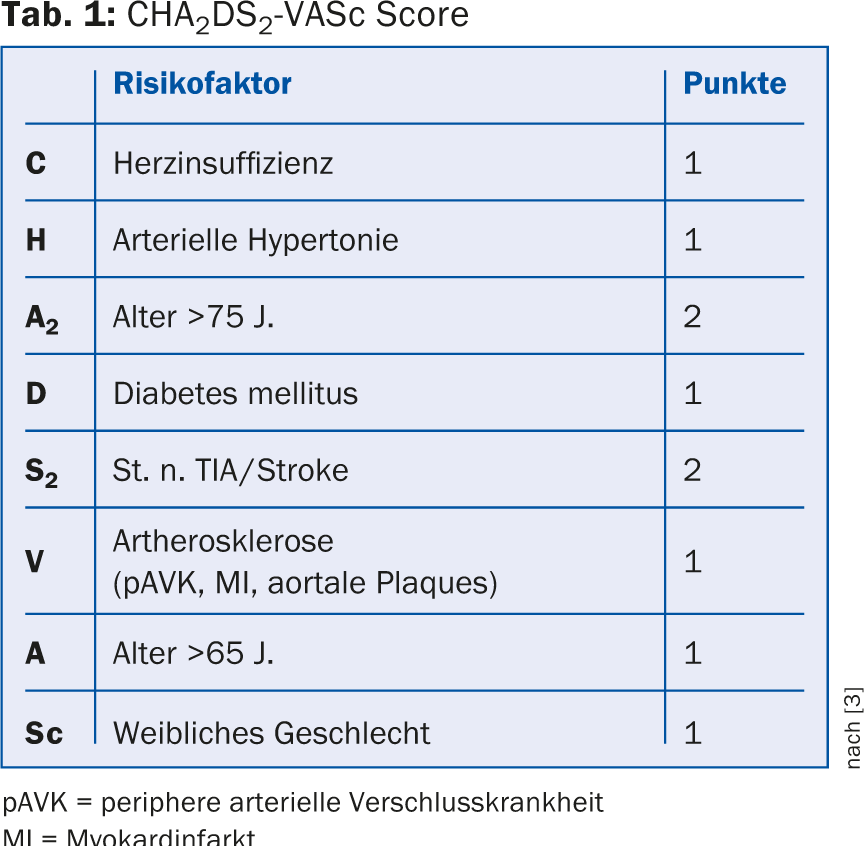
L’indication d’une anticoagulation orale (ACO) en cas de fibrillation auriculaire est posée selon le score CHA2DS2-VASc (tableau 1), tous les patients avec un point ≥1 nécessitant une ACO [3]. Chez les patients ayant un score CHA2DS2-VASc de 0 point ou les femmes de moins de 65 ans sans autre facteur de risque, le risque d’embolie est si faible qu’il est préférable de ne pas recourir à l’anticoagulation [2]. Les antiagrégants plaquettaires ne sont actuellement plus recommandés pour la prévention des embolies. En pratique clinique quotidienne, les antiplaquettaires sont parfois utilisés à la place d’un ACO chez des patients âgés et fragiles ayant une tendance accrue à la chute par crainte d’une hémorragie intracrânienne. Cependant, ces patients présentent également un risque élevé d’accident vasculaire cérébral ischémique, contre lequel les ACO offrent une meilleure protection [3,4]. Par exemple, l’étude AVERROES a montré que l’apixaban était nettement supérieur à l’acide acétylsalicylique dans la prophylaxie des AVC ischémiques [5]. De plus, aucune différence significative dans la survenue d’hémorragies intracrâniennes n’a été démontrée à ce jour sous antiplaquettaires par rapport aux antagonistes de la vitamine K [6]. Ainsi, les antiagrégants plaquettaires ne devraient être utilisés pour la prévention des embolies que chez les patients qui refusent toute autre forme d’ACO [2].
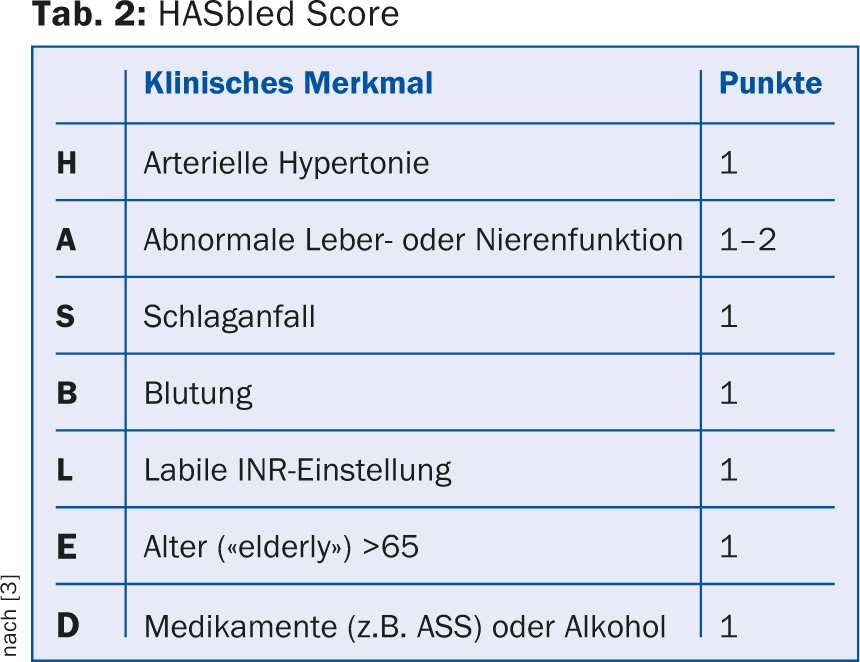
Le risque individuel de saignement peut être calculé à l’aide de différents systèmes de score, par exemple le score HASbled (tableau 2). Un score de saignement élevé ne doit cependant pas être automatiquement considéré comme une contre-indication aux ACO. Au contraire, en cas de risque hémorragique élevé, il convient de s’attaquer systématiquement à tous les facteurs de risque d’hémorragie pouvant être traités, par exemple en ajustant une hypertension artérielle, en passant aux nouveaux anticoagulants (NOAK) en cas d’INR instable, en renonçant à une co-médication par des anti-inflammatoires non stéroïdiens (AINS) et des antiagrégants plaquettaires, sauf si celle-ci est absolument nécessaire.
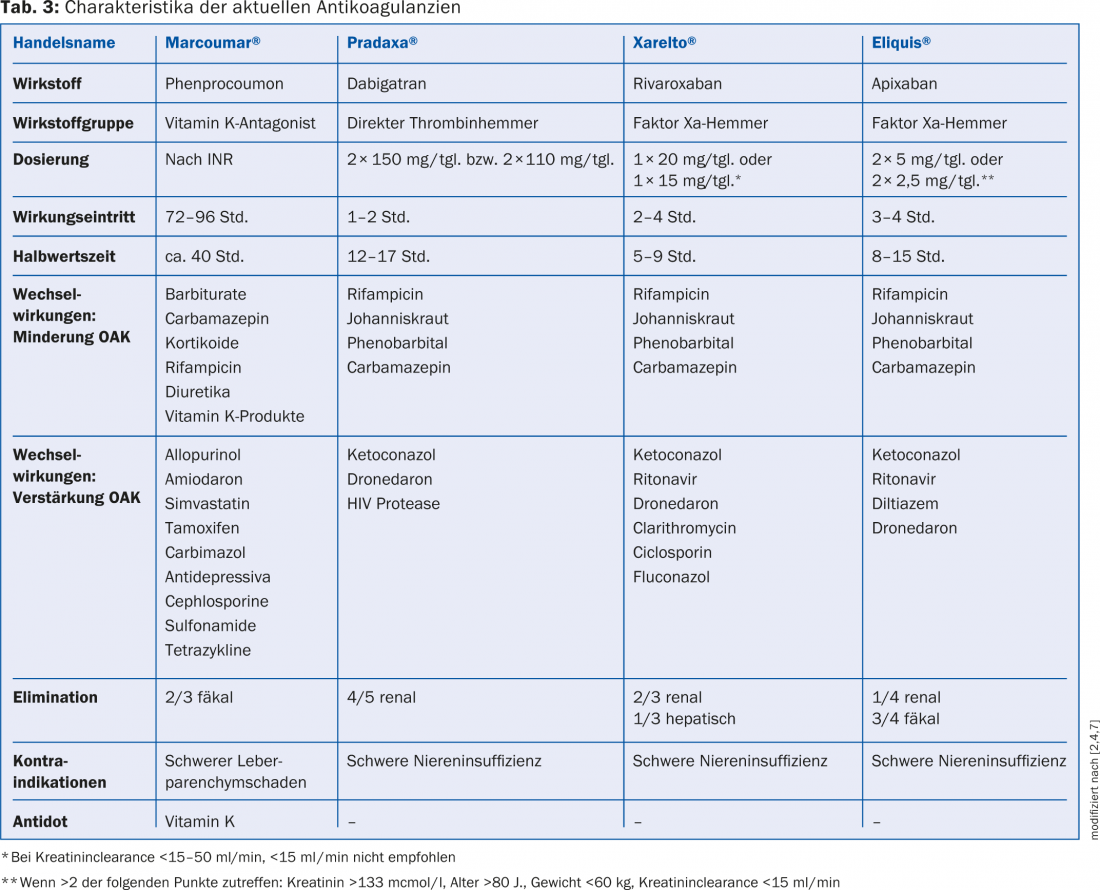
Antagonistes de la vitamine K (AVK) et NOAK : les antagonistes de la vitamine K, l’acénocoumarol (Sintrom®) et la phenprocoumone (Marcoumar®), sont les plus utilisés en Suisse et constituent également à ce jour la seule option d’anticoagulation en cas de prothèse valvulaire mécanique, de fibrillation auriculaire valvulaire et chez les patients souffrant d’insuffisance rénale sévère. Pour la prévention des embolies en cas de fibrillation auriculaire non valvulaire, les trois NOAK (rivaroxaban, dabigatran et apixaban) n’étaient pas inférieurs aux AVK dans les grandes études cliniques de phase III et présentaient en outre un meilleur profil de sécurité. À partir d’un score CHA2DS2-VASc ≥2 points, les trois NOAK étaient même supérieurs aux AVK en termes de prophylaxie des AVC ischémiques et d’incidence des hémorragies intracrâniennes [2], raison pour laquelle ils sont actuellement recommandés comme forme préférée d’anticoagulation [7]. Les caractéristiques de chaque NOAK et les principales interactions médicamenteuses sont présentées dans le tableau 3. La figure 1 donne un aperçu des populations de patients appropriées pour les NOAK ou les AVK.
Occlusion de l’oreillette : plus de 90% des thrombus chez les patients atteints de fibrillation auriculaire non valvulaire se forment dans l’oreillette gauche [8]. Il est possible de procéder à une fermeture chirurgicale ou interventionnelle de l’oreillette. Les études rétrospectives et d’observation ont donné des résultats incohérents concernant la fermeture chirurgicale de l’oreillette [2]. Pour la fermeture interventionnelle de l’oreillette, il existe deux systèmes de fermeture différents, le dispositif Watchman® et l’Amplatzer Cardiac Plug®, qui sont placés par voie transseptale dans l’oreillette gauche à partir de l’oreillette droite. Des études prospectives randomisées sont actuellement en cours (PROTECT AF, PREVAIL). En l’état actuel des données, l’occlusion de l’oreillette ne doit être évaluée qu’en cas de risque thromboembolique élevé et de contre-indication concomitante aux ACO [2].
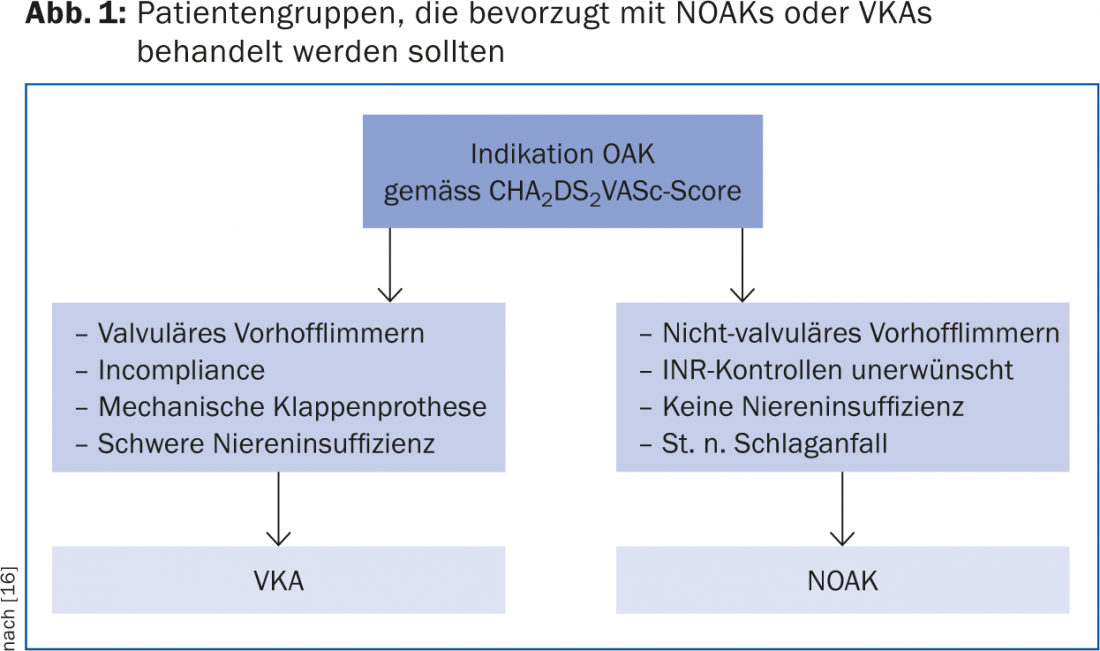
Rythme ou contrôle de la fréquence ?
Jusqu’à présent, aucune différence significative en termes de mortalité ou de taux d’AVC n’a été trouvée entre les patients sous contrôle de fréquence ou de rythme [9]. La question de savoir si un contrôle de la fréquence ou du rythme doit être envisagé dans un cas particulier dépend en grande partie de la symptomatologie et de la volonté du patient de prendre une médication permanente, qui peut avoir des effets secondaires, ou d’accepter une intervention. La figure 2 présente un algorithme possible pour la décision thérapeutique concernant le contrôle du rythme ou de la fréquence.
Symptômes de la fibrillation auriculaire : Les symptômes typiques de la fibrillation auriculaire sont causés par une altération de l’hémodynamique. Le remplissage ventriculaire irrégulier entraîne des palpitations et un déficit de pouls périphérique. La perte de contraction auriculaire associée à un remplissage ventriculaire raccourci en cas de tachycardie peut entraîner une diminution du “cardiac output” de 5 à 15%, ce qui peut provoquer une dyspnée, une intolérance à l’effort, une hypotension et des vertiges, voire des présyncopes. Les patients présentant une compliance VG réduite (par exemple une hypertrophie du VG en cas d’hypertension artérielle ou de sténose valvulaire aortique sévère) ou une insuffisance cardiaque sévère préexistante tolèrent particulièrement mal ces modifications hémodynamiques. La diastole étant raccourcie pendant une tachycardie, le flux coronaire est réduit et des troubles de l’AP peuvent survenir, en particulier en cas de sclérose coronaire préexistante [3]. Tous les symptômes énumérés ici peuvent également être la première manifestation d’une fibrillation auriculaire et, s’ils sont inexpliqués, doivent conduire à un diagnostic par ECG.
Contrôle de la fréquence: de nombreux symptômes de la fibrillation auriculaire peuvent être minimisés par un bon contrôle de la fréquence. En outre, une cardiomyopathie induite par la tachycardie peut survenir en cas de fréquences ventriculaires persistantes >120 bpm (battements par minute = fréquence cardiaque). La normalisation de la fréquence cardiaque entraîne généralement une récupération de la fonction VG [10]. Initialement, il convient de viser une fréquence de repos <110/min. Si la fibrillation auriculaire reste symptomatique, un contrôle plus strict de la fréquence <80 bpm au repos et <110 bpm en charge doit être recherché [3]. Pour vérifier la sécurité et l’efficacité d’un contrôle de fréquence, un monitorage ECG de 24 heures doit être effectué après l’adaptation du traitement. Chez les patients plus jeunes, les bêtabloquants et les antagonistes calciques de type non dihydropyridine sont préférables, car ils régulent la fréquence cardiaque au repos et à l’effort [3]. La prudence est de mise chez les patients présentant une préexcitation, qui peut ne pas être visible sur l’ECG 12 dérivations. L’administration de médicaments bradycardisants ralentit la conduction du nœud AV, mais n’affecte pas la conduction auriculaire. Ainsi, si une voie accessoire est présente, il peut y avoir une transmission non freinée des fréquences auriculaires rapides vers les ventricules [3].
L’ablation du nœud AV : l’ablation du nœud AV consiste à scléroser le nœud AV sous contrôle du cathéter après l’implantation d’un stimulateur cardiaque afin de provoquer un bloc AV total. Chez les patients atteints de fibrillation auriculaire symptomatique qui ne parviennent pas à contrôler leur fréquence, même avec un traitement médicamenteux combiné, l’ablation du nœud AV est une option de traitement définitive et fiable. Elle entraîne une amélioration de la qualité de vie et est associée à une augmentation de la fonction du VG [11].
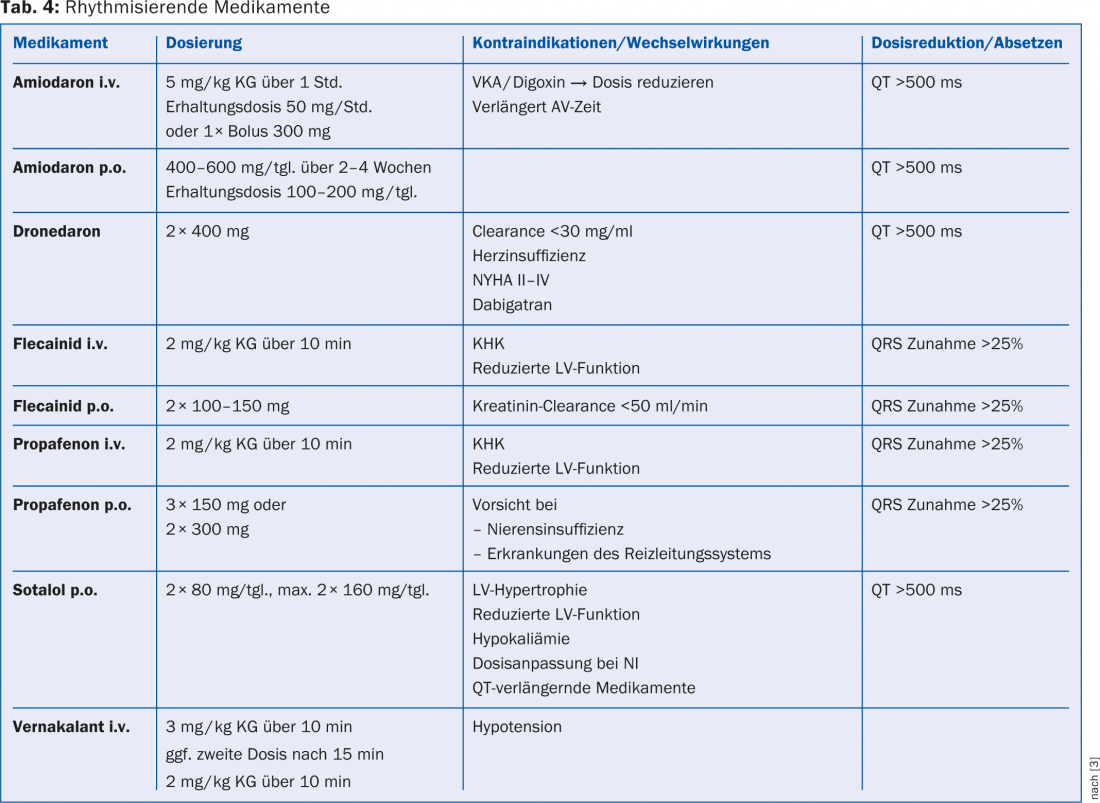
Indications pour le contrôle du rythme : si un patient est symptomatique même sous contrôle strict de la fréquence, le contrôle du rythme doit être recherché. En cas d’instabilité hémodynamique, celle-ci peut être provoquée par cardioversion dans la situation aiguë. Pour le traitement à long terme, il existe l’ablation par cathéter ou un traitement médicamenteux antiarythmique continu. Si une fibrillation auriculaire <existe depuis 48 heures, le traitement peut être commencé sans délai. Toutefois, si le score CHA2DS2-VASc est ≥1, il est indiqué de commencer simultanément une anticoagulation thérapeutique. Si la fibrillation auriculaire existe >48 heures, il faut exclure la présence de thrombus intracardiaques par échocardiographie transoesophagienne (ETO) avant de commencer un traitement rythmisant, ou bien il faut administrer une anticoagulation thérapeutique pendant trois semaines [3]. Quelle que soit la méthode de rythmicité choisie, un monitoring ECG doit être effectué périodiquement afin de vérifier le succès du traitement [3]. Une vue d’ensemble des médicaments et des doses respectives qui conviennent pour la rythmisation est disponible à l’adresse suivante Tableau 4 : Si un traitement rythmique est préféré à un contrôle de la fréquence, il doit être commencé le plus tôt possible après le diagnostic de la fibrillation auriculaire, car le maintien du rythme sinusal est d’autant plus difficile que la fibrillation auriculaire est présente depuis longtemps [12,13].
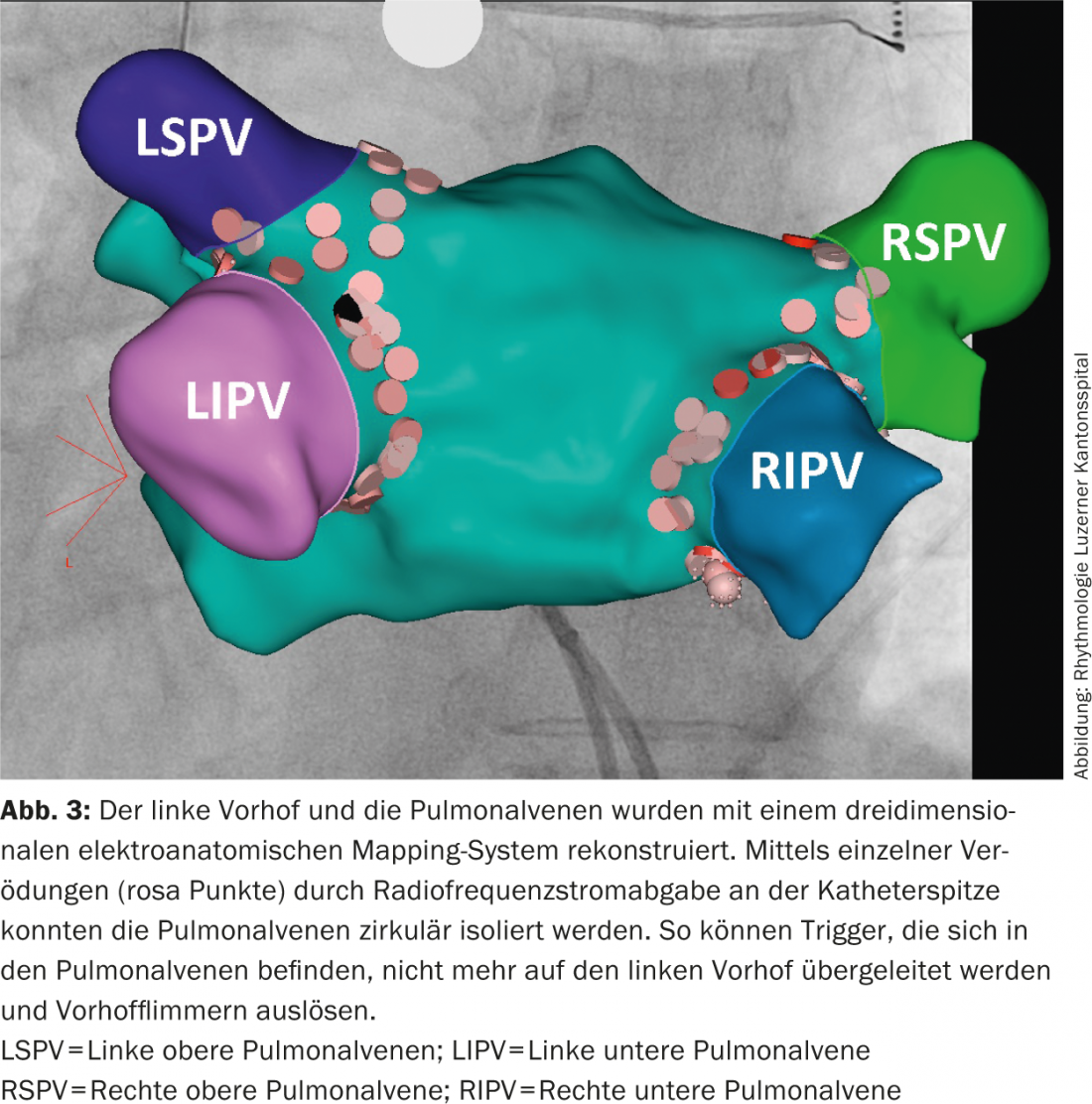
Traitement médicamenteux à long terme vs. ablation : chez les patients symptomatiques souffrant de fibrillation auriculaire, l’ablation par cathéter peut être proposée comme alternative au traitement médicamenteux par antiarythmiques en tant que traitement de première ligne (Fig. 3) [2]. Lorsqu’une ablation de fibrillation auriculaire est réalisée dans un centre expérimenté, davantage de patients présentent un rythme sinusal stable après l’ablation par cathéter que sous traitement antiarythmique à long terme et font état d’une meilleure qualité de vie [14,15]. L’ablation par cathéter est également une bonne alternative en cas d’échec ou d’intolérance à un traitement antiarythmique. L’ablation est un traitement efficace, en particulier chez les patients sans cardiopathie structurelle et dont la fibrillation auriculaire n’est que paroxystique ou persiste depuis moins d’un an.
Littérature :
- Heeringa J, et al : Prévalence, incidence et risque à vie de fibrillation auriculaire : l’étude de Rotterdam. Eur Heart J 2006 ; 27 : 949-953.
- Camm AJ, et al : 2012 focused update of the ESC Guidelines for the management of atrial fibrillation. An update of the 2010 ESC Guidelines for the management of atrial fibrillation. Eur Heart J 2012 ; 33 : 2719-2747.
- Camm AJ, et al : Guidelines for the management of atrial fibrillation : the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC).European Heart Rhythm Association ; European Association for Cardio-Thoracic Surgery. Eur Heart J 2010 Oct ; 31(19) : 2369-2429.
- Van Walraven C, et al : Effect of age on stroke prevention therapy in patients with atrial fibrillation. Accident vasculaire cérébral 2009 ; 40 : 1410-1416.
- Coppens M, et al : Efficacité et sécurité de l’apixaban par rapport à l’aspirine chez les patients ayant déjà essayé mais échoué à un traitement par antagonistes de la vitamine K : résultats de l’étude AVERROES. Eur Heart J 2014 Jul 21 ; 35(28) : 1856-1863.
- Mant J, et al : Warfarinvversus aspirin for stroke prevention in an elderly community populationvwith atrial fibrillation (the Birmingham Atrial Fibrillation Treatment of thevAged Study, BAFTA) : a randomised controlled trial. Lancet 2007 ; 370 : 493-503.
- Heidbuchel H, et al : EHRA practical guide on the use of new oral anticoagulants in patients with non-valvular atrial fibrillation : executive summary. European Heart Journal 2013 ; 34 : 2094-2106.
- Watson T, Shantsila E, Lip GY : Mechanisms of thrombogenesis in atrial fibrillation : Virchow’s triad revisited. Lancet 2009 ; 373 : 155-166.
- AFFIRM Investigators : A comparison of rate control and rythm control in patients with atrial fibrillation. N Engl J Med 2002 ; 347 : 1825-1833.
- Packer DL, et al. : Tachycardia-induced cardiomyopathy : a reversible form of left ventricular dysfunction. Am J Cardiol 1986 ; 57 : 563-570.
- Kay GN, et al. : The Ablate and Pace Trial : a prospective study of catheter ablation of the AV conduction system and permanent pacemaker implantation for treatment of atrial fibrillation. Les investigateurs de l’APT. Interv Card Electrophysiol 1998 Jun ; 2(2) : 121-135.
- Cosio FG, et al : Le retard dans le contrôle du rythme de la fibrillation auriculaire peut être une cause d’échec pour prévenir les récurrences : les raisons du changement pour un traitement antiarythmique actif au moment du premier épisode détecté. Europace 2008 ; 10 : 21-27.
- Kirchhof P : Peut-on améliorer les résultats chez les patients atteints de fibrillation auriculaire grâce à un traitement précoce ? BMC Med 2009 ; 7 : 72.
- Cosedis Nielsen J, et al : Ablation par radiofréquence comme traitement initial de la fibrillation auriculaire paroxystique. N Engl J Med 2012 ; 367(17) : 1587-1595.
- Wazni OM, et al : Radiofrequency ablation vs antiarrhythmic drugs as firstline treatment of symptomatic atrial fibrillation : A randomized trial. JAMA 2005 ; 293 : 2634-2640.
- Steinberg BA, Pinccini JP : Anticoagulation in atrial fibrillation. BMJ 2014 ; 348 : g2116.
CONCLUSION POUR LA PRATIQUE
- Tous les patients de plus de 65 ans doivent être dépistés pour la fibrillation auriculaire par palpation du pouls. Si le pouls est irrégulier, le diagnostic doit être vérifié par ECG.
- Tout patient de plus de 65 ans souffrant de fibrillation auriculaire a une indication d’anticoagulation orale (ACO).
- Les patients ayant un score CHA2DS2VAScde 0 point n’ont pas besoin d’ACO ni d’antiagrégants plaquettaires pour la prophylaxie de l’embolie. Le sexe féminin à un âge inférieur à 65 ans et l’absence d’autres facteurs de risque ne justifient pas un TOC.
- En cas de fibrillation auriculaire asymptomatique, il convient de viser une fréquence <110/min au repos et de la contrôler au moyen d’un Holter ECG. En cas de détérioration des performances sous fibrillation auriculaire, il faut penser à une cardiomyopathie induite par la tachycardie. Chez les patients symptomatiques, la fréquence de repos doit être <80/min.
- En cas de fibrillation auriculaire symptomatique, un contrôle du rythme doit être recherché. En cas de fibrillation auriculaire paroxystique sans cardiopathie structurelle, les directives actuelles permettent d’effectuer une ablation par radiofréquence de la fibrillation auriculaire comme traitement de première ligne.
PRATIQUE DU MÉDECIN DE FAMILLE 2014 ; 9 (9) : 11-17