La cardiopathie multiviscérale est une pathologie fréquente dont l’incidence va augmenter en raison de l’évolution démographique. L’association la plus fréquente est celle d’un rétrécissement aortique et d’une insuffisance valvulaire mitrale. La coopération entre les cardiologues et les chirurgiens cardiaques au sein de l’équipe de cardiologie joue un rôle crucial dans le traitement.
Une maladie cardiaque multivalvulaire (“multivalvular disease”, MVD) désigne l’association de vices valvulaires (sténose ou insuffisance) sur deux ou plusieurs valves cardiaques [1]. Elle a une prévalence élevée. Dans l’Euro Heart Survey, qui a recueilli des données sur plus de 5 000 patients dans 25 pays, 20,2% des patients atteints de valvulopathie native avaient une MVD [2]. L’âge moyen des patients était de 64 ans et 83,6% étaient des hommes. Dans les études PARTNER, environ 20% des patients présentant une sténose aortique sévère (SA) présentaient une insuffisance valvulaire mitrale (IVM) modérée à sévère concomitante [3]. Pendant longtemps, la majorité des MVD étaient d’origine rhumatismale [4]. Actuellement, en raison de la diminution de la fréquence du rhumatisme articulaire aigu d’une part et de l’augmentation de la population vieillissante d’autre part, il apparaît que les valvulopathies dégénératives représentent une part croissante des causes de MVD. Dans l’Euro Heart Survey, la dégénérescence était l’étiologie nettement la plus fréquente, avec 82% pour la SA et 61% pour l’IM [5].
Physiopathologie
L’expression clinique de la MVD dépend de nombreux facteurs et peut être très complexe. Il s’agit notamment de la gravité de chaque défaut valvulaire, de la combinaison des valves cardiaques concernées, du type de valvulopathie (primaire ou secondaire), des effets hémodynamiques et des mécanismes de compensation ventriculaire. La gravité et la symptomatologie clinique peuvent varier si l’hémodynamique est modifiée ou si l’un des défauts valvulaires est traité. Cette physiopathologie complexe et dynamique fait du diagnostic et du traitement des MVD un très grand défi.
L’AS et l’IM s’influencent mutuellement et peuvent, entre autres, amplifier les effets hémodynamiques de l’autre défaillance valvulaire.
La SA entraîne une augmentation de la postcharge et, par la suite, une hypertrophie du ventricule gauche. La pression exercée sur le ventricule gauche peut entraîner un dysfonctionnement systolique, une dilatation de l’annulus de la valve mitrale et, par conséquent, une IM fonctionnelle (secondaire) [6]. La pression exercée par une AS peut aggraver une IM existante. La SA est souvent associée à une maladie coronarienne, car les deux sont dues aux mêmes processus d’artériosclérose systémique. La survenue d’une IM fonctionnelle d’origine ischémique due à une maladie coronarienne est donc une autre genèse [7]. Dans ce cas, la fonction valvulaire est altérée par un dysfonctionnement des muscles papillaires et des parties adjacentes du myocarde. En outre, il peut bien sûr y avoir une combinaison de SA et d’IM dégénérative.
L’IM concomitante peut aggraver l’expression clinique de la SA. L’augmentation de la résistance à l’éjection due à l’AS favorise le reflux systolique à travers la valve mitrale non étanche [8]. Cela réduit encore plus le volume sanguin éjecté à l’antegrade et augmente la défaillance du ventricule gauche vers l’avant. L’IM conditionne un “état de bas débit” sur la valve aortique [6]. Une fibrillation auriculaire est souvent associée à l’IM, ce qui peut aggraver la symptomatologie clinique de la SA, car l’absence de contraction auriculaire synchrone et la fréquence cardiaque élevée réduisent le remplissage diastolique du VG. La fibrillation auriculaire est mal tolérée par les patients atteints de SA, ce qui entraîne souvent une décompensation. Même en l’absence d’IM, la fibrillation auriculaire entraîne une augmentation de la mortalité chez les patients atteints de SA [9].
Diagnostic
Le diagnostic et l’évaluation des valves cardiaques en cas de MVD sont nettement plus difficiles en raison de l’altération de l’hémodynamique [6]. Lors de l’examen clinique, l’auscultation peut être mal interprétée car les bruits cardiaques sont modifiés dans le temps et dans leur intensité. D’autres signes, comme la courbe de pouls, peuvent également se révéler atypiques par rapport au défaut valvulaire en question.
Echocardiographie : L’échocardiographie est l’outil de diagnostic le plus important pour l’évaluation des valves cardiaques. Celle-ci doit inclure la quantification de la sténose ou de l’insuffisance ainsi que l’évaluation de l’anatomie et de la fonction valvulaires. En outre, il est nécessaire d’évaluer les cavités cardiaques droite et gauche et de montrer l’impact des anomalies valvulaires sur l’hémodynamique [10]. Il convient de noter que de nombreux paramètres de mesure généralement utilisés pour l’évaluation des valves cardiaques n’ont été validés que pour des défauts valvulaires isolés. En général, le diagnostic échocardiographique de la MVD doit tenir compte de l’altération de l’hémodynamique [1]. Les directives actuelles de la Société européenne de cardiologie (ESC) soulignent que différentes mesures échocardiographiques doivent être combinées afin de prendre en compte l’interaction entre les anomalies valvulaires [11].
Lors de l’évaluation échocardiographique de la SA, l’IM peut favoriser un “état à bas débit/bas gradient”, car le flux d’insuffisance existant réduit le gradient au-dessus de la valve aortique. Cela rend la quantification de la SA difficile et peut conduire à une sous-estimation de la gravité de la SA (figure 1) [12]. En outre, la mesure du doppler cw de l’AS risque d’inclure le jet d’insuffisance de la valve mitrale. Cela conduirait à une surestimation de l’AS.
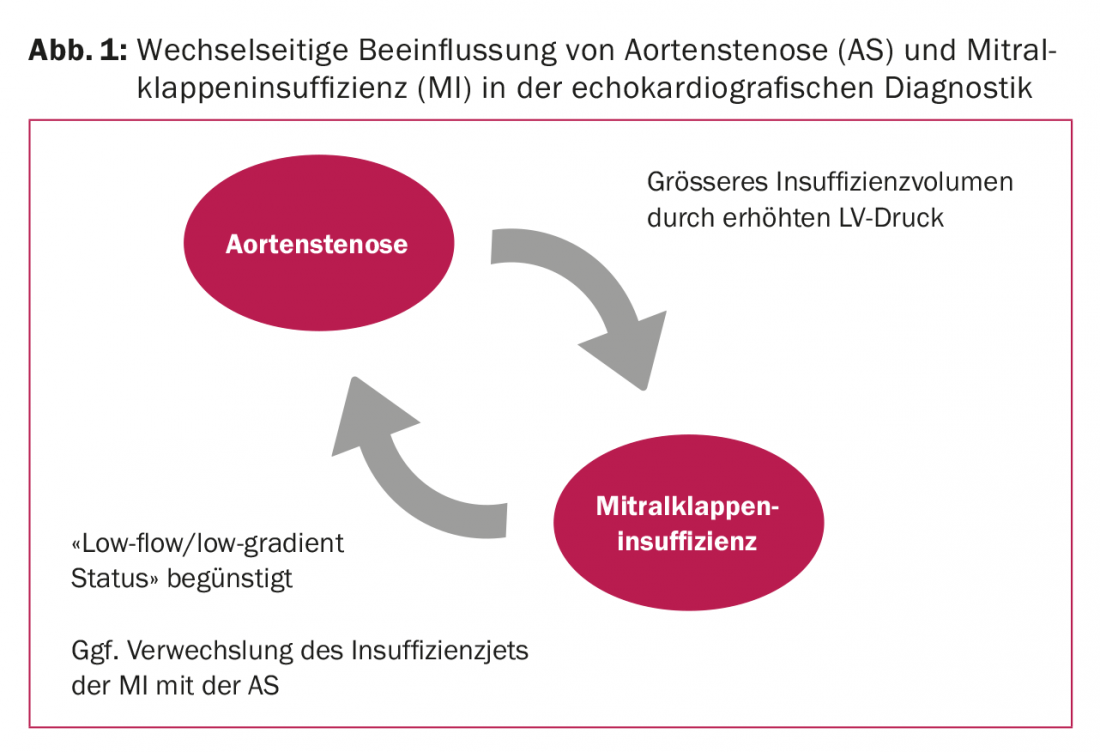
En raison de l’augmentation de la pression ventriculaire gauche dans la SA, le volume d’insuffisance au-dessus de la valve mitrale augmente et se présente de manière disproportionnée par rapport à la surface d’ouverture effective de la régurgitation (ERO). Le volume d’insuffisance indique ici la charge hémodynamique et est souvent en corrélation avec les symptômes cliniques du patient. Toutefois, pour évaluer la valve mitrale, il convient de se référer à l’ERO, qui est moins influencée par l’AS.
Étant donné que les mesures fonctionnelles (gradients, flux, etc.) sont faussées par la modification de l’hémodynamique, il convient d’accorder une importance particulière à l’évaluation morphologique des valves (modifications structurelles, telles que le degré de calcification). Dans ce cas, l’échocardiographie transoesophagienne est généralement plus pertinente que l’échocardiographie transthoracique.
Diagnostic complémentaire : si l’échocardiographie traditionnelle ne permet pas d’établir un diagnostic clair, d’autres méthodes de diagnostic sont nécessaires. Un diagnostic précis est essentiel pour prendre la bonne décision thérapeutique. En cas de réduction de la fonction de pompage du VG, une échocardiographie de stress à la dobutamine doit être réalisée si l’échocardiographie transthoracique révèle un “état à bas débit/à faible gradient” (indice de volume de battement <35 ml/min/m²), afin de pouvoir exclure un SA pseudo-grave. La quantification du degré de calcification de la valve aortique par scanner est de plus en plus importante pour le diagnostic de la SA [11,13]. Ce paramètre est totalement indépendant de l’hémodynamique.
Régime thérapeutique
Comme il existe très peu de littérature sur les MVD, la ligne directrice actuelle de l’ESC ne fait que des recommandations qui ne sont pas fondées sur des preuves (niveau de preuve C) [11].
La décision thérapeutique doit être prise en tenant compte de toutes les anomalies valvulaires et doit être prise par une équipe cardiaque dite multidisciplinaire (cardiologues interventionnels, experts en imagerie, chirurgiens cardiaques, anesthésistes, etc. Il est important de noter qu’une opération sur plus d’une valve augmente le risque opératoire. Dans l’Euro Heart Survey, les patients atteints de MVD ont connu une mortalité hospitalière postopératoire de 6,5%, tandis que les patients opérés d’une seule valve cardiaque ont connu une mortalité hospitalière de 0,9 à 3,9% [2]. Une autre étude a montré un taux de mortalité postopératoire de 10,7% lors d’une opération combinée de la valve aortique et mitrale [14]. Les principaux facteurs de risque de mortalité accrue semblent être l’hypertension pulmonaire et l’insuffisance cardiaque avancée de stade IV de la NYHA. Toutefois, après une opération, les études montrent une nette amélioration clinique et un meilleur pronostic à long terme. Pour décider du traitement chirurgical (ou interventionnel) à mettre en œuvre, il faut tenir compte du fait qu’une éventuelle ré-opération nécessaire sur le deuxième défaut valvulaire augmente considérablement le risque opératoire et détériore la survie à long terme.
Après le remplacement de la valve aortique sténosée, la pression ventriculaire gauche diminue, ce qui permet également de soulager la valve mitrale et d’améliorer l’IM [8]. Les nouvelles directives de l’ESC recommandent donc une approche chirurgicale plus prudente de la valve mitrale, à condition qu’elle ne présente pas de modifications structurelles telles que des anomalies de la voile [11].
Remplacement valvulaire interventionnel : les thérapies valvulaires percutanées sont de plus en plus fréquentes chez les patients présentant un risque chirurgical élevé ou moyen. Lors de l’implantation d’une valve aortique transcathéter (TAVI), l’IM de degré moyen ou élevé qui l’accompagne augmente la mortalité à 30 jours par rapport aux patients présentant une IM de faible degré [15]. Après 30 jours, les deux groupes ne présentent plus de différences. Les patients souffrant d’une IM de grade moyen ou élevé présentent des taux de survie comparables à ceux des patients souffrant d’une IM de faible grade, même après deux ans.
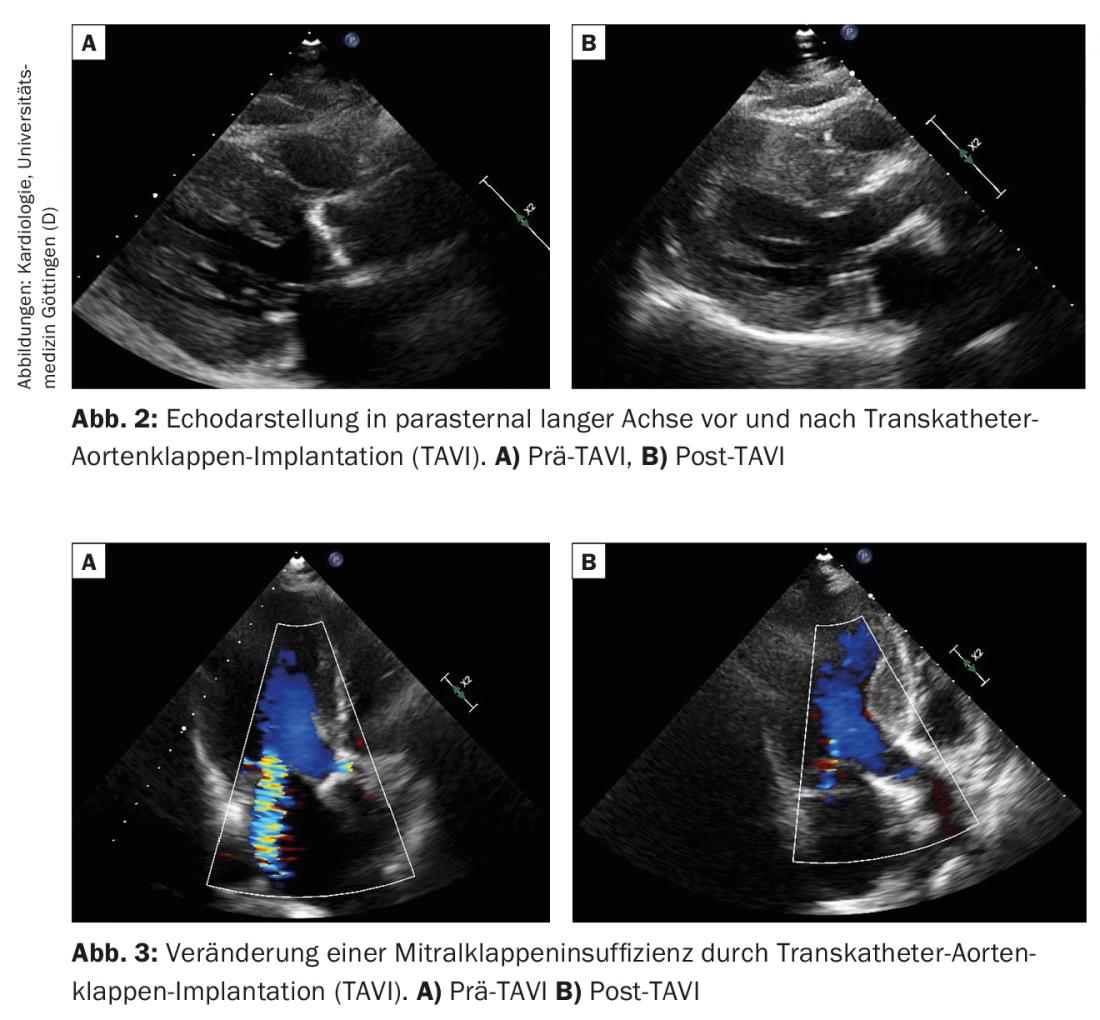
Après un TAVI, une IM fonctionnelle peut s’améliorer de manière significative (Fig. 2 et 3). Toutefois, la réponse de la valve mitrale est très hétérogène. Immédiatement après le TAVI, l’IM diminue chez une grande partie des patients. Une étude portant sur 478 patients a montré que l’IM de grade moyen ou élevé était réduite chez 61% des patients après TAVI [15]. Au bout d’un an, l’IM s’était améliorée chez 55%, était restée inchangée chez 16% et s’était aggravée chez 1%. Les facteurs associés à une réduction de l’IM après TAVI sont : l’absence de fibrillation auriculaire, l’absence d’hypertension pulmonaire et un gradient transvalvulaire particulièrement élevé sur la valve aortique en préopératoire (>40 mmHg). En cas d’IM fonctionnelle, la probabilité d’une diminution de la sévérité de l’IM après TAVI est plus élevée qu’en cas d’IM dégénérative (primaire).
Il existe à ce jour très peu de données sur le traitement percutané combiné de la valve aortique et de la valve mitrale. Pour les quelques patients étudiés, une approche en deux temps s’est avérée efficace. Dans un premier temps, la SA a été traitée par TAVI et, dans un second temps, un MitraClip® a été implanté si, trois mois après le TAVI, une IM de grade moyen à élevé et des symptômes persistaient. Les taux de réussite de la procédure étaient très bons. Après six mois, on a constaté une amélioration du statut fonctionnel et une bonne survie à court terme [16]. Des études complémentaires à long terme sur des groupes de patients plus importants sont toutefois nécessaires pour vérifier les avantages de cette approche.
Conclusion
Les MVD sont une pathologie fréquente dont l’incidence va augmenter en raison des changements démographiques. La combinaison la plus fréquente est celle de l’AS et de l’IM. Le principal outil de diagnostic est l’échocardiographie. Il convient de noter qu’une combinaison d’AS et d’IM peut notamment fausser les mesures de l’hémodynamique. Lors d’un remplacement valvulaire chirurgical, la mortalité augmente en raison d’une deuxième défaillance valvulaire. L’intervention valvulaire percutanée peut être une alternative, mais il est recommandé de procéder en deux temps afin de permettre une réévaluation après le traitement d’une valve. D’autres études cliniques sont nécessaires pour permettre des recommandations fondées sur des preuves. La coopération entre les cardiologues et les chirurgiens cardiaques au sein de l’équipe de cardiologie joue un rôle crucial dans le traitement.
Messages Take-Home
- Un cinquième des patients atteints de valvulopathie native présentent une cardiopathie multiviscérale (MVD), la plus fréquente étant une combinaison de sténose de la valve aortique (SA) et d’insuffisance de la valve mitrale (IM).
- Le diagnostic fonctionnel est rendu difficile par l’influence mutuelle des anomalies valvulaires.
- Une évaluation morphologique des valves par échocardiographie et scanner est particulièrement importante en cas de MVD (degré de calcification).
- Il n’existe pas de recommandations thérapeutiques fondées sur des preuves pour la MVD. La décision thérapeutique doit être prise individuellement par l’équipe de cardiologie.
- Une opération sur plus d’une valve cardiaque augmente le risque périopératoire.
- Après l’implantation d’une valve aortique transcathéter (TAVI), une IM fonctionnelle peut s’améliorer de manière significative. Le cas échéant, une procédure en deux temps suivie d’un MitraClip® peut être envisagée.
Littérature :
- Unger P, et al : Pathophysiology and management of multivalvular disease. Nat Rev Cardiol 2016 ; 13(7) : 429-440.
- Iung B, et al : A prospective survey of patients with valvular heart disease in Europe : The Euro Heart Survey on Valvular Heart Disease. European Heart J 2003 ; 24(13) : 1231-1243.
- Leon MB, et al : Implantation aortique-valvulaire par transcathéter pour la sténose aortique chez les patients qui ne peuvent pas subir d’opération. N Engl J Med 2010 ; 363(17) : 1597-1607.
- Roberts WC, Sullivan MF : Observations cliniques et nécropsie précoces après remplacement simultané des valves mitrale et aortique. The American Journal of Cardiology 1986 ; 58(11) : 1067-1084.
- Iung B, Vahanian A : Epidémiologie de la cardiopathie valvulaire chez l’adulte. Nat Rev Cardiol 2011 ; 8(3) : 162-172.
- Unger P, et al : Régurgitation mitrale chez les patients avec sténose aortique subissant un remplacement de valve. Heart (British Cardiac Society) 2010 ; 96(1) : 9-14.
- Paradis JM, et al : Aortic stenosis and coronary artery disease : what do we know ? Qu’est-ce qu’on ne sait pas ? A comprehensive review of the literature with proposed treatment algorithms. European Heart J 2014 ; 35(31) : 2069-2082.
- Unger P, et al : Effets du remplacement de valve pour sténose aortique sur la régurgitation mitrale. The American Journal of Cardiology 2008 ; 102(10) : 1378-1382.
- Burup Kristensen C, et al : Fibrillation atriale dans la sténose aortique-évaluation échocardiographique et importance pronostique. Cardiovasc Ultrasound 2012 ; 10 : 38.
- Lancellotti P, et al : Recommandations pour l’évaluation échocardiographique de la régurgitation valvulaire native : un résumé exécutif de l’Association européenne d’imagerie cardiovasculaire. Eur Heart J Cardiovasc Imaging 2013 ; 14(7) : 611-644.
- Baumgartner H, et al. : 2017 ESC/EACTS Guidelines for the management of valvular heart disease : The Task Force for the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2017 ; 38(36) : 2739-2791.
- Unger P, et al : Management of multiple valve disease. Heart (British Cardiac Society) 2011 ; 97(4) : 272-277.
- Clavel MA, et al : La nature complexe de la gradation de la maladie de la valve aortique calcifiée sévère discordante : nouveaux éléments issus de l’étude combinée de l’échocardiographie Doppler et de la tomodensitométrie. Journal of the American College of Cardiology 2013 ; 62(24) : 2329-2338.
- Vassileva CM, et al. : Caractéristiques des résultats de la chirurgie multi-ovale : comparaison avec les procédures mono-ovale. Innovations (Philadelphie, Pa) 2014 ; 9(1) : 27-32.
- Toggweiler S, et al : Remplacement de valve aortique par transcathéter : résultats des patients présentant une régurgitation mitrale modérée ou sévère. Journal of the American College of Cardiology 2012 ; 59(23) : 2068-2074.
- Kische S, et al : Staged total percutaneous treatment of aortic valve pathology and mitral regurgitation : institutional experience. Catheterization and cardiovascular interventions : official journal of the Society for Cardiac Angiography & Interventions 2013 ; 82(4) : E552-63.
CARDIOVASC 2018 ; 17(2) : 22-25