Longtemps considérée comme la “valve oubliée”, la valve tricuspide (VT) a fait l’objet d’une attention et d’un intérêt croissants au cours des dernières années. Cela est dû en grande partie au développement de nouvelles méthodes thérapeutiques via une approche transcathéter, qui peuvent désormais offrir à de nombreux patients une option de traitement efficace en plus des traitements médicamenteux et chirurgicaux.
Longtemps considérée comme la “valve oubliée”, la valve tricuspide (VT) a fait l’objet d’une attention et d’un intérêt croissants au cours des dernières années. Cela est dû en grande partie au développement de nouvelles méthodes thérapeutiques via une approche transcathéter, qui peuvent désormais offrir à de nombreux patients une option de traitement efficace en plus des traitements médicamenteux et chirurgicaux.
Une insuffisance valvulaire tricuspide (IT) significative est observée chez environ 4% de la population âgée (≥75 ans), avec une proportion plus élevée chez les femmes [1]. En raison de l’évolution démographique, on peut s’attendre à une augmentation de la prévalence dans les années à venir. Alors que l’on pensait autrefois que l’IC n’était qu’un symptôme accompagnant une autre maladie cardiaque, on sait aujourd’hui qu’elle a en soi un impact considérable sur le pronostic et l’évolution clinique des patients. Une augmentation de la mortalité peut être observée à partir d’un TI léger, même après analyse ajustée pour d’autres facteurs tels que les comorbidités, une fonction ventriculaire gauche réduite ou une hypertension pulmonaire. Même après la suppression de la cause initiale, par exemple par une opération ou un traitement transcathéter d’une pathologie valvulaire gauche, la gravité de l’IT peut persister et aggraver considérablement le pronostic des patients [2,3].
Comme une grande partie des patients ne sont pas éligibles pour un traitement chirurgical ouvert en raison de leur âge, de leurs comorbidités et du risque opératoire élevé qui en résulte, et que le traitement médicamenteux présente des limites importantes, il y a longtemps eu un grand vide thérapeutique. L’objectif du développement des procédures transcathéter est de combler cette lacune. Cet article vise à donner un aperçu de la compréhension actuelle de l’étiologie, des modalités diagnostiques ainsi que des possibilités actuelles de traitement interventionnel.
Étiologie et présentation clinique
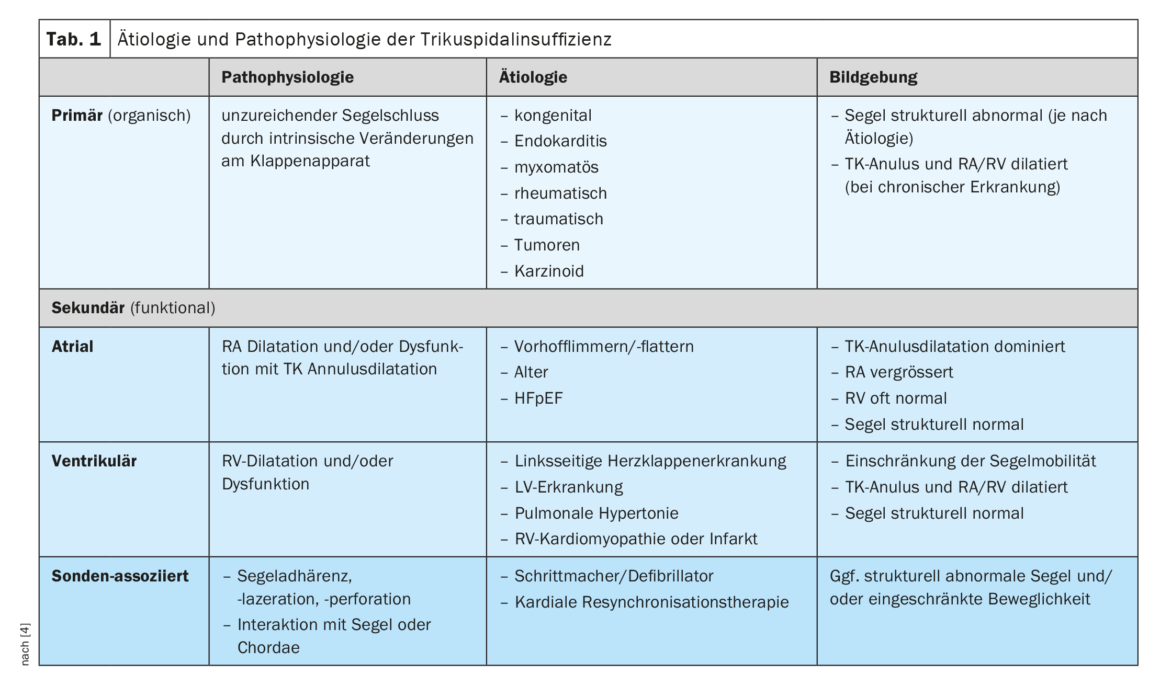
Une TI primaire (organique) est observée chez 8 à 10% des patients et correspond physiopathologiquement à une fermeture insuffisante du voile due à des modifications intrinsèques de l’appareil valvulaire (tableau 1) [4]. Sur le plan étiologique, cela peut être dû à des modifications congénitales, une endocardite, des maladies myxomateuses ou rhumatismales, des traumatismes, des tumeurs ou un carcinoïde (syndrome de Hedinger). L’imagerie montre une structure anormale des voiles, selon la cause sous-jacente, et souvent une dilatation consécutive de l’annulus TK et des cavités cardiaques droites [5]. En revanche, dans l’IC auriculaire secondaire (fonctionnelle), la dilatation de l’annulus du TK due à la dilatation de l’oreillette droite (RA) est le mécanisme dominant. Sur le plan étiologique, l’IC auriculaire secondaire est souvent due à une fibrillation/un flutter auriculaire ou à une insuffisance cardiaque avec fraction d’éjection préservée (HFpEF). La question de savoir si l’IT est une conséquence ou une cause de la FHV fait l’objet de recherches en cours, mais il a été démontré que la conversion en rythme sinusal peut réduire considérablement la sévérité de l’IT. La forme la plus courante est le TI ventriculaire secondaire, dans lequel la mobilité de la voile est limitée ou perturbée par une dilatation du VR. La cause est souvent une valvulopathie ou une maladie ventriculaire gauche, une hypertension pulmonaire ou une pathologie du ventricule droit (RV, cardiomyopathie ou infarctus). En présence d’une fonction VR réduite, celle-ci est également un facteur prédictif de mauvais pronostic clinique, indépendamment d’une éventuelle dilatation du VR [6]. Sur le plan de la morphologie de l’image, la mobilité du voile semble principalement limitée en systole et les cavités cardiaques droites sont dilatées et/ou dysfonctionnelles. Enfin, une TI peut être associée à la pose d’un stimulateur ou d’un défibrillateur, une forme de TI dont la prévalence est souvent sous-estimée. La cause peut être une lésion directe de l’appareil valvulaire lors de l’implantation ou une interaction mécanique avec un voile ou les chordes. Une dyssynchronie provoquée par la stimulation RV peut également jouer un rôle, car l’apparition d’une TI a également été observée avec des stimulateurs sans fil. Toutes les formes d’IC ont en commun le fait que la dilatation des cavités cardiaques droites et de l’annulus du TK par l’IC elle-même ne fait que l’aggraver, créant ainsi un cercle vicieux d’insuffisance toujours croissante.
Sur le plan clinique, l’IT entraîne principalement des symptômes d’insuffisance cardiaque droite, tels que des œdèmes périphériques, de l’ascite, une diminution de l’appétit, une sensation de plénitude et une congestion veineuse du cou, en raison du reflux dans le système veineux. En cas de TI très prononcée, une pulsatilité marquée de la veine jugulaire peut être observée à l’œil nu pendant l’examen clinique. Cependant, contrairement aux idées reçues, un TI sévère peut également entraîner une fatigue, une intolérance à l’effort et une dyspnée d’effort en raison d’une défaillance en amont (low output) . En raison de l’échec de l’avancement et de l’augmentation de la pression veineuse centrale due au TI, il y a également une réduction du gradient artério-veineux dans les organes terminaux (pression artérielle moyenne basse et CVD élevée). Cela peut, même chez les patients subjectivement asymptomatiques, affecter principalement la fonction hépatique et rénale – sous forme de syndrome cardio-hépatique ou cardio-rénal.
Modalités de diagnostic
Outre l’anamnèse et les signes d’examen clinique, l’échocardiographie transthoracique (ETT) joue un rôle crucial dans le diagnostic et l’évaluation de l’IC. Cependant, en raison de différents aspects, la représentation de la TC et de son insuffisance est très difficile, de sorte que la TI est souvent méconnue ou sous-estimée. Par rapport au côté gauche du cœur, les conditions de pression au niveau du TK sont basses et la structure de la valve est très fragile ; en outre, la gravité de l’IC visualisable dépend fortement du volume et est donc soumise à de grandes variations (par exemple chez les patients sous dialyse ou sous traitement diurétique). D’autres défis se posent en raison de la géométrie tridimensionnelle complexe de la valve tricuspide, avec son anulus elliptique en forme de selle non planaire, la disposition souvent multi-segments (>3 feuillets) de la CT, ainsi que les artefacts d’image possibles dus aux sondes de pacemaker/défibrillateur et aux prothèses valvulaires cardiaques gauches [7].
Une ETT est généralement suffisante pour poser le diagnostic et déterminer la gravité, car la valve tricuspide est située très en avant dans le thorax et près de la sonde, mais une échocardiographie transoesophagienne (ETO) est généralement nécessaire pour évaluer précisément le mécanisme sous-jacent de l’IT et planifier une éventuelle intervention. Pour des questions spécifiques ou la planification de certaines interventions, il est possible d’effectuer en plus une tomographie assistée par ordinateur (TDM) ou une imagerie par résonance magnétique (IRM). Outre le TI, le RV peut ici être évalué précisément dans sa fonction et sa dimension. Étant donné que l’évaluation échocardiographique du gradient de pression pulmonaire en cas d’IC sévère n’est pas fiable et est souvent sous-estimée de manière pertinente, il convient d’envisager la réalisation d’un cathétérisme cardiaque droit pour une évaluation hémodynamique.
L’échocardiographie utilise différents paramètres pour classer la gravité, et on distingue généralement une TI légère, modérée et sévère. Cependant, étant donné que les patients ne se présentent ou ne sont diagnostiqués qu’à un stade tardif de la maladie, en particulier dans le cas des TC, et que les paramètres sont alors très supérieurs au cut-off pour une TI sévère, les experts ont proposé d’élargir le spectre de la gravité en ajoutant deux niveaux supplémentaires : outre la TI sévère, il existe également la TI “massive” et la TI “torrentielle”. (torrentiel) TI [8,9]. Cela a notamment une influence sur l’interprétation appropriée du résultat post-intervention : ainsi, la réduction d’une TI “torrentielle” à une TI sévère peut entraîner une nette amélioration de la symptomatologie clinique et du pronostic du patient, même si formellement, sur le plan échocardiographique, la TI reste sévère. La classification de la gravité en cinq niveaux est utilisée depuis plusieurs années dans les études cliniques et a également été intégrée dans les nouvelles lignes directrices de l’ESC sur les valvulopathies publiées récemment [10].
Options thérapeutiques
Médicaments : le traitement médicamenteux des patients atteints de TI est principalement basé sur les comorbidités cardio-pulmonaires présentes. Le traitement d’une insuffisance cardiaque ou d’une valvulopathie gauche avec ou sans hypertension pulmonaire doit être effectué conformément aux directives actuelles. L’administration de diurétiques est utile pour réduire les symptômes, mais il est souvent difficile de concilier le dosage optimal entre les symptômes cliniques et la fonction rénale des patients. De nombreux patients présentent déjà une fonction rénale réduite au moment du diagnostic, qui peut s’aggraver sous traitement diurétique. Cependant, même dans ce cas, le traitement diurétique ne doit pas être complètement arrêté en cas de TI sévère, car cela augmente considérablement le risque de décompensation cardiaque droite et renforce également l’aspect néphrotoxique du TI lui-même. L’administration d’antagonistes des récepteurs minéralocorticoïdes et d’inhibiteurs du transporteur rénal de glucose sodium-dépendant SGLT2 (Sodium dependent glucose co-transporter 2) peut également être envisagée, mais là encore, il n’existe pas d’études spécifiques sur leur utilisation dans les TI de haut niveau. L’objectif du traitement médicamenteux doit être d’atteindre et de maintenir une TI de faible intensité. Si cela n’est pas possible, une présentation précoce à un centre de valvules cardiaques doit être effectuée, conformément aux directives de l’ESC.
Chirurgical : le traitement chirurgical reste le premier choix pour les patients symptomatiques présentant une TI primaire sévère. Si une dilatation ou une diminution de la fonction du RV est déjà visible suite à une TI primaire, la chirurgie peut également être envisagée chez les patients a- ou oligosymptomatiques. La correction chirurgicale d’une TI secondaire est particulièrement utile lorsqu’un patient doit subir une chirurgie valvulaire du côté gauche. Le risque périopératoire n’augmente probablement pas de manière significative, mais la réduction de l’annulus TK peut avoir des effets positifs sur le RV et l’état fonctionnel du patient. En revanche, la chirurgie isolée d’une TI secondaire ne doit être réalisée que chez des patients strictement sélectionnés, qui n’ont pas subi de pré-opérations cardiaques, dont la maladie n’est pas encore très avancée et dont la fonction VR est intacte. Deux scores de risque ont été développés entre-temps pour évaluer le risque chirurgical en cas de TI isolée [11,12], qui permettent d’évaluer la mortalité et la morbidité chirurgicales. Dans l’ensemble, les données à ce sujet sont limitées, mais elles montrent une mortalité élevée, un coût élevé, des hospitalisations prolongées et des processus de récupération longs chez les patients opérés [13,14].
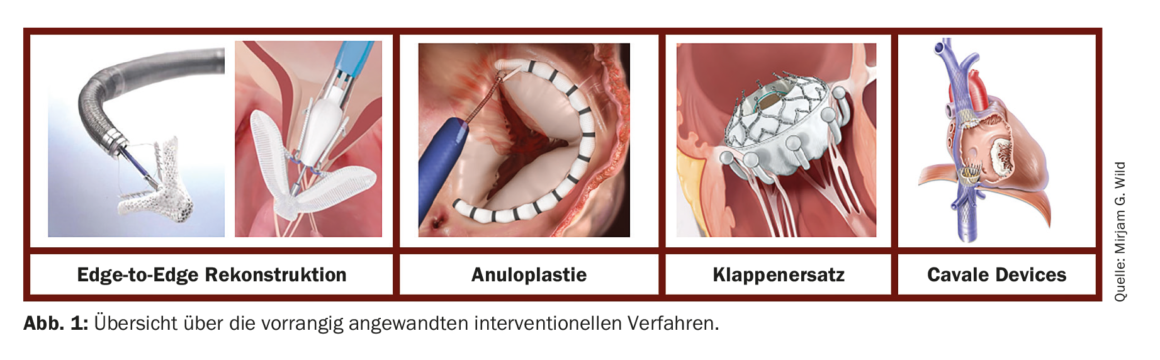
Interventionnel : Au cours des dernières années, différentes procédures interventionnelles ont été développées pour le traitement de la TC via un accès transcathéter. La plupart sont empruntées à des procédures chirurgicales, comme pour la valve mitrale. On distingue les méthodes de reconstruction qui visent à obtenir une approximation des voiles par une technique dite “edge-to-edge”, de celles qui réduisent la taille de l’annulus TK par un resserrement de l’annulus. Outre la reconstruction, il existe désormais différents systèmes de remplacement valvulaire par transcathéter. Par rapport au traitement de la valve mitrale, les conditions anatomiques (structure du voile plus fine, dimensions anulaires plus grandes et lacunes de coaptation plus importantes) et techniques (imagerie exigeante, navigation plus difficile dans l’appareil valvulaire à plusieurs feuillets) posent parfois d’immenses défis, raison pour laquelle les interventions ne devraient être réalisées que dans des centres expérimentés et spécialisés. La figure 1 donne un aperçu des méthodes actuellement utilisées en priorité.
La plupart des procédures utilisent une voie d’accès fémoro-veineuse et nécessitent généralement une anesthésie générale, car le contrôle continu de l’ETO est nécessaire en plus de la fluoroscopie. L’échocardiographie intracardiaque ( ICE) peut être utile en complément de l’ETO si la qualité de l’image est limitée.
A : Reconstruction bord à bord
La technique transcathéter la plus utilisée actuellement dans le monde pour traiter les TI sévères est la reconstruction dite “edge-to-edge”, pour laquelle il existe deux systèmes approuvés commercialement : le système TriClip® (Abbott Vascular, Chicago US) et le système PASCAL® (Edwards Lifesciences, Irvine US). Les deux systèmes diffèrent par les caractéristiques techniques du cathéter d’alimentation, la contrôlabilité et la finesse de construction des dispositifs de clipsage, mais le principe de base est le même : à l’endroit du plus grand jet d’insuffisance, le rapprochement des feuillets valvulaires par l’implant améliore la coaptation et réduit ainsi le reflux. Il est possible d’implanter plusieurs clips dans une valve et de combiner les différents systèmes pour s’adapter aux conditions anatomiques individuelles du patient. Les systèmes TriClip® et PASCAL® ont tous deux fait l’objet d’études démontrant leur sécurité et leur utilité[15–18]. Outre une amélioration des symptômes cliniques, on a constaté une réduction des dimensions cardiaques droites, une amélioration de la fonction RV, une augmentation du débit cardiaque et une diminution des enzymes hépatiques élevées [19,20].
B : Anuloplastie
Le système Cardioband® (Edwards Lifesciences, Irvine US) imite l’annuloplastie chirurgicale et a été initialement développé pour la valve mitrale. Cependant, ce système est désormais bien établi pour l’anuloplastie directe percutanée de la valve tricuspide et a reçu son approbation (marque CE) en 2018 [21]. L’intervention consiste à ancrer une bande dans l’annulus au moyen de 17 vis au maximum, puis à la resserrer, ce qui entraîne une sorte de froncement de l’annulus et améliore ainsi la coaptation de la voile. Dans une étude prospective, le système a obtenu de bons résultats techniques et fonctionnels. En raison de la proximité immédiate de l’artère coronaire droite, son trajet doit être étroitement contrôlé avant (par scanner) et pendant (par fluoroscopie et angiographie) la procédure afin d’exclure tout risque de compromission.
C : Remplacement de valve
Pour le remplacement percutané de la valve tricuspide native, différents systèmes font actuellement l’objet d’études précliniques et cliniques. La plus grande expérience et application actuelle concerne le système EVOQUE (Edwards Lifesciences, Irvine US), dans lequel la valve artificielle est stabilisée au moyen de petits bras d’ancrage qui entourent les voiles natifs. Plusieurs données prometteuses sont déjà disponibles pour ce système [22] et une approbation CE est attendue prochainement.
D : Cavale Devices
Chez les patients pour lesquels une intervention directe sur la valve tricuspide n’est pas possible pour des raisons anatomiques, il est possible d’implanter des systèmes de valves endovasculaires en amont dans la veine cave afin de minimiser le reflux veineux. Le système TricValve (P+F PRODUCTS + FEATURES GMBH, Wien AT) se compose de deux stents, chacun avec un élément à clapet, qui sont disponibles en différentes tailles et peuvent ainsi être adaptés aux dimensions cavales. Le système a récemment (2021) reçu son approbation commerciale en raison de sa sécurité et de son efficacité démontrées [23].
Les preuves actuellement disponibles sur le traitement transcathéter de l’IT sont en grande partie des données de registres, des rapports d’expérience clinique et des étudesprospectives à un seul bras. Le registre TriValve a été le premier grand registre TI à collecter des données de manière multicentrique. Dans ce cas, un taux de réussite technique élevé et un faible taux de complications ont pu être démontrés pour toutes les procédures recensées [24]. Une étude comparative plus poussée (propensity matched case-control study) a comparé 268 patients du registre à des patients traités par des médicaments seuls. Un avantage clair en termes de survie et une réduction du taux de réhospitalisation à un an ont été démontrés [25].
Importance pour la pratique clinique quotidienne
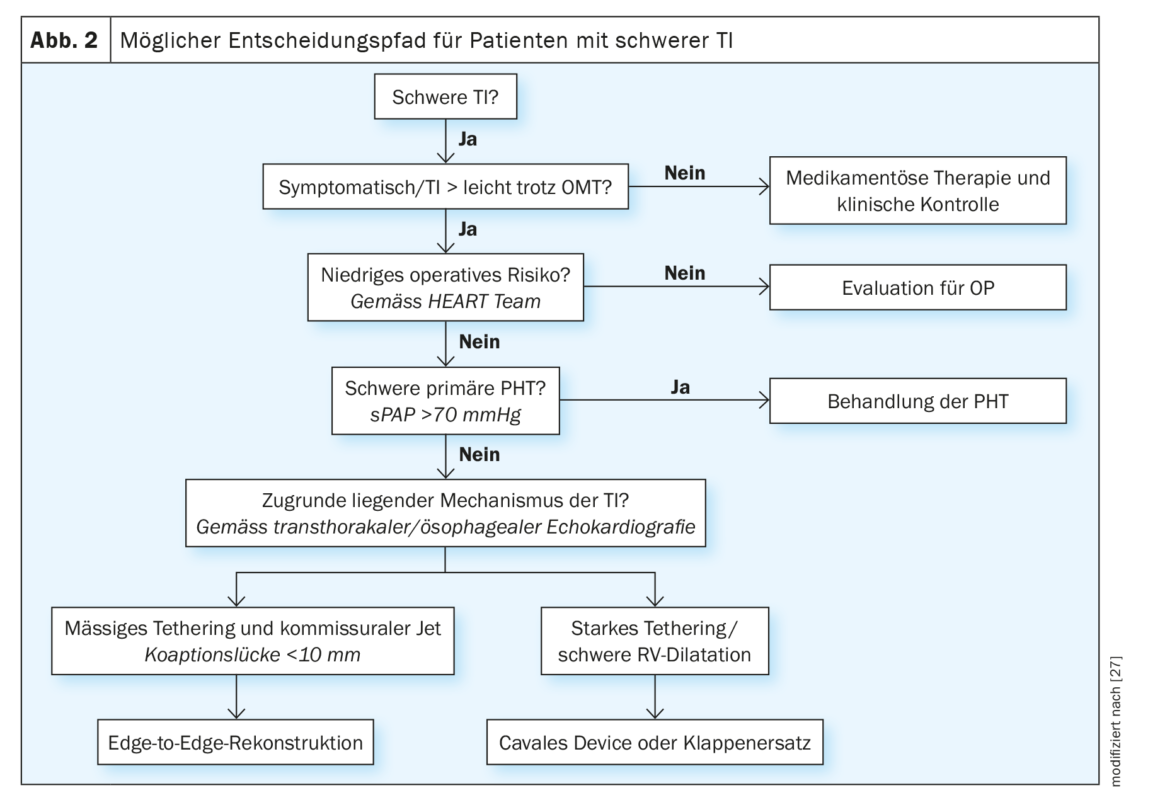
Les patients présentant une suspicion clinique ou échocardiographique de TI pertinente doivent être adressés rapidement à un centre spécialisé dans les valves pour une évaluation plus approfondie (conformément aux lignes directrices actuelles de l’ESC). Cependant, le choix du moment optimal d’intervention et de la procédure de traitement appropriée reste un défi majeur, même pour les experts. Aucune étude comparative n’a été réalisée à ce jour sur les différentes procédures transcathéter, mais l’expérience clinique et les données probantes disponibles à ce jour permettent de formuler des recommandations d’orientation. (Fig. 2). Chez les patients qui restent symptomatiques malgré un traitement médicamenteux intensif, qui présentent des décompensations cardiaques récurrentes à droite ou chez lesquels l’IT ne peut pas être réduite à un degré léger, le mécanisme sous-jacent de l’IT et la fonction VR doivent être examinés après avoir exclu une hypertension pulmonaire primaire sévère. Cela inclut généralement une ETO et un cathétérisme du cœur droit, ainsi qu’un scanner supplémentaire si une anuloplastie, un remplacement valvulaire ou un dispositif cavalier sont envisagés. Tous les patients doivent être discutés et évalués par une équipe interdisciplinaire de cardiologie. Sur la base de l’imagerie pré-procédurale, il est possible d’identifier différentes caractéristiques anatomiques qui rendent le patient éligible pour les différents systèmes de traitement.
Ainsi, pour les jets d’insuffisance avec un déficit de coaptation limité (<8 mm), la reconstruction bord à bord est la plus probable. En cas de maladie avancée avec dilatation de la VR, déficit important de coaptation et tétherisation des feuillets, la reconstruction de la valve par transcathéter peut ne pas être techniquement possible. Ces patients peuvent être évalués pour un remplacement valvulaire orthotopique (actuellement uniquement dans le cadre d’études cliniques) ou hétérotopique. La présence d’une sonde de stimulation ou de défibrillation ne constitue pas une contre-indication fondamentale au traitement par transcathéter de l’IT. Les résultats du traitement étant similaires pour ce groupe de patients par rapport aux patients sans électrode, les mêmes critères peuvent être appliqués pour déterminer la voie de traitement [26]. Le retrait de la sonde peut également être évalué dans le cadre d’un plan de traitement individuel.
Perspectives
Les patients atteints de TI sévère constituent une population de patients très hétérogène et complexe. Au cours des dernières années, plusieurs méthodes de traitement par transcathéter ont été développées et approuvées commercialement, offrant ainsi une option thérapeutique à de nombreux patients jusqu’ici mal desservis. De nombreuses études, telles que de grands registres longitudinaux ou des essais contrôlés randomisés menés par l’industrie (par ex. TRILUMINATE, CLASP TR, TRISCEND II) et des chercheurs (par ex. TRIC-I-HF) pourront apporter de nouvelles connaissances dans les années à venir.
La sélection des patients et le choix du traitement approprié restent des défis, c’est pourquoi les patients concernés doivent être adressés à un centre spécialisé dans les valves bien avant l’apparition d’un dysfonctionnement du VR. Il est également nécessaire de mieux comprendre l’évolution de la maladie et les mécanismes physiopathologiques sous-jacents afin de pouvoir intervenir dès le début de la maladie.
Messages Take-Home
- L’insuffisance de la valve tricuspide (IT), même indépendamment d’autres facteurs, a un impact considérable sur le pronostic et l’évolution clinique des patients.
- De nouvelles procédures transcathéter comme la reconstruction bord à bord ou
le remplacement valvulaire offrent des options de traitement alternatives pour de nombreux patients jusqu’ici mal desservis. - Les patients concernés doivent être adressés rapidement à un centre spécialisé dans les valves afin qu’une équipe cardiaque puisse déterminer l’indication,
le moment et la procédure de traitement appropriés peuvent être identifiés. - Auf Basis des derzeitigen Wissensstandes kann eine interventionelle
Therapie der TI bei den folgenden Konstellationen erwogen werden:- TI symptomatique et sévère,
- TI symptomatique, modérée à sévère, avec décompensations cardiaques antérieures conduisant à droite,
- TI symptomatique, modérée à sévère, avec des doses croissantes de diurétiques.
Littérature :
- Topilsky Y, Maltais S, Medina Inojosa J, et al.: Burden of Tricuspid Regurgitation in Patients Diagnosed in the Community Setting. JACC Cardiovascular imaging 2019; 12: 433–442.
- Nath J, Foster E, Heidenreich PA: Impact of tricuspid regurgitation on long-term survival. Journal of the American College of Cardiology 2004; 43: 405–409.
- Wang N, Fulcher J, Abeysuriya N, et al.: Tricuspid regurgitation is associated with increased mortality independent of pulmonary pressures and right heart failure: a systematic review and meta-analysis. European heart journal 2019; 40: 476–484.
- Praz F, Muraru D, Kreidel F, et al.: Transcatheter treatment for tricuspid valve disease. EuroIntervention: journal of EuroPCR in collaboration with the Working Group on Interventional Cardiology of the European Society of Cardiology 2021; 17: 791–808.
- Hahn RT, Waxman AB, Denti P, Delhaas T: Anatomic Relationship of the Complex Tricuspid Valve, Right Ventricle, and Pulmonary Vasculature: A Review. JAMA cardiology 2019; 4: 478–487.
- Dietz MF, Prihadi EA, van der Bijl P, et al.: Prognostic Implications of Right Ventricular Remodeling and Function in Patients With Significant Secondary Tricuspid Regurgitation. Circulation 2019; 140: 836–845.
- Hahn RT, Thomas JD, Khalique OK, et al.: Imaging Assessment of Tricuspid Regurgitation Severity. JACC Cardiovascular imaging 2019; 12: 469–490.
- Hahn RT, Zamorano JL: The need for a new tricuspid regurgitation grading scheme. European heart journal cardiovascular Imaging 2017; 18: 1342–1343.
- Go YY, Dulgheru R, Lancellotti P: The Conundrum of Tricuspid Regurgitation Grading. Frontiers in cardiovascular medicine 2018; 5: 164.
- Vahanian A, Beyersdorf F, Praz F, et al.: 2021 ESC/EACTS Guidelines for the management of valvular heart disease. European heart journal 2022; 43: 561–632.
- Dreyfus J, Audureau E, Bohbot Y, et al.: TRI-SCORE: a new risk score for in-hospital mortality prediction after isolated tricuspid valve surgery. European heart journal 2022; 43: 654–662.
- LaPar DJ, Likosky DS, Zhang M, et al.: Development of a Risk Prediction Model and Clinical Risk Score for Isolated Tricuspid Valve Surgery. The Annals of thoracic surgery 2018; 106: 129-136.
- Zack CJ, Fender EA, Chandrashekar P, et al.: National Trends and Outcomes in Isolated Tricuspid Valve Surgery. Journal of the American College of Cardiology 2017; 70: 2953–2960.
- Alqahtani F, Berzingi CO, Aljohani S, et al.: Contemporary Trends in the Use and Outcomes of Surgical Treatment of Tricuspid Regurgitation. Journal of the American Heart Association 2017; 6.
- Braun D, Nabauer M, Orban M, et al.: One-year results of transcatheter treatment of severe tricuspid regurgitation using the edge-to-edge repair technique. EuroIntervention: journal of EuroPCR in collaboration with the Working Group on Interventional Cardiology of the European Society of Cardiology 2018; 14: e413–e415.
- Nickenig G, Weber M, Lurz P, et al.: Transcatheter edge-to-edge repair for reduction of tricuspid regurgitation: 6-month outcomes of the TRILUMINATE single-arm study. Lancet 2019; 394: 2002–2011.
- Kodali S, Hahn RT, Eleid MF, et al.: Feasibility Study of the Transcatheter Valve Repair System for Severe Tricuspid Regurgitation. Journal of the American College of Cardiology 2021; 77: 345–356.
- Wild MG, Low K, Rosch S, et al.: Multicenter Experience With the Transcatheter Leaflet Repair System for Symptomatic Tricuspid Regurgitation. JACC Cardiovascular interventions 2022; 15: 1352–1363.
- Karam N, Braun D, Mehr M, et al.: Impact of Transcatheter Tricuspid Valve Repair for Severe Tricuspid Regurgitation on Kidney and Liver Function. JACC Cardiovascular interventions 2019; 12: 1413–1420.
- Orban M, Braun D, Deseive S, et al.: Transcatheter Edge-to-Edge Repair for Tricuspid Regurgitation Is Associated With Right Ventricular Reverse Remodeling in Patients With Right-Sided Heart Failure. JACC Cardiovascular imaging 2019.
- Nickenig G, Weber M, Schuler R, et al.: Two-year Outcomes with the Cardioband Tricuspid System from the Multicentre, Prospective TRI-REPAIR Study. EuroIntervention: journal of EuroPCR in collaboration with the Working Group on Interventional Cardiology of the European Society of Cardiology 2020.
- Webb JG, Chuang AM, Meier D, et al.: Transcatheter Tricuspid Valve Replacement With the EVOQUE System: 1-Year Outcomes of a Multicenter, First-in-Human Experience. JACC Cardiovascular interventions 2022; 15: 481–491.
- Estevez-Loureiro R, Sanchez-Recalde A, Amat-Santos IJ, et al.: 6-Month Outcomes of the TricValve System in Patients With Tricuspid Regurgitation: The TRICUS EURO Study. JACC Cardiovascular interventions 2022; 15: 1366–1377.
- Mehr M, Taramasso M, Besler C, et al.: 1-Year Outcomes After Edge-to-Edge Valve Repair for Symptomatic Tricuspid Regurgitation: Results From the TriValve Registry. JACC Cardiovascular interventions 2019; 12: 1451–1461.
- Taramasso M, Benfari G, van der Bijl P, et al.: Transcatheter versus medical treatment of symptomatic severe tricuspid regurgitation. Journal of the American College of Cardiology 2019.
- Taramasso M, Gavazzoni M, Pozzoli A, et al.: Outcomes of TTVI in Patients With Pacemaker or Defibrillator Leads: Data From the TriValve Registry. JACC Cardiovascular interventions 2020.
- Winkel MG, Brugger N, Khalique OK, et al.: Imaging and Patient Selection for Transcatheter Tricuspid Valve Interventions. Frontiers in cardiovascular medicine 2020; 7: 60.
CARDIOVASC 2024; 23(1): 12–17