La norme pour un glioblastome nouvellement diagnostiqué est une résection aussi complète que possible. Il est suivi d’une radiochimiothérapie à base de témozolomide. Parmi les approches thérapeutiques les plus récentes, on trouve l’utilisation de champs de thérapie tumorale.
Les glioblastomes sont les tumeurs cérébrales primaires malignes les plus fréquentes chez les adultes et peuvent en principe survenir à tout âge. L’incidence augmente avec l’âge et l’âge moyen de survenue de la maladie est de 64 ans. Les hommes sont légèrement plus touchés que les femmes [1]. La survie médiane des patients atteints d’un glioblastome nouvellement diagnostiqué n’est que d’environ 16 mois, même dans le cadre d’études cliniques, et est encore beaucoup plus courte dans les études basées sur la population.
Contrairement aux progrès thérapeutiques relativement limités, la compréhension des bases de la biologie moléculaire du glioblastome a considérablement progressé au cours de la dernière décennie. Selon la classification de l’OMS révisée en 2016, les glioblastomes qui se développent de novo ne présentent pas de mutation dans l’un des deux gènes de l’isocitrate déshydrogénase (IDH). Ce groupe représente environ 90% de tous les glioblastomes. En revanche, les glioblastomes, beaucoup plus rares, issus d’une tumeur de bas grade, présentent généralement une mutation IDH et ont un meilleur pronostic. Ces tumeurs sont donc identifiées séparément dans la nouvelle classification de l’OMS [2]. La méthyltransférase de l’ADN de la O6-méthylguanine (MGMT) s’est imposée comme un biomarqueur important. Il s’agit d’une protéine de réparation de l’ADN qui inverse les alkylations à la position O6 de la guanine. La méthylation du promoteur MGMT est présente dans environ un tiers des glioblastomes. Le résultat de la méthylation est l’absence ou la diminution de l’expression de la MGMT, ce qui entraîne une sensibilité des cellules à la chimiothérapie alkylante.
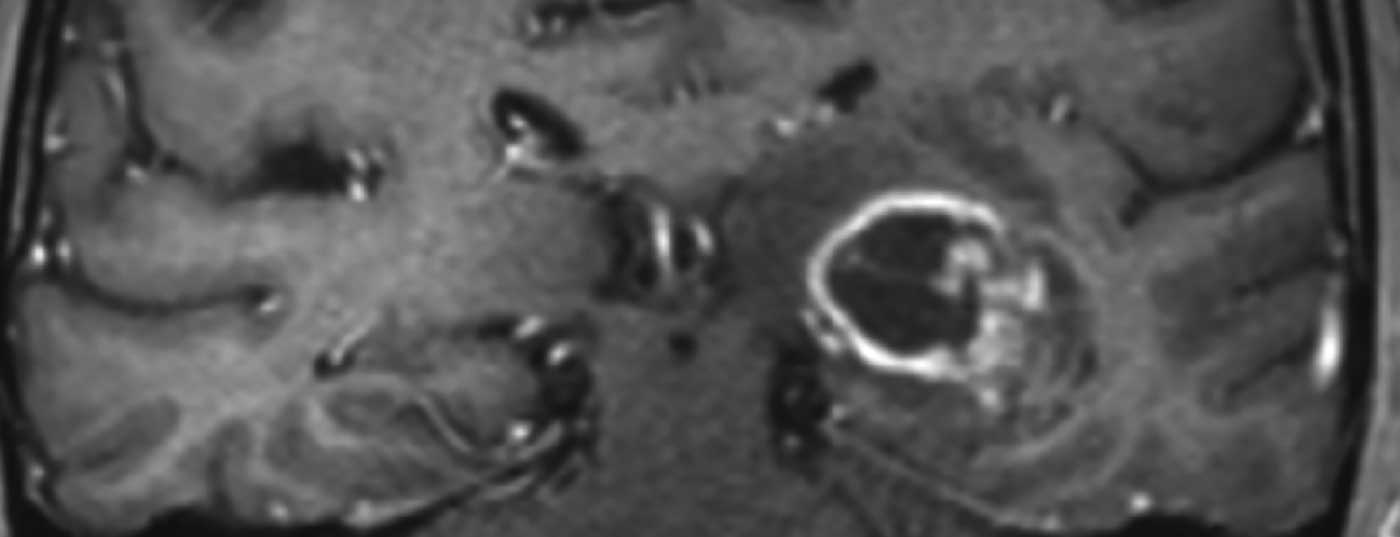
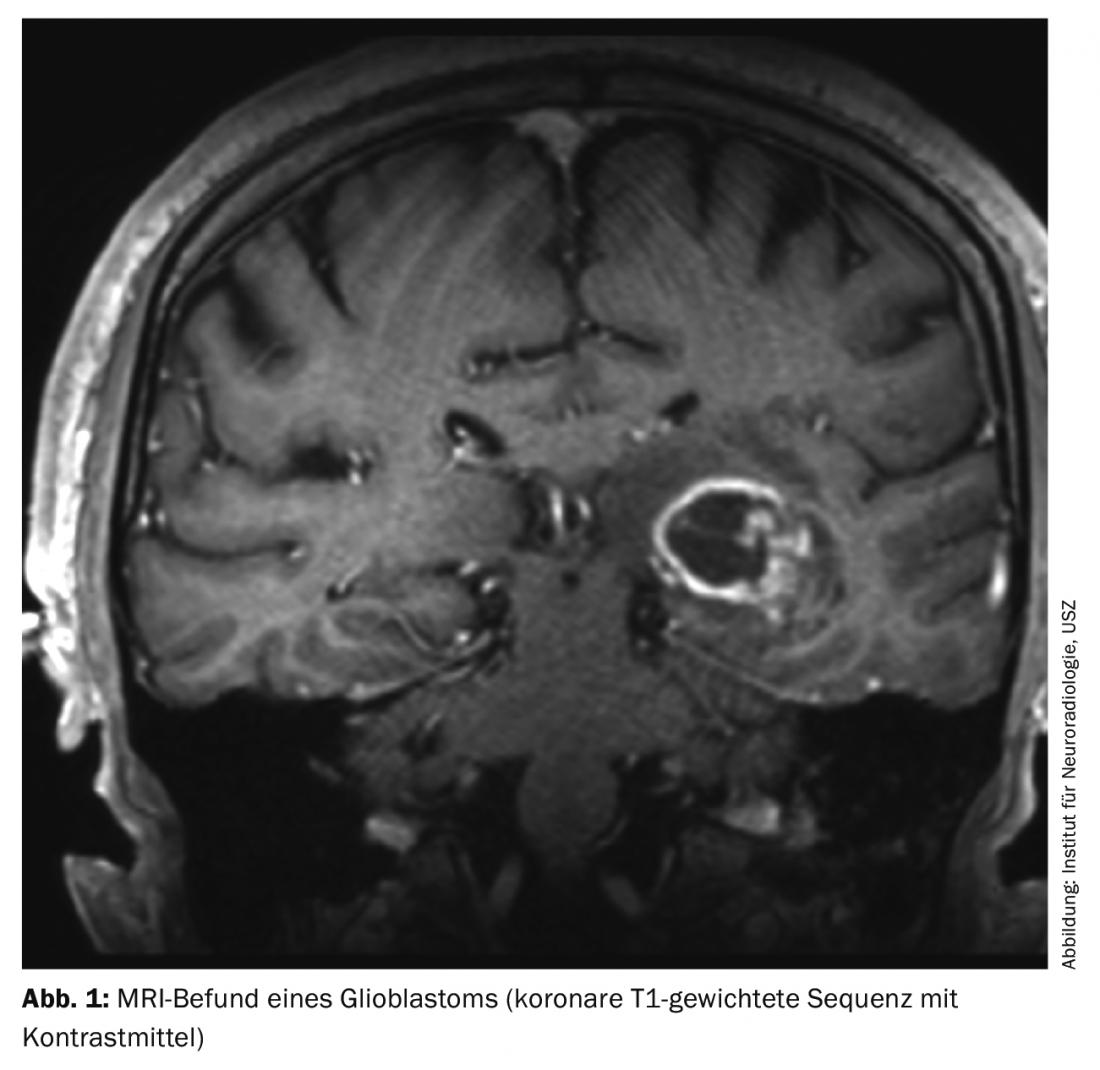
Les glioblastomes se manifestent par différents symptômes cliniques, qui dépendent principalement de la localisation de la tumeur dans le cerveau. Outre les changements de personnalité, les maux de tête, les nausées et les vomissements au sens d’une symptomatologie de pression intracrânienne ou les déficits neurologiques focaux, une crise d’épilepsie conduit souvent à un examen diagnostique. L’IRM crânienne montre typiquement une lésion marginale prenant le contraste avec une nécrose centrale (Fig. 1). En cas de suspicion de glioblastome ou d’une autre tumeur cérébrale à l’imagerie, une confirmation histologique du diagnostic doit généralement être recherchée.
Thérapie
L’objectif de l’intervention chirurgicale, outre l’obtention de tissus, est la résection maximale qui peut être réalisée sans provoquer de nouveaux déficits neurologiques. Les tumeurs pour lesquelles une résection complète n’est pas possible en raison de leur localisation dans le cerveau doivent uniquement faire l’objet d’une biopsie. Il en va de même pour les patients dont l’état général est réduit et qui peuvent ne pas supporter les contraintes d’une opération importante. L’utilisation de l’acide 5-aminolévulinique et de l’imagerie peropératoire permet d’améliorer l’étendue de la résection. Cela se traduit par une augmentation de la survie sans progression [3,4].
Depuis 2005, la radiothérapie avec un traitement concomitant au témozolomide suivi d’un traitement d’entretien au témozolomide pendant un maximum de six cycles (TMZ/RT -> TMZ) est le traitement standard pour les patients atteints d’un glioblastome nouvellement diagnostiqué. Dans ce cas, la radiochimiothérapie est supérieure à la radiothérapie seule [5]. Le témozolomide est un alkylant qui peut être administré par voie orale et qui présente un profil d’effets secondaires globalement favorable. Les effets secondaires les plus fréquents sont la fatigue et les nausées, ainsi que la myélosuppression, qui nécessite parfois un ajustement de la dose.
Plusieurs tentatives de compléter la radiochimiothérapie à base de témozolomide par d’autres substances n’ont pas permis de prolonger la survie. C’est notamment le cas du bévacizumab, un anticorps dirigé contre le “vascular endothelial growth factor” (VEGF). L’ajout du bevacizumab au traitement standard a permis de prolonger la survie sans progression chez les patients atteints d’un glioblastome nouvellement diagnostiqué, mais pas la survie globale [6,7]. Le vaccin peptidique bovopepimut, qui cible le variant vIII muté du “récepteur du facteur de croissance épidermique” (EGFRvIII), a également fait l’objet d’une étude randomisée chez des patients atteints de glioblastome EGFRvIII positif nouvellement diagnostiqué. Cependant, aucun avantage en termes de survie n’a été constaté par rapport à un vaccin placebo [8].
Contrairement aux médicaments susmentionnés, une nouvelle approche thérapeutique utilisant des champs de traitement des tumeurs (“tumor treating fields”) a montré une prolongation de la survie [9]. Il s’agit de créer un champ électrique à l’aide d’électrodes à appliquer sur le crâne, ce qui devrait entraîner une inhibition de la prolifération des cellules tumorales. Le traitement par champs de thérapie tumorale s’ajoute au traitement d’entretien par témozolomide. Idéalement, l’appareil doit être porté au moins 18 heures par jour. Parmi les effets secondaires les plus fréquents figurent les irritations cutanées dues aux électrodes adhésives. Reste à savoir combien de patients opteront à l’avenir pour un tel traitement en plus de la chimiothérapie. En outre, la question du remboursement des frais par les organismes d’assurance n’est pas encore claire dans la plupart des pays.
Le traitement des patients âgés atteints de glioblastome constitue un défi particulier. Entre-temps, une étude randomisée a montré que, chez ces patients également, la combinaison de la radiothérapie et de la chimiothérapie au témozolomide était supérieure à la radiothérapie seule. Cependant, le témozolomide n’entraîne un avantage de survie significatif que chez les patients présentant une tumeur méthylée MGMT [10]. En conséquence, une radiothérapie seule peut être envisagée, en particulier chez les patients âgés de plus de 70 ans et présentant une tumeur non méthylée MGMT. Les patients dont la tumeur est méthylée par MGMT et pour lesquels une radiochimiothérapie combinée n’est pas indiquée, par exemple en raison d’un état général réduit, peuvent recevoir une monothérapie par témozolomide [11]. En particulier chez les patients âgés dont l’état général est réduit, un concept de traitement palliatif et de soutien doit être évalué précocement en raison du pronostic très défavorable.
Perspectives
L’intérêt scientifique se porte actuellement sur les approches thérapeutiques immunothérapeutiques [12]. Outre les concepts de vaccination avancés, les inhibiteurs de la voie de signalisation “mort cellulaire programmée” (PD)-1 sont particulièrement étudiés. Le nivolumab, un inhibiteur de PD1, est actuellement utilisé dans deux études randomisées de phase III. L’étude Checkmate 498 compare la combinaison de la radiothérapie et du nivolumab au traitement standard (TMZ/RT -> TMZ) chez les patients atteints de glioblastome non méthylé MGMT. L’étude Checkmate 548, qui recrute en parallèle, compare l’ajout de nivolumab ou d’un placebo à TMZ/RT -> TMZ chez des patients atteints de glioblastome nouvellement diagnostiqué et dont la tumeur présente une méthylation du promoteur MGMT. Les résultats de cette étude et d’autres études permettront de déterminer si les approches immunothérapeutiques peuvent contribuer à améliorer le pronostic des patients atteints de glioblastome.
Messages Take-Home
- Le traitement standard d’un glioblastome nouvellement diagnostiqué consiste en une résection aussi complète que possible, suivie d’une radiochimiothérapie à base de témozolomide.
- L’ajout du bevacizumab au traitement standard ne prolonge pas la survie des patients atteints de glioblastome.
- Une étude de phase III évaluée positivement a montré une augmentation de la survie de quelques mois grâce à l’utilisation de champs de thérapie tumorale.
- Les études actuellement en cours examinent notamment différentes approches de traitement immunothérapeutique.
Littérature :
- Ostrom QT, et al : CBTRUS statistical report : primary brain and other central nervous system tumors diagnosed in the United States in 2009-2013. Neuro Oncol 2016 ; 18(Suppl 5) : v1-v75.
- Louis DN, et al : The 2016 World Health Organization Classification of Tumors of the Central Nervous System : a summary. Acta Neuropathol 2016 ; 131(6) : 803-820.
- Stummer W, et al : Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma : a randomised controlled multicentre phase III trial. Lancet Oncol 2006 ; 7(5) : 392-401.
- Senft C, et al : Guidance IRM peropératoire et étendue de la résection dans la chirurgie du gliome : un essai randomisé et contrôlé. Lancet Oncol 2011 ; 12(11) : 997-1003.
- Stupp R, et al : Radiothérapie plus concomitant et adjuvant temozolomide pour le glioblastome. N Engl J Med 2005 ; 352(10) : 987-996.
- Chinot OL, et al : Bevacizumab plus radiothérapie-témozolomide pour le glioblastome nouvellement diagnostiqué. N Engl J Med 2014 ; 370(8) : 709-722.
- Gilbert MR, et al : A randomized trial of bevacizumab for newly diagnosed glioblastoma. N Engl J Med 2014 ; 370(8) : 699-708.
- Weller M, et al : Rindopepimut with temozolomide for patients with newly diagnosed, EGFRvIII-expressing glioblastoma (ACT IV) : a randomised, double-blind, international phase 3 trial. Lancet Oncol 2017 ; 18(10) : 1373-1385.
- Stupp R, et al : Maintenance Therapy With Tumor-Treating Fields Plus Temozolomide vs Temozolomide Alone for Glioblastoma : A Randomized Clinical Trial. JAMA 2015 ; 314(23) : 2535-2543.
- Perry JR, et al : Short-Course Radiation plus Temozolomide in Elderly Patients with Glioblastoma. N Engl J Med 2017 ; 376(11) : 1027-1037.
- Weller M, et al : European Association for Neuro-Oncology (EANO) guideline on the diagnosis and treatment of adult astrocytic and oligodendroglial gliomas. Lancet Oncol 2017 ; 18(6) : e315-e329.
- Weiss T, Weller M, Roth P : Immunothérapie pour le glioblastome : concepts et défis. Curr Opin Neurol 2015 ; 28(6) : 639-646.
InFo ONKOLOGIE & HÉMATOLOGIE 2017 ; 5(6) : 16-18