L’exposition à l’amiante jusqu’en 1990 fait des ravages, notamment par le nombre toujours croissant de mésothéliomes pleuraux malins en Suisse. L’espérance de vie des personnes atteintes est extrêmement faible (environ 12 mois) et il n’existe pas de méthode de dépistage appropriée. Néanmoins, la récente approbation de la première option immunothérapeutique pour cette pathologie suscite un léger espoir.
Le principal facteur de risque est clair : l’exposition à l’amiante. Cependant, bien que l’importation et la transformation de l’amiante soient interdites en Suisse depuis le 1er mars 1990, le nombre de cas de mésothéliome pleural malin continue d’augmenter [1,2]. En raison de la période de latence de 20 à 55 ans, le nombre de nouveaux cas ne devrait atteindre son maximum qu’en 2030 [1]. Actuellement, environ 200 maladies sont diagnostiquées chaque année en Suisse. Dans 85% des cas, ce sont les hommes qui sont touchés, généralement âgés de plus de 60 ans [3]. Malheureusement, le pronostic est extrêmement défavorable, avec une durée de survie moyenne inférieure à un an [4]. Après des décennies de chirurgie et de chimiothérapie, voire de radiothérapie, l’autorisation récente de la double immunothérapie ipilimumab/nivolumab a permis d’introduire pour la première fois des produits oncologiques modernes – en espérant qu’ils soient le point de départ d’autres améliorations thérapeutiques à l’avenir.
L’amiante comme coupable
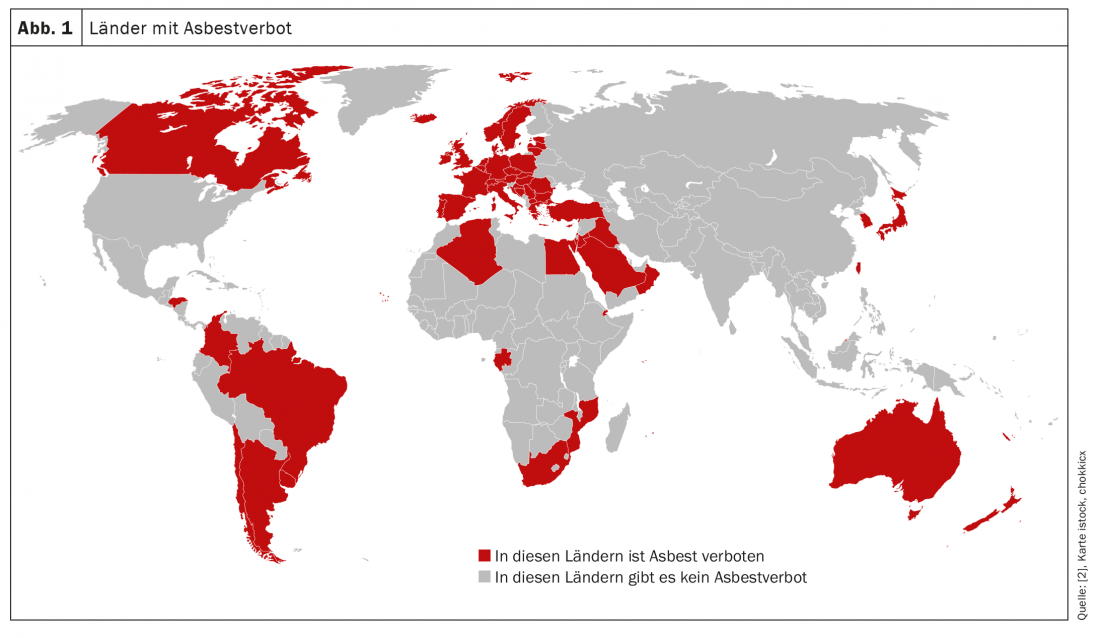
Chez 70 à 90% des personnes concernées, le mésothéliome pleural malin est attribué à une exposition antérieure à l’amiante [1]. L’amiante pénètre dans les poumons sous forme de poussière, les fibres mortelles étant produites par le traitement du matériau. Une fois inhalées, les fibres d’amiante s’accumulent dans les voies respiratoires et ne peuvent être ni dégradées ni éliminées en raison de leur taille critique. La forme en aiguille des fibres permet une migration jusqu’à la plèvre et même un passage dans l’espace pleural. Résultat : des fibroses et, à plus long terme, des cancers, les tumeurs pulmonaires, laryngées et pleurales étant les séquelles néoplasiques les plus fréquentes liées à l’amiante [5]. Plus la dose cumulée est élevée, plus le risque de maladie est important [6]. Mais tous les types d’amiante ne se valent pas. Ainsi, l’amiante blanc (chrysotile), le plus couramment utilisé, est considéré comme moins nocif que d’autres types d’amiante, comme l’amiante bleu (crocidolite). En général, le matériau de construction encore utilisé dans une grande partie du monde – l’amiante n’est interdit que dans 67 pays (figure 1) [2] – est un groupe de minéraux inorganiques cristallins naturels appelés silicates. Avec une excellente résistance à la chaleur et les meilleures propriétés d’isolation [5].
Le mésothéliome pleural malin consécutif à une exposition professionnelle à l’amiante est considéré comme une maladie professionnelle et est donc couvert en Suisse par l’assurance-accidents obligatoire. Cependant, comme l’exposition remonte souvent à plusieurs décennies, il n’est pas toujours facile de la traiter. Ceux qui ont eu un contact non professionnel avec le matériel sont moins bien protégés financièrement. Entre-temps, il existe de plus en plus d’offres de soutien pour les personnes concernées, telles que la Fondation d’indemnisation des victimes de l’amiante (EFA) [7].
Le rôle des gènes
Outre l’exposition à l’amiante, diverses modifications génétiques ont été identifiées au cours des dernières années comme facteurs de risque de mésothéliome pleural malin, en particulier les mutations BAP1 (BRCA-1-associated protein 1), tant au niveau des protéines que de l’ADN. Elles sont souvent observées dans les familles plus touchées que la moyenne, chez les jeunes patients et en présence d’une deuxième tumeur [6,8]. Globalement, les mutations BAP1 sont présentes dans environ deux tiers des mésothéliomes sporadiques [9]. Certaines régions de Turquie, fortement contaminées par l’érionite, une fibre d’amiante naturelle, semblent particulièrement touchées. En raison de cette prévalence et des mutations héréditaires de BAP1, jusqu’à 50% des personnes meurent d’un mésothéliome dans certaines régions [9]. Des mutations inactivantes de gènes suppresseurs de tumeurs tels que CDKN2A, LATS-1 ou NF2 peuvent également favoriser les mésothéliomes pleuraux malins [9].
Présentation clinique et diagnostic
En raison de symptômes non spécifiques et généralement tardifs, la maladie n’est souvent détectée qu’à un stade avancé. Outre la dyspnée, la toux et les douleurs thoraciques, la perte de poids est le plus souvent observée. Environ un tiers des patients présentent des épanchements pleuraux récurrents. Plus tard, l’hémoptysie, la dysphagie, l’enrouement et le syndrome de Horner ne sont pas rares [10]. Une maladie du mésothéliome doit être envisagée, en particulier en cas d’épanchement pleural unilatéral ou d’épaississement de la plèvre [11].
La première question à poser dans le cadre du diagnostic est celle d’une éventuelle exposition à l’amiante dans le passé. Les antécédents familiaux jouent également un rôle important. Si l’exposition à l’amiante reste inexpliquée, les fibres d’amiante peuvent être détectées par microscopie électronique. Toutefois, cela ne confirme pas le diagnostic de mésothéliome pleural, mais seulement l’exposition. La condition préalable est un lavage broncho-alvéolaire ou une biopsie pulmonaire pour obtenir du matériel [4]. Le plus tôt possible, en cas de suspicion de mésothéliome, il convient d’orienter le patient vers un centre spécialisé.
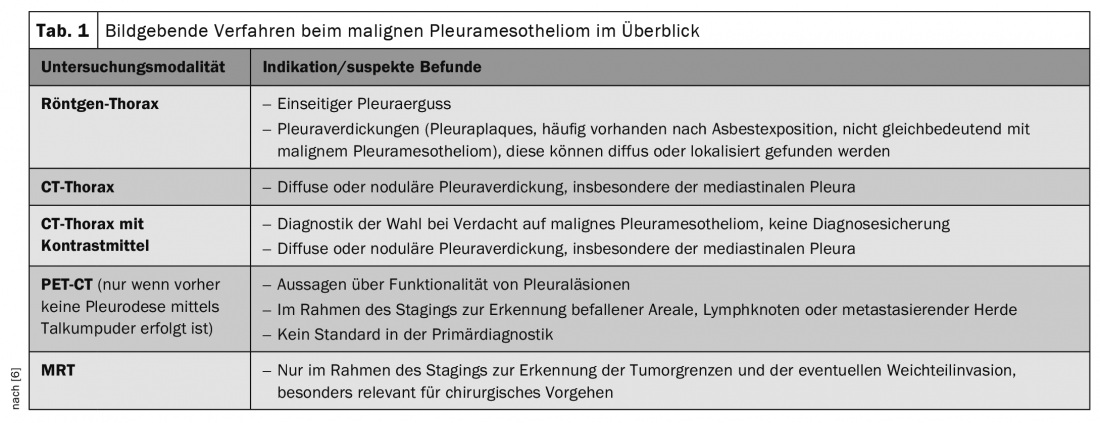
Outre les techniques d’imagerie, c’est surtout le traitement histopathologique du biopsat et de l’épanchement pleural qui revêt une grande importance. Les marqueurs tumoraux ne jouent actuellement aucun rôle dans le diagnostic et l’évaluation de l’évolution [6]. L’imagerie par radiographie thoracique, échographie et/ou scanner permet d’étayer le diagnostic de suspicion et de déterminer la localisation optimale de la biopsie. En revanche, seul l’examen histopathologique des tissus permet de confirmer définitivement le diagnostic. L’imagerie initiale recommandée est le scanner thoracique avec contraste, où le mésothéliome pleural malin se présente de manière caractéristique comme un épaississement pleural diffus ou nodulaire (tableau 1). Dans le cadre de la stadification, le PET-CT et éventuellement l’IRM sont également utilisés au cours de l’évolution. Dans tous les cas, le staging avant le début du traitement doit également inclure une échographie endobrachiale et une médiastinoscopie pour déterminer le statut des ganglions lymphatiques. Les VATS (thoracoscopies vidéo-assistées) controlatérales et les laparoscopies sont également utilisées [6]. La classification des stades est basée sur la classification internationale TNM.
Pour confirmer le diagnostic, des biopsies sont prélevées dans des zones pleurales morphologiquement anormales ou non, soit par VATS, soit par biopsie à l’aiguille guidée par échographie, soit par biopsie pleurale ouverte [6]. L’examen purement cytologique de l’épanchement pleural ne peut pas remplacer la biopsie en raison de son manque de sensibilité [4]. Dans le cadre du traitement histopathologique, des analyses immunohistochimiques et de génétique moléculaire sont effectuées. Celles-ci permettent d’une part de prouver l’origine mésothéliale et d’autre part de faire la distinction avec d’autres modifications malignes. De plus, les sous-types histologiques sont associés à différentes protéines de surface [8]. En général, on distingue les sous-types épithélioïdes, biphasiques et sarcomatoïdes sur la base des modèles de croissance histomorphologiques, les mésothéliomes pleuraux épithélioïdes s’avérant de meilleur pronostic que les sarcomatoïdes [12].
Thérapie : le chemin vers la modernité
Jusqu’à présent, il n’existe pas de normes uniformes pour le traitement du mésothéliome pleural malin. Une chose est cependant claire : une monothérapie ne semble pas être suffisante [13]. L’objectif du traitement est – si possible – une résection macroscopiquement complète dans le cadre d’un concept de traitement multimodal. Dans ce cadre, on a jusqu’à présent surtout misé sur la chimiothérapie adjuvante ou néoadjuvante au moyen de platine plus pemetrexed. La gemcitabine s’est révélée aussi efficace, mais avec une tolérance nettement moins bonne [13]. L’ajout de bevacizumab est envisageable, mais n’est pas autorisé en Suisse [14]. Actuellement, aucun traitement d’entretien n’est recommandé et il n’existe pas d’options bien testées pour un traitement de deuxième ligne [6]. En principe, les patients devraient être traités de préférence dans des centres spécialisés et avoir accès à des études cliniques [6].
Outre la chirurgie et la chimiothérapie, des techniques de radiothérapie sont également utilisées. Ils sont par exemple utilisés pour soulager la douleur et pourraient avoir un impact sur le risque de récidive, ce qui fait actuellement l’objet d’études [6]. L’irradiation radicale de l’ensemble de la tumeur n’est généralement pas recommandée en dehors des études en raison de la propagation généralement complexe de la tumeur et de la charge de dose qui en résulte. Contrairement à ce que l’on pensait auparavant, les sites de biopsie ne doivent pas être irradiés à titre prophylactique pour empêcher la propagation des cellules tumorales [6].
Le traitement chirurgical radical est en principe réservé aux patients sans histologie sarcomatoïde. Les autres conditions préalables sont un statut ganglionnaire N<2 et un stade UICC <IV, ce qui signifie qu’il ne doit pas y avoir de métastases [6]. On ne vise pas une opération sans résidu tumoral, mais une résection macroscopiquement complète. Les procédures envisagées sont, selon la situation, la pneumonectomie extrapleurale (EPP), la pleurectomie et la décortication avec conservation des poumons (P/D) et la pleurectomie partielle [8]. Au final, le bénéfice de ces opérations reste incertain. L’étude MARS2 examine actuellement le bénéfice d’une pleurectomie et d’une décortication avec conservation des poumons par rapport à une approche sans chirurgie. Les interventions chirurgicales sont également importantes dans le cadre d’un concept de traitement palliatif. Par exemple, en cas d’épanchements pleuraux récurrents, une pleurodèse peut être effectuée avec de la poudre de talc [15].
Dans le domaine de la thérapie systémique, une percée a récemment été réalisée après une longue période d’accalmie. Ainsi, l’étude CheckMate-743 a montré un avantage du traitement de première ligne avec les deux inhibiteurs de point de contrôle nivolumab et ipilimumab en situation palliative [16,17]. La double immunothérapie a déjà été approuvée en raison de ses résultats convaincants en cas d’histologie non épithélioïde ainsi qu’en cas d’histologie épithélioïde et d’expression de PD-L1 ≥1% [14]. Dans l’étude, elle a entraîné une survie globale (OS) médiane de 18,1 mois, contre 14,1 mois dans le groupe chimiothérapie (hazard ratio 0,74, p=0,002) [17]. Ce premier succès décisif dans le domaine des thérapies oncologiques modernes soulève d’autres questions. La combinaison de la chimiothérapie et de l’immunothérapie est notamment à l’ordre du jour, de même que de nouvelles options possibles en deuxième ligne. Et ce ne sont pas seulement d’autres nouvelles molécules qui pourraient bientôt faire leur entrée dans le traitement du mésothéliome pleural malin, mais aussi des voies d’administration alternatives. Le taux élevé de récidives locales étant un problème pertinent, les options thérapeutiques localisées, telles que la thérapie intracavitaire, sont de plus en plus mises en avant. Par exemple, l’hôpital universitaire de Zurich mène actuellement l’étude de phase II INFLuenCe-Meso, qui évalue la sécurité et l’efficacité d’une chimiothérapie intracavitaire après une résection chirurgicale [13].
Littérature :
- Beeler P, et al. : Sources de données sur la fréquence du mésothéliome pleural malin en Suisse depuis 2001. ASU Revue de prévention médicale. 2021 ; 09.
- Unia : 30 ans d’interdiction de l’amiante. www.unia.ch/de/arbeitswelt/von-a-z/asbest/30-jahre-asbestverbot (dernier accès le 30.09.2021).
- Ligue suisse contre le cancer : Le cancer en Suisse : chiffres clés. Situation en décembre 2020. www.krebsliga.ch/fileadmin/downloads/sheets/zahlen-krebs-in-der-schweiz.pdf (dernier accès le 30.09.2021).
- Scherpereel A, et al : Guidelines of the European Respiratory Society and the European Society of Thoracic Surgeons for the management of malignant pleural mesothelioma. Eur Respir J. 2010 ; 35(3) : 479-495.
- Duell T : Oncology Guide – Pleural mésothelioma (cancer de la plèvre) | Causes, diagnostic et traitement.www.oncology-guide.com/erkrankung/pleuramesotheliom (dernier accès le 30.09.2021).
- Scherpereel A, et al : ERS/ESTS/EACTS/ESTRO guidelines for the management of malignant pleural mesothelioma. Eur Respir J. 2020 ; 55(6).
- Fondation EFA. www.stiftung-efa.ch (dernier accès le 30.09.2021).
- Baas P, et al : Mésothéliome pleural malin : Lignes directrices de pratique clinique de l’ESMO pour le diagnostic, le traitement et le suivi. Ann Oncol. 2015 ; 26 Suppl 5 : v31-9.
- Duell T : Traitement systémique du mésothéliome pleural. Thérapie médicamenteuse. 2017 ; 35(06).
- Mésothéliome pleural malin – Symptômes, traitement et recherche de médecins : Deutscher Verlag für Gesundheitsinformation, Heidelberg, Germany ; www.leading-medicine-guide.ch/erkrankungen/tumoren/mesotheliom#topics (dernier accès le 30.09.2021).
- Gill RR : Imagerie du mésothéliome. Résultats récents Cancer Res. 2011 ; 189 : 27-43.
- Husain AN, et al : Guidelines for pathologic diagnosis of malignant mesothelioma : 2012 update of the consensus statement from the International Mesothelioma Interest Group. Arch Pathol Lab Med. 2013 ; 137(5) : 647-667.
- Mésothéliome pleural malin Traitement. www.usz.ch/fachbereich/thoraxchirurgie/angebot/malignes-pleuramesotheliom (dernier accès le 30.09.2021).
- Information sur les médicaments de Swissmedic. www.swissmedicinfo.ch (dernier accès le 30.09.2021).
- Bielsa S, et al : Le type de tumeur influence l’efficacité de la pleurodèse dans les effusions malignes. Lung. 2011 ; 189(2) : 151-155.
- Nowak AK, Jackson A, Sidhu C : Management of Advanced Pleural Mesothelioma-At the Crossroads. JCO Oncol Pract. 2021 : Op2100426.
- Baas P, et al : First-line nivolumab plus ipilimumab in unresectable malignant pleural mesothelioma (CheckMate 743) : a multicentre, randomised, open-label, phase 3 trial. Lancet . 2021 ; 397(10272) : 375-386.
InFo ONKOLOGIE & HÉMATOLOGIE 2021 ; 9(5) : 32-33