I tumori della testa e del collo sono stati il settimo tumore più comune a livello mondiale nel 2018. I fattori di rischio più importanti includono il consumo di nicotina e di alcol. La prognosi e le opzioni di trattamento multimodale per i pazienti con tumori della testa e del collo variano a seconda dei fattori epidemiologici, della posizione anatomica e dello stadio del tumore. Una panoramica.
I tumori della testa e del collo sono stati il settimo tumore più comune a livello mondiale nel 2018 (890.000 nuovi casi) [1]. Negli Stati Uniti, i tumori della testa e del collo rappresentano il 3% di tutti i tumori (51.540 nuovi casi) e poco più dell’1,5% di tutti i decessi per cancro (10.030 decessi) [2]. Questi tumori maligni sono per lo più associati al consumo di nicotina e di alcol come fattori di rischio più importanti. Negli ultimi decenni, è stato osservato un calo complessivo dell’incidenza, in particolare grazie alla diminuzione del consumo di nicotina [3,4]. Al contrario, è stato dimostrato un aumento del cancro orofaringeo nelle persone più giovani in Nord America e in Europa settentrionale, principalmente a causa dell’aumento dell’incidenza di tumori associati a sottotipi di papillomavirus umano (HPV) ad alto rischio (soprattutto HPV tipo 16) [4,5].
La prognosi e le opzioni di trattamento multimodale per i pazienti con tumore della testa e del collo variano a seconda dei fattori epidemiologici, della posizione anatomica e dello stadio del tumore. I tumori della testa e del collo rappresentano un gruppo eterogeneo di malattie. Il focus di questo articolo di revisione è sulle opzioni di trattamento per i carcinomi a cellule squamose ricorrenti e metastatici, nonché localmente avanzati, originati dalle membrane mucose (prevalentemente cavità orale, faringe e laringe). Il trattamento nelle fasi iniziali di questi tumori non sarà discusso in questa sede, poiché negli ultimi anni non ci sono stati cambiamenti rilevanti nella terapia.
Il trattamento dei pazienti con tumori della testa e del collo è complesso e comprende non solo il trattamento medico del tumore e gli effetti acuti della chirurgia, della chemioterapia e della radioterapia, ma anche la guida e la consulenza per affrontare le menomazioni permanenti e le conseguenze psicosociali che ne derivano. Fortunatamente, le recenti scoperte hanno portato a miglioramenti significativi nei risultati del trattamento. I progressi nella chirurgia e nella radioterapia hanno migliorato la conservazione funzionale degli organi corrispondenti e ridotto la morbilità e la mortalità complessiva. Ad esempio, le nuove tecniche di chirurgia robot-assistita per il carcinoma orofaringeo [6] e quelle di microchirurgia laser minimamente invasiva per il carcinoma laringeo e ipofaringeo [7] possono aumentare notevolmente la probabilità di preservare la funzione. I progressi nella radioterapia conformazionale, come la radioterapia a intensità modulata (IMRT) e la radioterapia a guida d’immagine, possono anche ridurre la morbilità [8]. In particolare, l’introduzione degli inibitori del checkpoint immunitario per il trattamento del tumore della testa e del collo ricorrente o metastatico ha migliorato in modo significativo la prognosi di molti pazienti, di cui si parlerà prima in seguito.
Tumori della testa e del collo ricorrenti e/o metastatizzati
I tumori della testa e del collo ricorrenti e/o metastatizzati sono associati a una prognosi sfavorevole. La maggior parte dei pazienti con recidiva primaria localizzata – come i pazienti con tumori metastatici della testa e del collo – riceve una terapia sistemica palliativa, poiché solo alcuni pazienti selezionati con recidiva loco-regionale possono essere trattati con la chirurgia o la radioterapia rinnovata [9]. Di conseguenza, una valutazione interdisciplinare della situazione della malattia, di eventuali trattamenti precedenti e della situazione individuale è sempre necessaria per la scelta individuale della migliore strategia terapeutica. Per molti anni, la terapia standard per i tumori recidivati e/o metastatici è stata il cosiddetto “regime EXTREME”, che comprende la chemioterapia a base di platino (cisplatino o carboplatino) in combinazione con fluorouracile (5-FU) e cetuximab, un anticorpo contro il recettore del fattore di crescita epidermico (EGFR), seguito da una terapia di mantenimento con cetuximab [10]. Il trattamento con il regime EXTREME ha mostrato una sopravvivenza globale mediana di circa dieci mesi nello studio pivotal. Per i pazienti che non erano idonei al regime EXTREME, i taxani e il metotrexato erano alcune delle poche opzioni di trattamento disponibili. Con queste sostanze, la sopravvivenza globale mediana scende a sei mesi [11]. Questi dati dimostrano che sono urgentemente necessarie nuove opzioni terapeutiche per i pazienti con tumore alla testa e al collo ricorrente/metastatico.
Negli ultimi anni, le terapie con inibitori del checkpoint si sono affermate come un nuovo standard in molte entità tumorali. I tumori della testa e del collo sono associati a deficit immunitari, come l’alterazione della funzione delle cellule natural killer e la compromissione dei linfociti T che si infiltrano nel tumore, il che costituisce la motivazione per studiare gli inibitori del checkpoint immunitario in questi tumori [11]. Nivolumab e pembrolizumab, entrambi anticorpi monoclonali IgG4 anti-PD-1, sono stati studiati in studi di fase III in pazienti con carcinoma a cellule squamose della testa e del collo (cavità orale, orofaringe, laringe o ipofaringe) dopo il fallimento della chemioterapia a base di platino e confrontati con l’anticorpo o la chemioterapia a scelta del medico responsabile dello studio (docetaxel, cetuximab o metotrexato). Il “fallimento al platino” è stato definito come progressione della malattia entro sei mesi dalla chemioterapia contenente platino, utilizzata con intento curativo (combinazione con radioterapia) o palliativo. Lo studio CheckMate 141 è il primo studio di fase III che ha dimostrato l’efficacia di nivolumab rispetto alla chemioterapia (hazard ratio [HR] per la morte 0,70; p=0,01). Inoltre, nivolumab si è dimostrato meglio tollerato (effetti collaterali G3/4 13,1% contro 35,1% per nivolumab e chemioterapia, rispettivamente) e ha portato a un miglioramento della qualità di vita [12,13]. Nivolumab è stata la prima opzione terapeutica in assoluto a migliorare significativamente la sopravvivenza globale nei pazienti con tumore della testa e del collo recidivato/metastatico che avevano fallito la chemioterapia a base di platino [12]. Nello studio KEYNOTE-040, che aveva un disegno simile a quello dello studio CheckMate-141, pembrolizumab ha anche aumentato la sopravvivenza globale rispetto alla chemioterapia [14]. Vale la pena ricordare che in entrambi gli studi non era richiesta alcuna prova di espressione di PD-L1 come criterio di inclusione e l’endpoint primario non dipendeva dallo stato di PD-L1. Nessuno degli studi ha mostrato una differenza significativa nella sopravvivenza libera da progressione. Come per altri tumori solidi, l’aumento della sopravvivenza globale era quindi dovuto principalmente al fatto che l’immunoterapia ha portato al controllo della malattia a lungo termine in alcuni pazienti. Ad esempio, sebbene solo il 13% dei pazienti abbia mostrato una risposta radiologica al nivolumab, la durata mediana della risposta è stata di 9,7 mesi – il doppio rispetto alla chemioterapia [15]. Gli anticorpi contro PD-L1 sono stati studiati sia come monoterapia che in combinazione con anticorpi contro CTLA-4 dopo il fallimento della terapia a base di platino. Dopo gli studi iniziali di fase II con durvalumab (anticorpo anti-PD-L1) nei pazienti con alta espressione di PD-L1 (≥25%) nello studio HAWK [16] e durvalumab, durvalumab più tremelimumab (anticorpo anti-CTLA-4) o tremelimumab da solo nei pazienti con bassa espressione di PD-L1 (<25%) nello studio CONDOR [17], è stato avviato lo studio di fase III EAGLE [18]. In questo studio, i pazienti con tumore della testa e del collo recidivato/metastatico che avevano fallito la terapia a base di platino sono stati randomizzati tra durvalumab più tremelimumab, durvalumab in monoterapia o chemioterapia standard a scelta del medico dello studio. Lo studio non ha mostrato alcun beneficio in termini di sopravvivenza con durvalumab (HR 0,88; p=0,20) o durvalumab più tremelimumab (HR 1,04; p=0,76) rispetto alla chemioterapia. Considerando la potenza limitata dei confronti inter-studio, è degno di nota il fatto che la sopravvivenza globale mediana nel braccio durvalumab era simile a quella di nivolumab nello studio CheckMate-141 (7,6 e 7,5 mesi, rispettivamente), ma la sopravvivenza globale mediana nel braccio di controllo era numericamente più lunga nello studio EAGLE rispetto a CheckMate-141 (8,3 mesi e 5,1 mesi, rispettivamente). Un’analisi esplorativa dello studio EAGLE suggerisce che questa sopravvivenza globale più alta del previsto nel gruppo di controllo potrebbe essere dovuta a caratteristiche sbilanciate al momento dell’inclusione nello studio (percentuale più alta di pazienti con ECOG PS 0 e metastasi a distanza senza recidiva locale/regionale nel gruppo di controllo), all’uso maggiore di paclitaxel nel gruppo di controllo e al successivo trattamento con anticorpi anti-PD-1. [18]. In che misura la differenza tra gli anticorpi PD-1 e PD-L1 abbia rilevanza clinica non è attualmente chiaro.
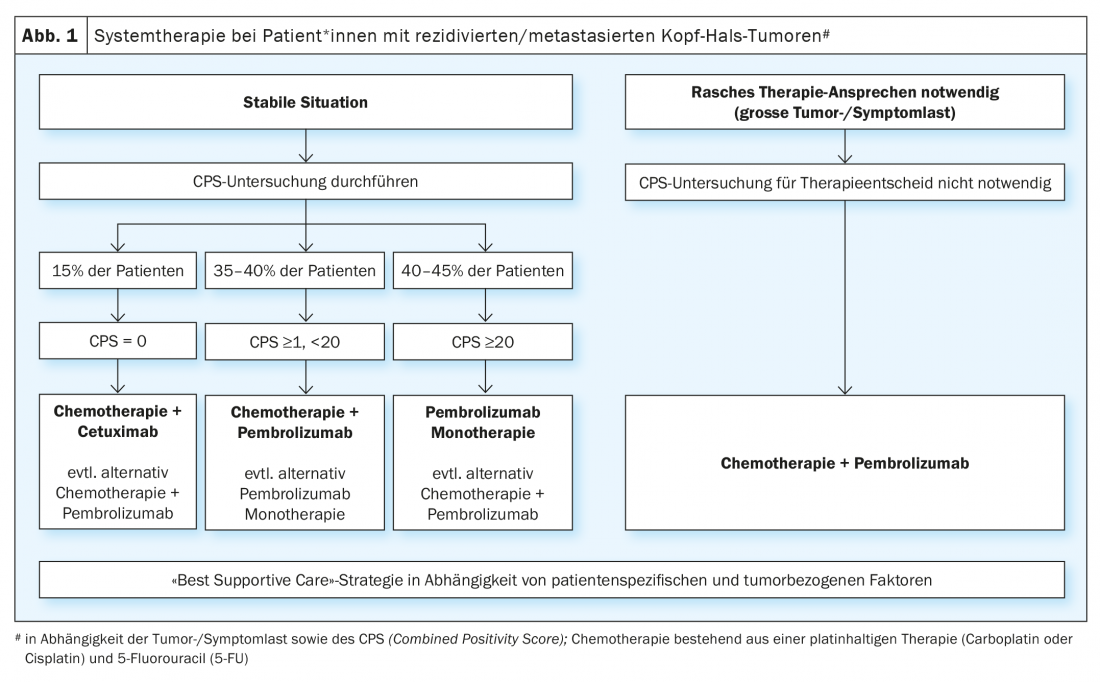
Il comprovato beneficio della terapia con gli inibitori del checkpoint immunitario nei pazienti con tumore della testa e del collo recidivato/metastatico dopo il fallimento della terapia a base di platino ha portato alla valutazione di queste sostanze nella terapia palliativa di prima linea. Lo studio randomizzato di fase III KEYNOTE-048 ha confrontato la monoterapia con pembrolizumab e un trattamento combinato con platino/5-FU e pembrolizumab con il regime EXTREME (platino/5-FU/ cetuximab) [19]. Le analisi statistiche per la sopravvivenza globale sono state eseguite nella popolazione totale e in sottogruppi definiti in base all’espressione di PD-L1. L’espressione di PD-L1 è stata classificata in base al cosiddetto ” punteggio di positività combinato” (CPS ) (CPS ≥1 e ≥20). Il CPS è definito come il numero di cellule PD-L1-positive (cellule tumorali, linfociti, macrofagi) diviso per il numero totale di cellule tumorali e moltiplicato per un fattore 100. La monoterapia con pembrolizumab ha migliorato significativamente la sopravvivenza complessiva nei pazienti con CPS ≥1 e ≥20. Sebbene il tasso di risposta sia stato inferiore rispetto alla chemioterapia (19-21% vs. 36%), la durata mediana della risposta è stata quintuplicata con la monoterapia con pembrolizumab (20,9 vs. 4,5 mesi). La chemioterapia più pembrolizumab ha migliorato significativamente la sopravvivenza globale in tutte e tre le popolazioni. Non c’è stata alcuna differenza significativa nel tasso di risposta e nel tempo libero da progressione tra il trattamento combinato di chemioterapia più pembrolizumab e il regime EXTREME. Come previsto, la monoterapia con pembrolizumab era associata a una minore tossicità, mentre il platino/5-FU più pembrolizumab aveva un tasso di eventi avversi simile a quello del regime EXTREME. Lo studio di fase III KESTREL ha randomizzato i pazienti 2:1:1 a durvalumab da solo, durvalumab più tremelimumab o al regime EXTREME (NCT02551159). L’endpoint primario è la sopravvivenza globale con la monoterapia con durvalumab rispetto a EXTREME nei pazienti con alta espressione di PD-L1 (definita come espressione di > 50% nelle cellule tumorali o >25% nei linfociti infiltranti il tumore). L’endpoint secondario è la sopravvivenza globale con durvalumab più tremelimumab rispetto a EXTREME per tutti i pazienti. Non sono ancora stati pubblicati dati. Tuttavia, è stato annunciato tramite comunicato stampa che lo studio non ha raggiunto i suoi obiettivi finali.
Per la terapia di prima linea, si può riassumere che lo studio KEYNOTE-048 è il primo studio positivo dopo la pubblicazione dello studio EXTREME nel 2009 e ha cambiato lo standard di cura. Tuttavia, ci sono ancora alcune domande senza risposta sulla pratica quotidiana. Uno è se i pazienti con un CPS ≥20, che rappresentavano il 44% dei pazienti con comprovata espressione di PD-L1 nello studio KEYNOTE-048, fossero il motivo del beneficio della monoterapia con pembrolizumab nel gruppo CPS ≥1. La domanda se la monoterapia con pembrolizumab sia sufficiente per i pazienti con CPS 1-19 non può avere una risposta univoca. Un’analisi di sottogruppo dello studio KEYNOTE-048 ha mostrato che pembrolizumab aveva ancora un beneficio rispetto a EXTREME nella CPS 1-19 (HR 0,86), sebbene minore rispetto ai pazienti* con CPS ≥20 (HR 0,58) [20]. Nella pratica clinica, la decisione a favore della monoterapia con pembrolizumab rispetto alla terapia combinata con platino/5-FU più pembrolizumab per i pazienti con CPS 1-19 dipende principalmente dal tumore e dal carico di sintomi. Inoltre, si devono prendere in considerazione anche le comorbidità e le condizioni generali delle persone colpite. Nei pazienti con CPS 1-19 e un elevato carico tumorale e/o sintomi significativi correlati al tumore, la chemio-immunoterapia combinata è spesso preferita per massimizzare la risposta potenziale. Un’altra domanda riguarda la sequenza di trattamento dei pazienti PD-L1-negativi, che rappresentano circa il 15% delle persone colpite. Un’analisi di sottogruppo per i pazienti PD-L1 negativi nello studio KEYNOTE 048 ha mostrato un beneficio per il regime EXTREME rispetto al trattamento di combinazione con pembrolizumab (HR 1,22) [20]. Tuttavia, dato il numero ridotto di pazienti in questa coorte e il fatto che si trattava di un’analisi di sottogruppo non pianificata, non si può concludere che i pazienti PD-L1 negativi non dovrebbero essere trattati con la combinazione di platino/5-FU e pembrolizumab. In sintesi, la monoterapia con pembrolizumab nei pazienti con elevata espressione di PD-L1 (CPS ≥20) e la terapia di combinazione di platino/5-FU e pembrolizumab, indipendentemente dall’espressione di PD-L1, ma soprattutto nei tumori PD-L1-positivi, rappresentano un nuovo standard terapeutico. (Fig. 1). Per i pazienti che mostrano una progressione del tumore durante o dopo questa terapia di prima linea, le chemioterapie sopra citate (docetaxel, metotrexato) o il trattamento con cetuximab sono opzioni di trattamento disponibili. Nuovi approcci immunoterapeutici sono attualmente oggetto di numerosi studi. Ad esempio, lo studio INTERLINK-1 è aperto al reclutamento in diversi centri in Svizzera. Questo studio randomizzato confronta cetuximab con la combinazione di cetuximab e l’inibitore del checkpoint immunitario monalizumab diretto contro NKG2A (NCT04590963).
Oltre all’espressione di PD-L1, lo stato dell’HPV potrebbe servire anche come biomarcatore clinico per prevedere la risposta alla terapia con inibitori del checkpoint immunitario. L’infezione da HPV porta alla produzione di proteine legate al virus che possono innescare una risposta de novo delle cellule T e una maggiore infiltrazione del tumore con cellule T CD8+ [21]. Nello studio di fase II KEYNOTE-055, il tasso di risposta al pembrolizumab è stato del 22% nei pazienti con tumori p16-positivi e del 16% nei tumori p16-negativi [22]. Una meta-analisi ha anche mostrato che lo stato dell’HPV sembra correlarsi con il tasso di risposta al trattamento anti-PD-1 indipendentemente dall’espressione di PD-L1 e dal carico di mutazioni tumorali [23]. Un’altra meta-analisi ha concluso che i pazienti con tumori HPV-positivi hanno avuto esiti significativamente migliori se trattati con inibitori del checkpoint immunitario [24]. Non è ancora possibile valutare in modo definitivo se questi risultati siano rilevanti nella pratica clinica quotidiana. Le attuali linee guida sull’immunoterapia per i tumori della testa e del collo non raccomandano ancora di utilizzare lo stato dell’HPV per prendere decisioni sul trattamento [25].
Tumori della testa e del collo localmente avanzati
Oltre il 60% dei pazienti con carcinoma a cellule squamose della testa e del collo presenta uno stadio III o IV, caratterizzato da tumori di grandi dimensioni con marcata invasione locale, evidenza di metastasi nei linfonodi regionali o entrambi. La malattia localmente avanzata comporta un rischio elevato di recidiva locale (dal 15% al 40%) e di metastasi a distanza [26]. Gli approcci multimodali hanno migliorato i tassi di guarigione, mirando a preservare la funzione e la qualità della vita [27]. Le decisioni terapeutiche in queste fasi richiedono un complesso bilanciamento tra morbilità, possibili effetti collaterali e conservazione della funzione. Inoltre, dipendono fortemente dalle dimensioni e dalla posizione anatomica del tumore primario, dallo stadio della malattia, dall’età della persona colpita, dalle sue preferenze, nonché dalle sue condizioni generali e dalle malattie concomitanti. Queste decisioni terapeutiche dovrebbero quindi essere sempre prese su base interdisciplinare nell’ambito di un comitato tumori.
Nel caso di tumori localmente avanzati, resecabili, la terapia adiuvante, che consiste nella radioterapia o nella radio-chemioterapia combinata (RCT), segue la resezione con l’intenzione di un trattamento curativo. Questo dipende dai fattori di rischio e dalle comorbidità delle persone colpite. L’evidenza microscopica di cellule tumorali sul resecato (R1) e l’evidenza di crescita extracapsulare nei linfonodi sono considerati fattori di rischio “ad alto rischio”. Se sono presenti, si raccomanda un RCT combinato adiuvante. Il cisplatino si è affermato come agente chemioterapico qui [28,29].
Quando la resezione chirurgica non è tecnicamente o comorbidamente fattibile o porterebbe a risultati funzionali a lungo termine potenzialmente scarsi, la RCT definitiva è lo standard curativo stabilito. Una grande meta-analisi (Meta-analysis of Chemotherapy in Head and Neck Cancer [MACH-NC]) ha incluso quasi 20.000 pazienti con tumore della testa e del collo localmente avanzato. L’RCT combinato ha dimostrato di ridurre la mortalità a 5 anni di 6,5 punti percentuali rispetto alla sola radioterapia (HR 0,83; p<0,001). La chemioterapia aggiuntiva di induzione o adiuvante non ha migliorato significativamente la sopravvivenza globale rispetto alla sola RCT [30]. Il cisplatino ad alto dosaggio (100 mg/m2 di superficie corporea, somministrato per via endovenosa ogni 21 giorni per tre cicli) somministrato in concomitanza con la radioterapia nell’ambito di un RCT definitivo è l’attuale standard di cura. Tuttavia, a causa delle significative tossicità a breve e a lungo termine associate al cisplatino, il suo utilizzo è riservato principalmente ai pazienti più giovani che non presentano gravi comorbilità [30–32]. Questo ha portato a diverse modifiche e variazioni del regime originariamente utilizzato di cisplatino (una volta ogni tre settimane). Le revisioni sistematiche hanno confrontato i dati tra cisplatino una volta alla settimana e cisplatino ogni tre settimane (criterio di inclusione: dosaggio cumulativo di cisplatino ≥180 mg/m2). Questo ha mostrato risultati simili e tassi più bassi di effetti collaterali gravi, soprattutto nefro- e ototossicità [33]. Questo è stato confermato anche nella nostra analisi, sebbene la dose cumulativa di cisplatino fosse inferiore nei pazienti trattati a intervalli settimanali [34]. La terapia settimanale con cisplatino può quindi essere utilizzata come alternativa accettabile, in quanto il dosaggio è più controllabile e la nefro- e l’ototossicità sono generalmente meno gravi. Inoltre, nei pazienti che non sono idonei per il cisplatino (ad esempio, i pazienti con malattia renale cronica, perdita cronica dell’udito, età avanzata o performance status ECOG borderline), il carboplatino viene spesso utilizzato in combinazione con un taxano, anche se non esiste un confronto diretto negli studi randomizzati controllati. Il cetuximab somministrato in concomitanza con la radioterapia era già stato approvato come terapia standard nel 2006, dopo che i dati avevano dimostrato che questo trattamento portava a un miglioramento del controllo loco-regionale e della sopravvivenza globale rispetto alla sola radioterapia [35]. Tuttavia, recenti studi randomizzati suggeriscono che la radioterapia combinata con cetuximab nei pazienti con carcinoma orofaringeo HPV-positivo ha esiti peggiori, compresa una minore sopravvivenza, se confrontata direttamente con il cisplatino ad alte dosi in combinazione con la radioterapia [36,37]. Pertanto, l’RCT combinato con cisplatino rimane la terapia standard preferita.
Un altro approccio promettente per migliorare la prognosi è quello di combinare l’RCT a base di cisplatino con lo xevinapant. Xevinapant è un antagonista degli inibitori dell’apoptosi. In uno studio randomizzato di fase II, l’aggiunta di xevinapant all’RCT ha migliorato significativamente il tasso di controllo loco-regionale del tumore come endpoint primario a 18 mesi, del 21% rispetto al placebo in combinazione con l’RCT (54% vs. 33%; p=0,026) [38]. Inoltre, è stato osservato un beneficio significativo in termini di sopravvivenza libera da progressione dopo un follow-up di due anni rispetto al braccio di controllo (HR 0,37; p=0,0069). Dopo un periodo di follow-up di tre anni, Xevinapant più RCT ha mostrato una riduzione statisticamente significativa del 51% del rischio di morte rispetto a placebo più RCT (HR 0,49; p=0,0261). Per confermare questi risultati, è in corso lo studio randomizzato di fase III TrilynX (NCT04459715).
Grazie ai dati incoraggianti nel tumore della testa e del collo recidivato/metastatico, numerosi studi stanno attualmente esaminando l’uso degli inibitori del checkpoint immunitario nelle fasi precedenti, soprattutto nei tumori localmente avanzati, in combinazione con l’RCT. Ad esempio, lo studio multinazionale di fase III JAVELIN Head and Neck 100 [39] ha già studiato l’efficacia di avelumab, un inibitore di PD-L1, in combinazione con RCT con cisplatino rispetto al placebo in combinazione con RCT. Lo studio è stato interrotto precocemente dopo un’analisi ad interim perché non ha mostrato alcun miglioramento del tempo libero da progressione [40]. Uno studio in corso sta esaminando il valore della terapia di mantenimento con atezolizumab dopo il completamento dell’RCT (IMvoke010; NCT03452137). Ulteriori studi stanno testando un RCT combinato con inibitori del checkpoint immunitario, seguito da una terapia di mantenimento. Il più grande di questi studi è KEYNOTE-412 (pembrolizumab vs. placebo; NCT03040999).
Un altro approccio interessante che è stato studiato in vari tumori e che ha portato a risultati promettenti è l’uso neoadiuvante degli inibitori del checkpoint immunitario [41,42]. Considerando la situazione di trattamento naïve e la mancanza di cellule resistenti al trattamento rispetto alla situazione di recidiva/metastatica, l’immunoterapia neoadiuvante può essere in grado di ottenere un effetto terapeutico più forte e duraturo. Ad esempio, il trattamento neoadiuvante anti-PD-1 in un modello murino con tumori della testa e del collo ha determinato una conversione dell’immunodominanza funzionale e ha indotto risposte immunitarie robuste dirette contro il tumore [43]. Schoenfeld et al. ha studiato nivolumab (N) in neoadiuvante in uno studio di fase II e la combinazione di nivolumab più ipilimumab (N+I) in una seconda coorte di 29 pazienti non trattati con carcinoma del cavo orale [44]. Nivolumab (3 mg/kg) è stato somministrato alle settimane 1 e 3, mentre ipilimumab (1 mg/kg) è stato somministrato soltanto alla settimana 1. Sebbene un totale di 21 pazienti abbia sperimentato eventi avversi, compresi quelli di grado 3/4 in 2 (N) e 5 (N+I), non ci sono stati ritardi nell’intervento. Inoltre, c’è stata evidenza di risposta a queste terapie in entrambe le coorti. In particolare, quattro pazienti (N, n=1; N+I, n=3) hanno avuto una risposta completa o quasi completa (<10% di cellule tumorali vitali). Questi risultati parlano della tollerabilità clinica e dell’efficacia dell’immunoterapia neoadiuvante. Altri dati interessanti sull’uso neoadiuvante degli inibitori del checkpoint immunitario sono stati forniti dallo studio CAIO [45], dallo studio IMCISION [46], dallo studio CheckMate 358 [47] e da altri studi [48–50], che hanno tutti dimostrato la fattibilità e l’efficacia di questa strategia terapeutica. Di conseguenza, sono stati avviati studi più ampi su questa base (ad esempio, lo studio randomizzato di fase III KEYNOTE-689, NCT03765918). Inoltre, è importante esplorare i possibili predittori di risposta per consentire la selezione dei pazienti adatti. In questo caso, è importante un’analisi dettagliata dei campioni di tumore, nonché dei possibili cambiamenti nel microambiente tumorale e delle cellule immunitarie infiltranti il tumore.
Riepilogo/Conclusione
L’introduzione dell’immunoterapia nel trattamento dei tumori ricorrenti e/o metastatici della testa e del collo ha cambiato radicalmente la terapia di questi quadri clinici e ha migliorato significativamente la loro prognosi. Il trattamento analogo a quello dello studio KEYNOTE-048 (chemioterapia contenente platino + 5-FU + pembrolizumab o pembolizumab mono in base al CPS e al carico del tumore/sintomo) si è affermato come la nuova terapia palliativa di prima linea. A causa dei risultati incoraggianti negli stadi tumorali avanzati, la questione del beneficio dell’immunoterapia si pone anche per gli stadi tumorali più precoci, in combinazione o in sequenza alla radioterapia e alla chemioterapia. È molto probabile che la sequenza delle diverse modalità di trattamento influenzi in modo significativo i risultati. Soprattutto considerando che la risposta delle cellule T antitumorali ha diverse fasi che possono essere prese di mira da diverse immunoterapie, e che sia la radioterapia che la chemioterapia possono modulare il sistema immunitario pur avendo effetti citotossici contro le cellule T [51]. Altri approcci combinati inediti sono in fase di sperimentazione clinica, combinando gli immunoterapici con vaccini contro l’HPV, vaccini tumorali specifici per il paziente, terapie mirate alle cellule T, virus oncolitici e altri immunomodulatori.
Messaggi da portare a casa
- L’introduzione dell’immunoterapia con inibitori del checkpoint immunitario nel trattamento del tumore della testa e del collo ricorrente/metastatico ha migliorato significativamente la prognosi di questi pazienti.
- La monoterapia con l’anticorpo anti-PD-1 pembrolizumab nei pazienti con elevata espressione di PD-L1 (CPS ≥20) e la terapia combinata di platino/5-FU e pembrolizumab (indipendentemente dall’espressione di PD-L1, ma soprattutto nel caso di un CPS ≥1) rappresentano il nuovo standard terapeutico per i tumori della testa e del collo recidivati/metastatici, sulla base dello studio KEYNOTE-048.
- Per i tumori localmente avanzati, non operabili, la radio-chemioterapia combinata definitiva (RCT) con cisplatino rimane la terapia standard. Le alternative farmacologiche al cisplatino in combinazione con la radioterapia sono il carboplatino combinato con un taxano e il cetuximab. Lo Xevinapant (antagonista degli inibitori dell’apoptosi) come aggiunta all’RCT sembra promettente (studio randomizzato di fase III attualmente in corso).
- L’uso dell’immunoterapia negli stadi tumorali più precoci in combinazione con la RCT, come terapia di mantenimento o nel contesto neoadiuvante, è oggetto di studi in corso.
Conflitti di interesse
ED:
Nessun conflitto di interessi.
SR: Compensi per attività di consulenza (pagamento all’Ospedale Universitario di Basilea) da Astra-Zeneca, BMS, Boehringer-Ingelheim, Eisai, Eli Lilly, Merck Serono, MSD, Novartis, Pfizer, Roche, Takeda. Finanziamento della ricerca da parte di AbbVie, Astra-Zeneca, BMS, Boehringer-Ingelheim, Merck. Supporto per la partecipazione al congresso da parte di Amgen, AstraZeneca, BMS, Boehringer-Ingelheim, MSD, Roche, Takeda. Membro della Commissione federale sulle droghe dell’Ufficio federale della sanità pubblica.
Letteratura:
- Bray F, et al: Statistiche globali sul cancro 2018: stime GLOBOCAN di incidenza e mortalità a livello mondiale per 36 tumori in 185 Paesi. CA Cancer J Clin 2018; 68: 394-424.
- Siegel RL, et al: Una valutazione dei progressi nel controllo del cancro. CA Cancer J Clin 2018; 68: 329-339.
- Mourad M, et al: Tendenze epidemiologiche del cancro della testa e del collo negli Stati Uniti: uno studio di popolazione SEER. J Oral Maxillofac Surg 2017; 75: 2562-2572.
- Fitzmaurice C, et al. Incidenza del cancro globale, regionale e nazionale, mortalità, anni di vita persi, anni vissuti con disabilità e anni di vita aggiustati per disabilità per 32 gruppi di tumori, dal 1990 al 2015: un’analisi sistematica per il Global Burden of Disease Study Global Burden of Disease Cancer Collaboration. JAMA Oncol. 2017; 3: 524-548.
- Gillison ML, et al: Epidemiologia del carcinoma a cellule squamose della testa e del collo positivo al Papillomavirus umano. J Clin Oncol 2015; 33: 3235-3242.
- Moore EJ, Janus J, Kasperbauer J: Chirurgia robotica transorale dell’orofaringe: considerazioni cliniche e anatomiche. Clin. Anat. 2012; 25: 135-141.
- Weiss BG, et al: Microchirurgia laser transorale per il trattamento del cancro ipofaringeo in 211 pazienti. Head Neck 2017; 39: 1631-1638.
- Gupta T, et al: Revisione sistematica e meta-analisi della radioterapia a intensità modulata rispetto alla radioterapia convenzionale bidimensionale e/o o tridimensionale nella gestione ad intento curativo del carcinoma a cellule squamose della testa e del collo. PLoS One. 2018; 13. DOI:10.1371/journal.pone.0200137.
- Vermorken JB, Specenier P: Trattamento ottimale per il cancro della testa e del collo ricorrente/metastatico. Annali di Oncologia. Oxford University Press, 2010. DOI:10.1093/annonc/mdq453.
- Vermorken JB, et al: Chemioterapia a base di platino più cetuximab nel cancro della testa e del collo. N Engl J Med 2008; 359: 1116-1127.
- Saleh K, et al.: Nuovi sviluppi nella gestione del tumore della testa e del collo – Impatto di pembrolizumab. Ther. Clin. Gestione del rischio. 2018; 14: 295-303.
- Ferris RL, et al: Nivolumab per il carcinoma a cellule squamose ricorrente della testa e del collo. N Engl J Med 2016; 375: 1856-1867.
- Harrington KJ, et al: Nivolumab rispetto alla terapia standard, a singolo agente, a scelta dello sperimentatore, nel carcinoma a cellule squamose ricorrente o metastatico della testa e del collo (CheckMate 141): risultati sulla qualità di vita correlata alla salute di uno studio randomizzato, di fase 3. Lancet Oncol 2017; 18: 1104-1115.
- Cohen EEW, et al: Pembrolizumab rispetto a metotrexato, docetaxel o cetuximab per il carcinoma a cellule squamose della testa e del collo ricorrente o metastatico (KEYNOTE-040): uno studio di fase 3 randomizzato, in aperto. Lancet 2019; 393: 156-167.
- Ferris RL, et al: Nivolumab vs scelta dello sperimentatore nel carcinoma a cellule squamose ricorrente o metastatico della testa e del collo: aggiornamento sulla sopravvivenza a lungo termine a 2 anni di CheckMate 141 con analisi in base all’espressione di PD-L1 del tumore. Oral Oncol 2018; 81: 45-51.
- Zandberg DP, et al: Durvalumab per il carcinoma a cellule squamose della testa e del collo ricorrente o metastatico: risultati di uno studio di fase II a braccio singolo in pazienti con espressione di PD-L1 delle cellule tumorali ≥25% che hanno avuto una progressione con la chemioterapia a base di platino. Eur J Cancer 2019; 107: 142-152.
- Siu LL, et al: Sicurezza ed efficacia di Durvalumab con o senza Tremelimumab nei pazienti con HNSCC recidivante o metastatico con PD1 basso/negativo: lo studio clinico randomizzato di fase 2 CONDOR. JAMA Oncol 2019; 5: 195-203.
- Ferris RL, et al: Durvalumab con o senza tremelimumab nei pazienti con carcinoma a cellule squamose della testa e del collo ricorrente o metastatico: EAGLE, uno studio di fase III randomizzato, in aperto. Ann Oncol 2020; 31: 942-950.
- Burtness B, et al: Pembrolizumab da solo o con chemioterapia rispetto a cetuximab con chemioterapia per il carcinoma a cellule squamose ricorrente o metastatico della testa e del collo (KEYNOTE-048): uno studio di fase 3 randomizzato, in aperto. Lancet 2019; 394: 1915-1928.
- Burtness B, et al: Abstract LB-258: Efficacia di pembrolizumab in prima linea (1L) in base al punteggio positivo combinato PD-L1 <1, 1-19 e ≥20 nel carcinoma a cellule squamose della testa e del collo (HNSCC) ricorrente e/o metastatico (R/M): Analisi di sottogruppo KEYNOTE-048. Ricerca sul cancro. Associazione americana per la ricerca sul cancro (AACR), 2020.
- Matlung SE, et al.: Differenze negli infiltrati delle cellule T e nella sopravvivenza tra il carcinoma orofaringeo a cellule squamose HPV+ e HPV-. Futuro. Sci. OA. 2016; 2. DOI:10.4155/fso.15.88.
- Bauml J, et al: Pembrolizumab per il cancro della testa e del collo refrattario al platino e al cetuximab: risultati di uno studio di fase II a braccio singolo. J Clin Oncol 2017; 35: 1542-9.
- Wang J, et al: Lo stato di positività all’HPV è associato a un microambiente immunitario infiammato e a una migliore risposta alla terapia anti-PD-1 nel carcinoma a cellule squamose della testa e del collo. Sci Rep 2019; 9. DOI:10.1038/s41598-019-49771-0.
- Xu Y, et al.: Blocco dell’asse Morte programmata-1/Programmed Death-Ligand 1 nel carcinoma a cellule squamose della testa e del collo ricorrente o metastatico, stratificato in base allo stato del Papillomavirus umano: revisione sistematica e meta-analisi. Front Immunol 2021; 12. DOI:10.3389/fimmu.2021.645170.
- Cohen EEW, et al: Dichiarazione di consenso della Society for Immunotherapy of Cancer sull’immunoterapia per il trattamento del carcinoma a cellule squamose della testa e del collo (HNSCC). J Immunother Cancer 2019; 7. DOI:10.1186/s40425-019-0662-5.
- Braakhuis BJM, Brakenhoff RH, René Leemans C: Scelta del trattamento per i tumori della testa e del collo localmente avanzati in base ai fattori di rischio: fattori di rischio biologici. Ann Oncol 2012; 23. DOI:10.1093/annonc/mds299.
- Brana I, Siu LL: Cancro a cellule squamose della testa e del collo localmente avanzato: scelta del trattamento in base ai fattori di rischio e ottimizzazione della prescrizione di farmaci. Ann Oncol 2012; 23. DOI:10.1093/annonc/mds322.
- Cooper JS, et al: Radioterapia e chemioterapia concomitante postoperatoria per il carcinoma a cellule squamose ad alto rischio della testa e del collo. N Engl J Med 2004; 350: 1937-1944.
- Bernier J, et al: Irradiazione postoperatoria con o senza chemioterapia concomitante per il cancro della testa e del collo localmente avanzato. N Engl J Med 2004; 350: 1945-1952.
- Pignon JP, et al: Meta-analisi della chemioterapia nel cancro della testa e del collo (MACH-NC): un aggiornamento su 93 studi randomizzati e 17.346 pazienti. Radiother Oncol 2009; 92: 4-14.
- Adelstein D, et al: Linee guida NCCN® sui tumori della testa e del collo, versione 2.2017 con aggiornamenti alle linee guida NCCN. JNCCN J Natl Compr Cancer Netw 2017; 15: 761-770.
- Adelstein DJ, et al: Un confronto intergruppo di fase III tra la radioterapia standard e due programmi di chemioradioterapia concomitante nei pazienti con tumore a cellule squamose della testa e del collo non resecabile. J Clin Oncol 2003; 21: 92-98.
- Mohamed A, et al: Chemioradioterapia concomitante con cisplatino settimanale rispetto a quella trisettimanale nel carcinoma a cellule squamose localmente avanzato della testa e del collo: analisi comparativa. Testa-collo. 2019; 41: 1490-1498.
- Helfenstein S, et al: Cisplatino trisettimanale o settimanale in concomitanza con la radioterapia per i pazienti con carcinoma a cellule squamose della testa e del collo – Un’analisi multicentrica, retrospettiva. Radiat Oncol 2019; 14. DOI:10.1186/s13014-019-1235-y.
- Bonner JA, et al: Radioterapia più cetuximab per il tumore della testa e del collo locoregionale avanzato: dati di sopravvivenza a 5 anni da uno studio randomizzato di fase 3 e relazione tra l’eruzione cutanea indotta da cetuximab e la sopravvivenza. Lancet Oncol 2010; 11: 21-28.
- Mehanna H, et al: Radioterapia più cisplatino o cetuximab nel carcinoma orofaringeo a basso rischio positivo al papillomavirus umano (De-ESCALaTE HPV): uno studio randomizzato controllato di fase 3 in aperto. Lancet 2019; 393: 51-60.
- Gillison ML, et al: Radioterapia più cetuximab o cisplatino nel tumore orofaringeo positivo al papillomavirus umano (NRG Oncology RTOG 1016): uno studio randomizzato, multicentrico, di non inferiorità. Lancet 2019; 393: 40-50.
- Bourhis J, et al: TrilynX: uno studio di fase 3 su xevinapant e chemioradiografia concomitante per il tumore della testa e del collo localmente avanzato. J Clin Oncol 2021; 39: TPS6091-TPS6091.
- Yu Y, Lee NY: JAVELIN Head and Neck 100: uno studio di fase III su avelumab e chemioradiografia per il tumore della testa e del collo localmente avanzato. Futur Oncol 2019; 15: 687-694.
- Cohen EE, et al.: Risultati primari dello studio di fase III JAVELIN head & neck 100: Avelumab più chemioradioterapia (CRT) seguita da avelumab di mantenimento vs CRT in pazienti con carcinoma a cellule squamose della testa e del collo localmente avanzato (LA SCCHN). Congresso ESMO 2020: Annali di Oncologia (2020) 31 (suppl_4): S599-S628.
- Topalian SL, Taube JM, Pardoll DM: Blocco del checkpoint neoadiuvante per l’immunoterapia del cancro. Scienza 2020; 367. DOI:10.1126/science.aax0182.
- Rothschild SI, et al: SAKK 16/14: Durvalumab in aggiunta alla chemioterapia neoadiuvante nei pazienti con carcinoma polmonare non a piccole cellule in stadio IIIA(N2) – studio di fase II multicentrico a braccio singolo. J Clin Oncol 2021; 39: 2872-2880.
- Friedman J, et al: Il blocco del checkpoint immunitario PD-1 neoadiuvante inverte l’immunodominanza funzionale tra le cellule T antigene-specifiche del tumore. Clin Cancer Res 2020; 26: 679-689.
- Schoenfeld JD, et al: Nivolumab neoadiuvante o Nivolumab più Ipilimumab nel carcinoma a cellule squamose della cavità orale non trattato: uno studio clinico randomizzato di fase 2 in aperto. JAMA Oncol 2020; 6: 1563-1570.
- Ferrarotto R, et al.: Impatto del durvalumab neoadiuvante con o senza tremelimumab sulla densità dei linfociti CD8+ tumorali, sulla sicurezza e sull’efficacia nei pazienti con cancro orofaringeo: risultati dello studio CIAO. Clin Cancer Res 2020; 26: 3211-3219.
- Vos JL, et al: L’immunoterapia neoadiuvante con nivolumab e ipilimumab induce risposte patologiche importanti nei pazienti con carcinoma a cellule squamose della testa e del collo. Nat Commun 2021; 12. DOI:10.1038/s41467-021-26472-9.
- Ferris RL, et al: nivolumab neoadiuvante per i pazienti con carcinomi a cellule squamose della testa e del collo resecabili HPV-positivi e HPV-negativi nello studio CheckMate 358. J Immunother Cancer 2021; 9. DOI:10.1136/jitc-2021-002568.
- Merlino DJ, et al: Risposte discordanti tra tumori primari della testa e del collo e metastasi nodali trattati con Nivolumab neoadiuvante: correlazione tra effetto del trattamento radiografico e patologico. Front Oncol 2020; 10. DOI:10.3389/fonc.2020.566315.
- Xiong Y, et al: Effetti immunologici dell’immunoterapia con nivolumab nei pazienti con carcinoma a cellule squamose della cavità orale. BMC Cancer 2020; 20. DOI: 10.1186/s12885-020-06726-3.
- Uppaluri R, et al: Pembrolizumab neoadiuvante e adiuvante nel cancro della testa e del collo localmente avanzato, non correlato al Papillomavirus umano, resecabile: uno studio multicentrico di fase II. Clin Cancer Res 2020; 26: 5140-52.
- Yan Y, et al.: Combinazione degli inibitori del checkpoint immunitario con la terapia oncologica convenzionale. Anteriore. Immunol. 2018; 9. DOI:10.3389/fimmu.2018.01739.
InFo ONCOLOGIA & EMATOLOGIA 2022; 10(1): 5-11