Le terapie curative per il carcinoma epatocellulare sono la resezione chirurgica, l’ablazione e il trapianto di fegato. Le raccomandazioni valide a livello internazionale per il trapianto di fegato per l’HCC sono state formulate in occasione della Conferenza di Consenso di Zurigo 2010.
Il carcinoma epatocellulare (HCC) è la terza causa di morte legata al cancro a livello mondiale e la sesta causa di morte legata al cancro in Svizzera [1]. L’incidenza è in aumento nel corso di molti anni. Le cause principali sono le infezioni da virus dell’epatite B/C (HBV/HCV) e, più recentemente, l’aumento epidemiologico della steatoepatite non alcolica (NASH). Se non trattato, l’HCC ha una prognosi sfavorevole, con un tasso di sopravvivenza a 5 anni inferiore al 10%. La maggior parte dei pazienti sviluppa un carcinoma epatocellulare in presenza di cirrosi epatica, il che rende le strategie di trattamento ottimali molto più difficili. Nell’ultimo decennio, sono stati compiuti progressi decisivi nella conoscenza biomedica della malattia e nella terapia. Le opzioni di trattamento si basano principalmente su approcci chirurgici (resezione, trapianto di fegato) e non chirurgici (chemioembolizzazione interventistica radiologica, ablazione locoregionale, chemioterapia). Nel caso della malattia HCC localizzata e non multifocale, l’asportazione chirurgica del tumore e il trapianto di fegato sono il gold standard [2,3].
Presentazione clinica e diagnosi
I sintomi e l’aspetto clinico dipendono dallo stadio della malattia tumorale. In uno stadio avanzato, i pazienti spesso presentano la triade dolore addominale superiore, tumore palpabile nell’addome superiore destro e perdita di peso. Inoltre, si verificano ascite e segni clinici di ipertensione portale e raramente ittero. In meno del 5% dei casi, i pazienti presentano la rottura del tumore, che può anche portare a un’emorragia pericolosa per la vita e a una “disseminazione tumorale” intra-addominale. Inoltre, sono state descritte numerose complicazioni paraneoplastiche, come ipoglicemia, ipercalcemia, eritrocitosi e osteoartropatia polmonare ipertrofica. Nei pazienti con cirrosi epatica che vengono monitorati in un programma di screening, i tumori possono essere individuati in una fase più precoce.
Il marcatore tumorale α-fetoproteina (AFP) è elevato fino al 90% dei pazienti con HCC; tuttavia, non è correlato all’estensione della malattia tumorale ed è limitato sia nella sua specificità che nella sua sensibilità, in quanto anche le malattie benigne come l’epatite e la cirrosi epatica possono essere associate a un aumento dell’AFP. Come regola di base, un AFP >200 ng/ml in combinazione con una diagnostica per immagini appropriata è altamente sensibile per la malattia HCC.
In termini di imaging, l’attenzione si concentra su TAC, RM e US. Gli ultrasuoni sono adatti come metodo di screening a basso costo. Tuttavia, la bassa sensibilità e specificità e l’alto tasso di falsi negativi, superiore al 50%, sono i limiti di questo esame.
Simili ai criteri BiRAD stabiliti per il carcinoma mammario, i criteri LiRAD (tra cui l’accumulo del mezzo di contrasto nella fase arteriosa, le dimensioni del reperto, il “wash out”) sono stati definiti dalla Società Americana di Radiologia. In base a questi criteri, un nodulo epatico può essere valutato in relazione alla sua malignità.
Grazie al miglioramento della diagnostica per immagini, la conferma della diagnosi è indicata solo in caso di risultati inconcludenti. In questo caso, la biopsia percutanea con ago sottile guidata da ultrasuoni è il gold standard, anche se può verificarsi una semina del tumore lungo il canale bioptico in <1%.
Stadiazione secondo la classificazione BCLC
La stadiazione e la scelta appropriata della terapia vengono effettuate secondo l’algoritmo di classificazione della Barcelona Clinic Liver Cancer (BCLC), che definisce cinque stadi della malattia HCC. Questi dipendono dal numero e dalle dimensioni del tumore, dallo stadio di Child-Pugh e dallo stato di performance ECOG (Fig. 1) [4].
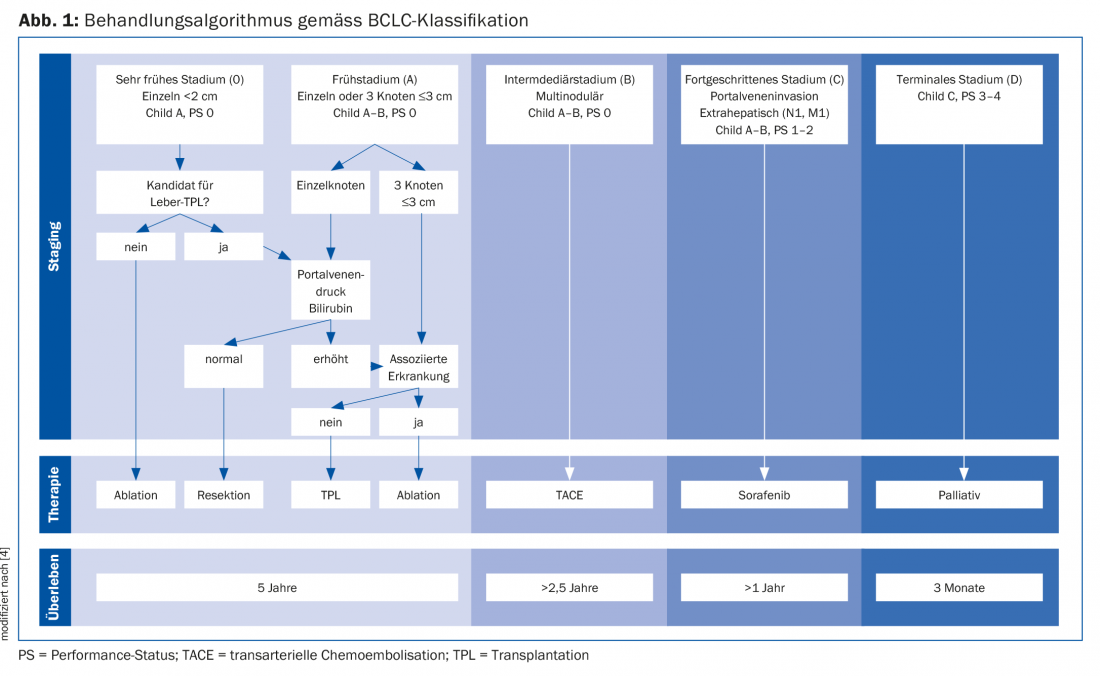
Terapie conservative: Terapia di sistema vs. terapie locali
I metodi di terapia conservativa includono la terapia sistemica (inibitori della multichinasi e immunoterapia) e i metodi di ablazione del tumore. L’inibitore della proteina chinasi sorafenib è indicato come terapia di prima linea per il BCLC in stadio C. C’è un vantaggio di sopravvivenza di 10,7 vs. 7,9 mesi nei pazienti trattati con sorafenib (vs. placebo) [5]. Anche gli inibitori multichinasici più recenti, come lenvatinib, sembrano essere efficaci secondo gli attuali studi di non inferiorità (non ancora pubblicati: Cheng et al., abstract 4001 all’ASCO 2017) e saranno presto approvati come terapie sistemiche di prima linea. Inoltre, altri inibitori multichinasici (ad esempio, regorafenib e cabozantinib) saranno presto disponibili come terapie di seconda linea [6].
Ancora poco chiaro e oggetto di ricerca attuale è il ruolo dell’immunoterapia, con studi di fase II con nivolumab che mostrano risultati promettenti. Pertanto, possiamo attendere con ansia i prossimi studi sull’efficacia.
I pazienti con HCC in lista per il trapianto di fegato vengono rivalutati regolarmente. In caso di progressione epatica della malattia tumorale al di fuori dei criteri di inclusione – determinata con la diagnostica per immagini e l’AFP – in molti casi si verifica un’inclusione inattiva e si prevede un downstaging. Se si verifica una progressione nonostante le terapie locoregionali, il paziente deve essere “cancellato” dalla lista d’attesa per il trapianto. I centri di trapianto con lunghe liste d’attesa eseguono terapie ponte locali per il controllo del tumore in questi pazienti. Questi includono la chemioembolizzazione transarteriosa (TACE), l’ablazione con radiofrequenza (RFA) e microonde (MWA) e l’iniezione percutanea di etanolo (PEI) [7]. La TACE è un’embolizzazione selettiva dell’afflusso arterioso dell’epatoma con agenti chemioterapici (principalmente cisplatino o doxorubicina), che in combinazione porta al danno ischemico del tumore e alla chemioterapia locale con pochi effetti collaterali sistemici. Con questo metodo interventistico, si può ottenere una riduzione delle dimensioni del tumore dal 50% fino alla completa necrosi tumorale. La TACE può essere utilizzata anche per ridurre il tasso di abbandono della lista d’attesa e il tasso di recidiva del tumore dopo il trapianto di fegato e per ottenere un downstaging. La RFA/MWA prevede il posizionamento percutaneo, assistito da immagini, di una sonda RFA nel tumore, che viene distrutto termicamente con energia elettrica alternata ad alta frequenza. I risultati sono soddisfacenti e sono stati pubblicati resoconti di un tasso di abbandono pari allo zero per cento e di una sopravvivenza a 3 anni fino all’83 per cento [8]. La PEI è stata meno studiata come terapia ponte. L’uso di un ago sottile rende l’operazione teoricamente meno invasiva e quindi meno probabile che provochi la semina del tumore. Con uno spettro di effetti collaterali favorevole del PEI, si possono ottenere risultati di successo con una necrosi tumorale fino all’80%. Tuttavia, poiché sono necessari diversi trattamenti, la maggior parte di questa tecnica è stata sostituita dalla RFA. Le nuove tecniche di ablazione, come la radioterapia interna selettiva (SIRT), mostrano risultati promettenti in termini di risposta tumorale e di sopravvivenza [4]. In uno studio recente, i pazienti con HCC dopo TACE frustrata sono stati trattati con SIRT rispetto a sorafenib; non c’è stata alcuna differenza nella sopravvivenza [9]. Tuttavia, secondo gli studi attuali, l’importanza della SIRT resta da definire [4].
In caso di dimensioni e numero di tumori borderline dopo la terapia ponte, il paziente viene inserito nell’elenco degli inattivi per conoscere la biologia del tumore mediante risonanza magnetica, TAC e AFP nel corso. Se non si osserva alcuna progressione del tumore dopo un periodo di attesa inattivo di tre mesi nella lista, il paziente può essere inserito nella lista attiva.
Terapia chirurgica: resezione vs. trapianto di fegato
Il gold standard per l’HCC è la resezione chirurgica o il trapianto ortotopico di fegato. Tuttavia, solo il 10-30% dei pazienti con HCC è candidato alla resezione. Dopo una laparotomia esplorativa, la resezione curativa può essere eseguita solo nel 50-70% dei pazienti. L’unica controindicazione alla chirurgia è rappresentata dalle metastasi extraepatiche. La resecabilità dipende dalle dimensioni del tumore, dal numero, dalla vicinanza ai vasi sanguigni e dalla malattia epatica sottostante. L’obiettivo dell’intervento è una resezione completa nel tessuto sano, corrispondente a un R0 istopatologico. La resecabilità è determinata anche dal volume epatico residuo in situ (“futuro residuo epatico”, FLR) e dall’ipertensione portale. Secondo il nostro algoritmo proposto, deve rimanere un volume residuo di fegato libero da tumore di almeno il 50%. Per volumi inferiori a questo valore, si può eseguire l’embolizzazione della vena porta per l’induzione del volume. L’ipertensione portale non è più necessariamente una controindicazione assoluta alla resezione epatica [10,11]. Quando si prende in considerazione la resezione nei pazienti cirrotici, si dovrebbe perseguire una procedura chirurgica minimamente invasiva ogni volta che è possibile, poiché questo gruppo di pazienti ne trae particolare beneficio [12]. Noi a Zurigo offriamo ai nostri pazienti interventi di resezione laparoscopica e robotica come operazioni minimamente invasive [7].
Per i tumori più piccoli (<2-3 cm) si discute l’indicazione all’ablazione curativa, poiché è stata postulata una sopravvivenza equivalente rispetto alla resezione chirurgica [13,14]. Tuttavia, il valore di questi studi deve essere considerato con riserva, poiché da un lato si tratta di analisi di sottogruppi di studi retrospettivi con un livello di evidenza limitato e dall’altro i pochi studi prospettici condotti finora non hanno mostrato alcuna differenza [7].
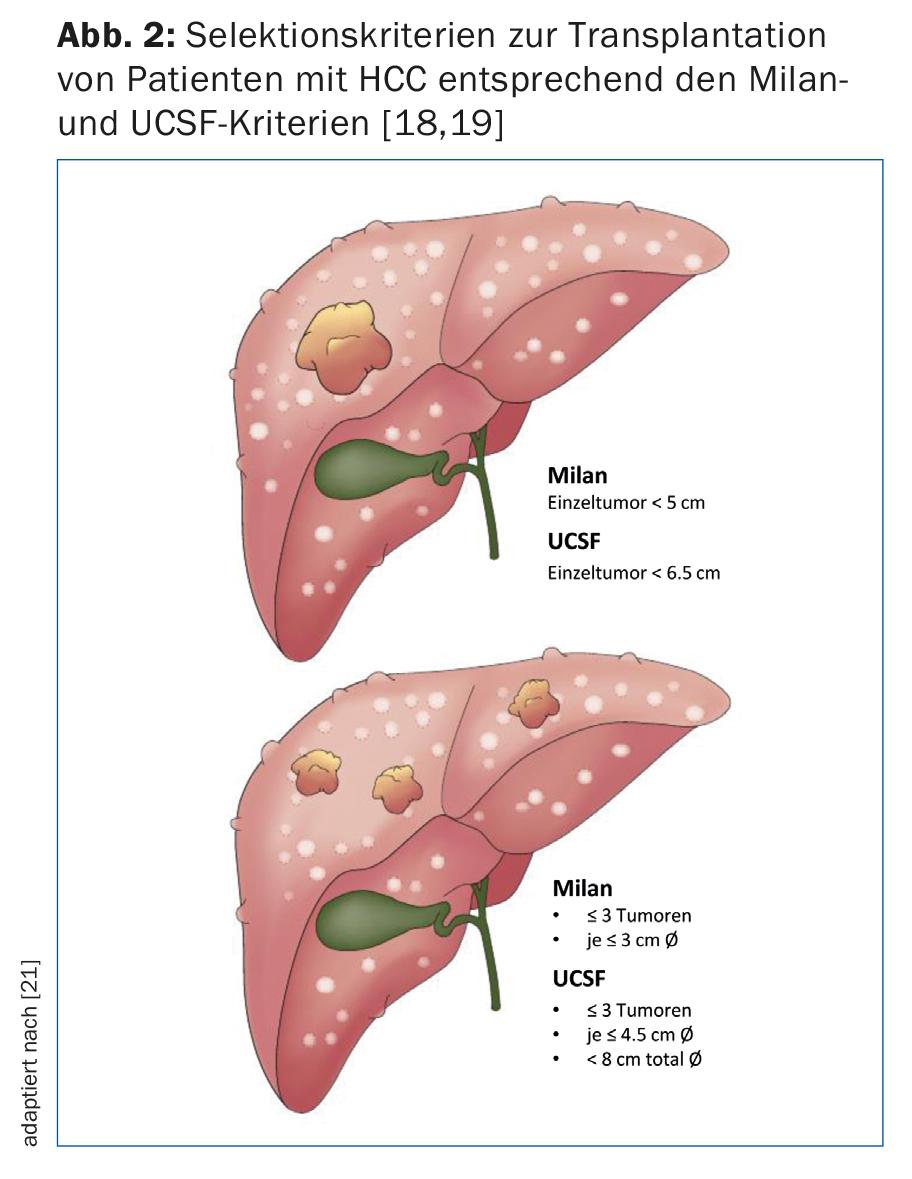
Il trapianto di fegato è chiaramente superiore alla resezione in termini di sopravvivenza libera da recidiva a 5 anni ed è certamente la migliore opzione terapeutica nei pazienti cirrotici con HCC di piccole dimensioni. A causa della scarsità di organi di donatori e dello stadio spesso avanzato della malattia, al di fuori dei criteri accettati (Fig. 2), il trapianto può essere offerto solo in una popolazione selettiva di HCC. Pertanto, la resezione rimane il trattamento di scelta per i pazienti cirrotici con funzione epatica compensata (stadio Child-Pugh A) senza ipertensione portale (Fig. 3) [15].
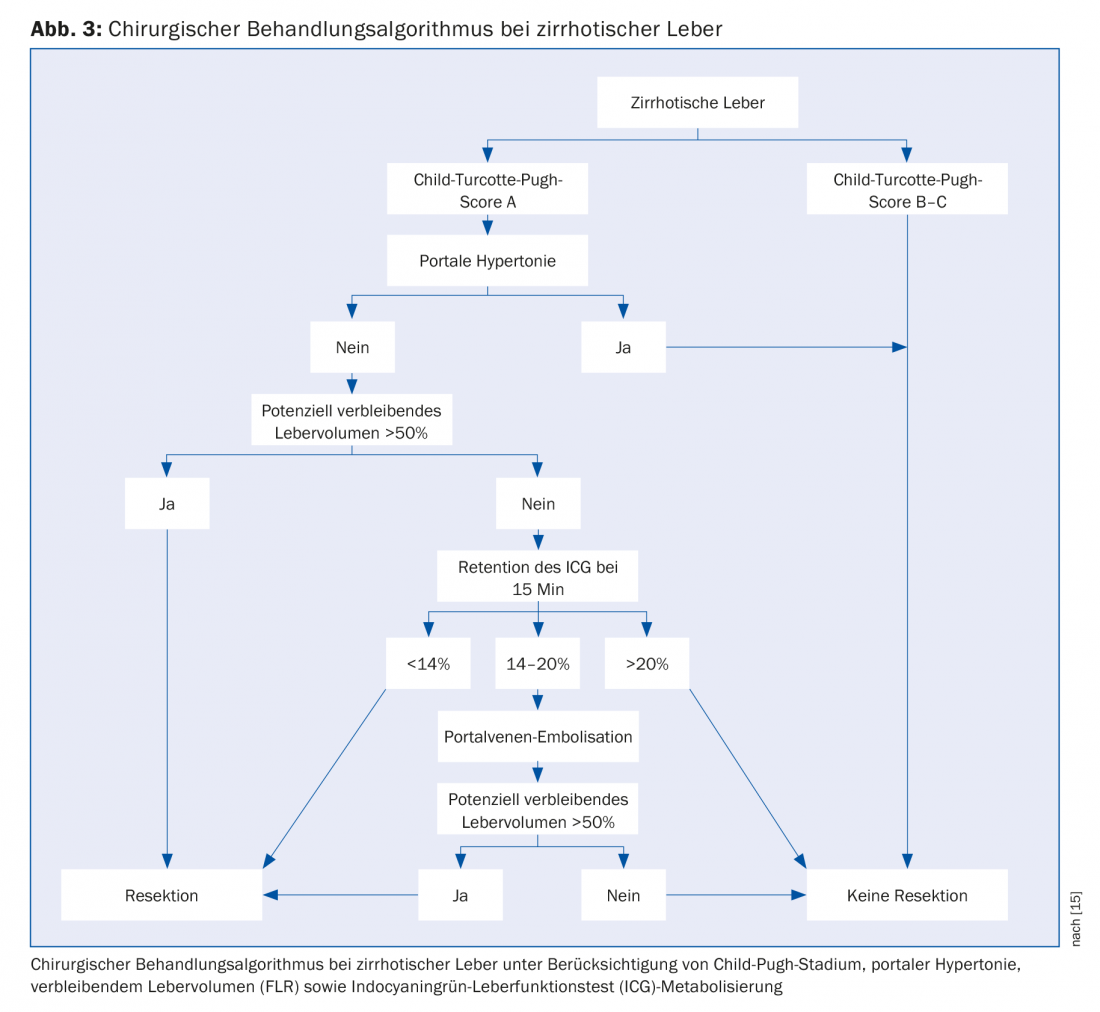
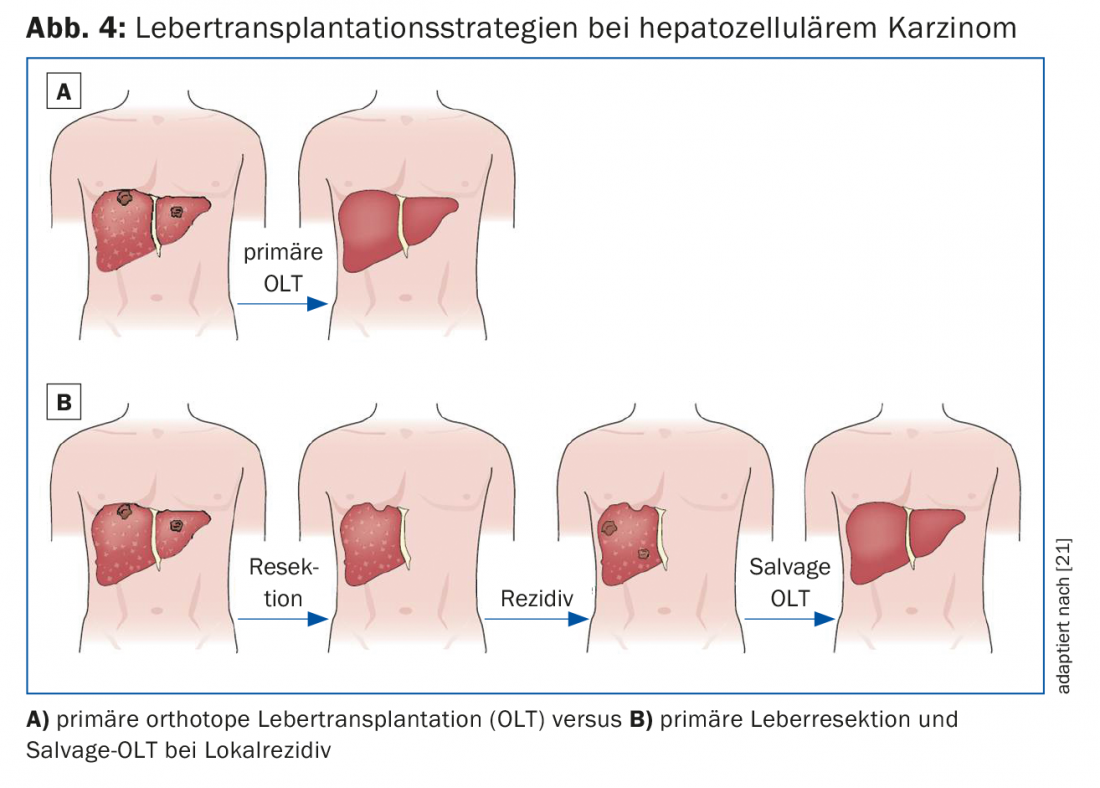
La terapia combinata di resezione epatica e trapianto può essere presa in considerazione in tre diversi scenari clinici:
- Terapia primaria con trapianto di salvataggio in caso di recidiva del tumore (Fig. 4)
- Procedura diagnostica per la valutazione istopatologica del tumore in relazione all’invasione vascolare e ai satelliti tumorali, con conseguente selezione adeguata dei candidati al trapianto.
- Terapia ponte prima del trapianto per garantire il controllo del tumore secondo i criteri di Milano o UCSF (Fig. 2) [16].
I pazienti con HCC con funzione epatica non compensata (Child-Pugh B o C) e/o ipertensione portale devono essere trattati principalmente con il trapianto di fegato, se la malattia tumorale rientra nei rispettivi criteri di trapianto accettati (Fig. 2).
Il trapianto di fegato sembra essere la terapia ideale per il carcinoma epatocellulare, poiché l’asportazione completa del fegato infestato dal tumore corrisponde formalmente a un’asportazione oncologica del tumore con margini di resezione negativi. Nel contesto della carenza di organi da donare, il trapianto di fegato viene preso in considerazione solo nei pazienti la cui sopravvivenza è paragonabile a quella di un ricevente senza HCC.
Originariamente, il gruppo di Bismuth ha riportato l’estensione dell’infestazione tumorale come marcatore surrogato della biologia del tumore. Hanno dimostrato che i pazienti con tumori piccoli uni- o binodulari <3 cm hanno una sopravvivenza migliore in caso di trapianto rispetto alla resezione del tumore (83% vs. 18%). Inoltre, i pazienti con HCC diffuso con più di due noduli >3 cm o con trombo della vena porta avevano un tasso di recidiva più elevato con conseguente riduzione della sopravvivenza [17]. Mazzaferro et al. ha studiato i pazienti con cirrosi e HCC non resecabile che sono stati trattati con il trapianto. Hanno stabilito criteri specifici – la base dei cosiddetti criteri di Milano – definiti come un singolo tumore <5 cm o ≤3 tumori ciascuno <3 cm di diametro (Fig. 2). I pazienti che rispondevano ai criteri di Milano hanno mostrato un miglioramento significativo della sopravvivenza libera da recidiva e della sopravvivenza globale dopo il trapianto [18]. Numerosi studi hanno riportato eccellenti dati di sopravvivenza nei pazienti con HCC trapiantati secondo questi criteri. Questo ha portato alcuni esperti a considerare i criteri troppo restrittivi. Infatti, un gruppo di ricerca dell’Università della California, San Francisco (UCSF) ha dimostrato che anche i pazienti che non rientrano nei criteri di Milano traggono un beneficio significativo dal trapianto. I criteri UCSF più ampi sono definiti come un singolo tumore ≤6,5 cm o ≤3 tumori ciascuno ≤4,5 cm e somma dei diametri totali del tumore ≤8 cm (Fig. 2) [19]. L’Associazione Europea dei Trapianti di Fegato e Intestino (ELITA) e la Società Internazionale dei Trapianti di Fegato (ILTS) hanno lanciato il progetto Metroticket. In base ai dati pre- e post-operatori del paziente (dimensione massima del tumore, numero di tumori, valore AFP), è possibile prevedere la sopravvivenza “post-trapianto” utilizzando un calcolatore online sul sito web www.hcc-olt-metroticket.org [20] (Fig. 5).
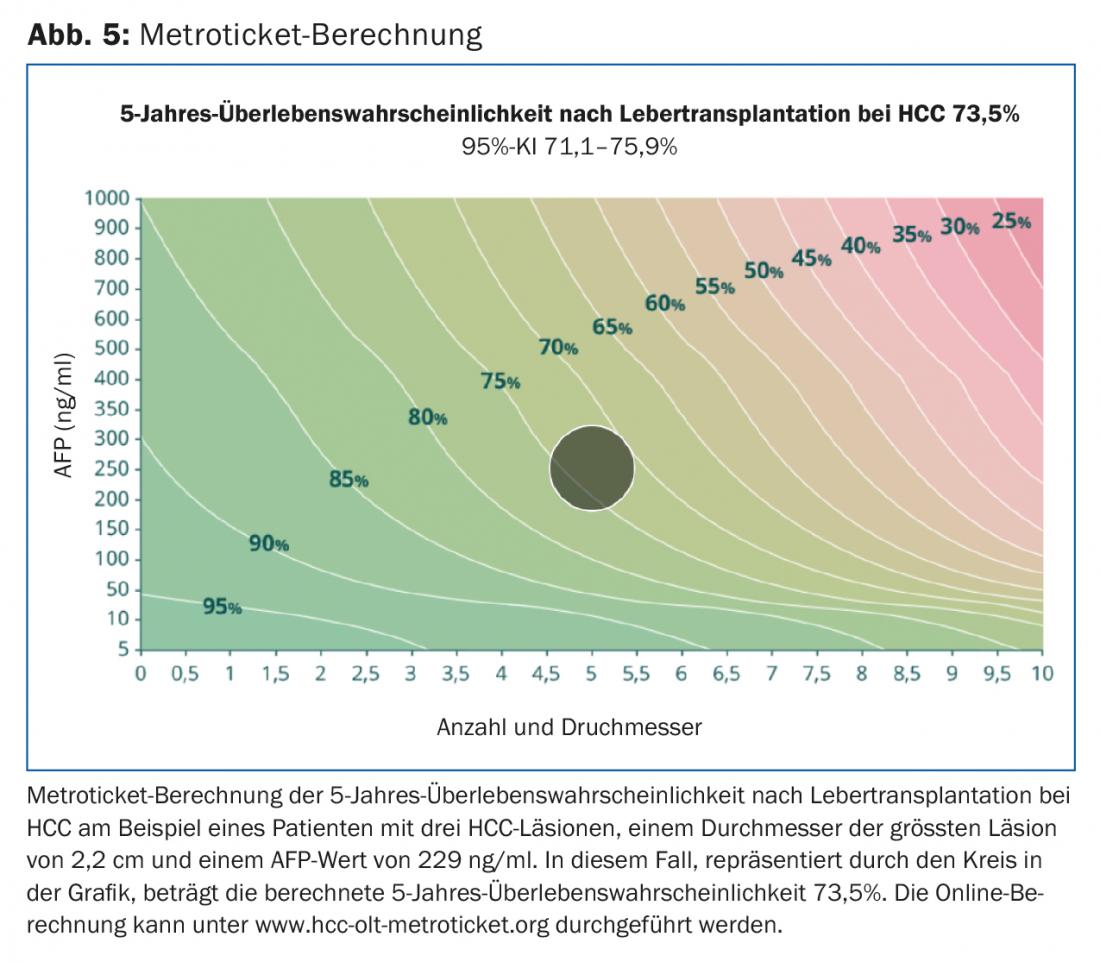
I pazienti trapiantati secondo i criteri di Milano o UCSF hanno dati di sopravvivenza simili (80% contro 75% di sopravvivenza a 5 anni). Tuttavia, il trapianto al di fuori dei criteri UCSF è associato a una sopravvivenza ridotta, con un tasso di sopravvivenza a 5 anni ben al di sotto del 50%. Indipendentemente dalle dimensioni e dal numero del tumore, l’evidenza dell’invasione macrovascolare del tumore è una controindicazione al trapianto di fegato.
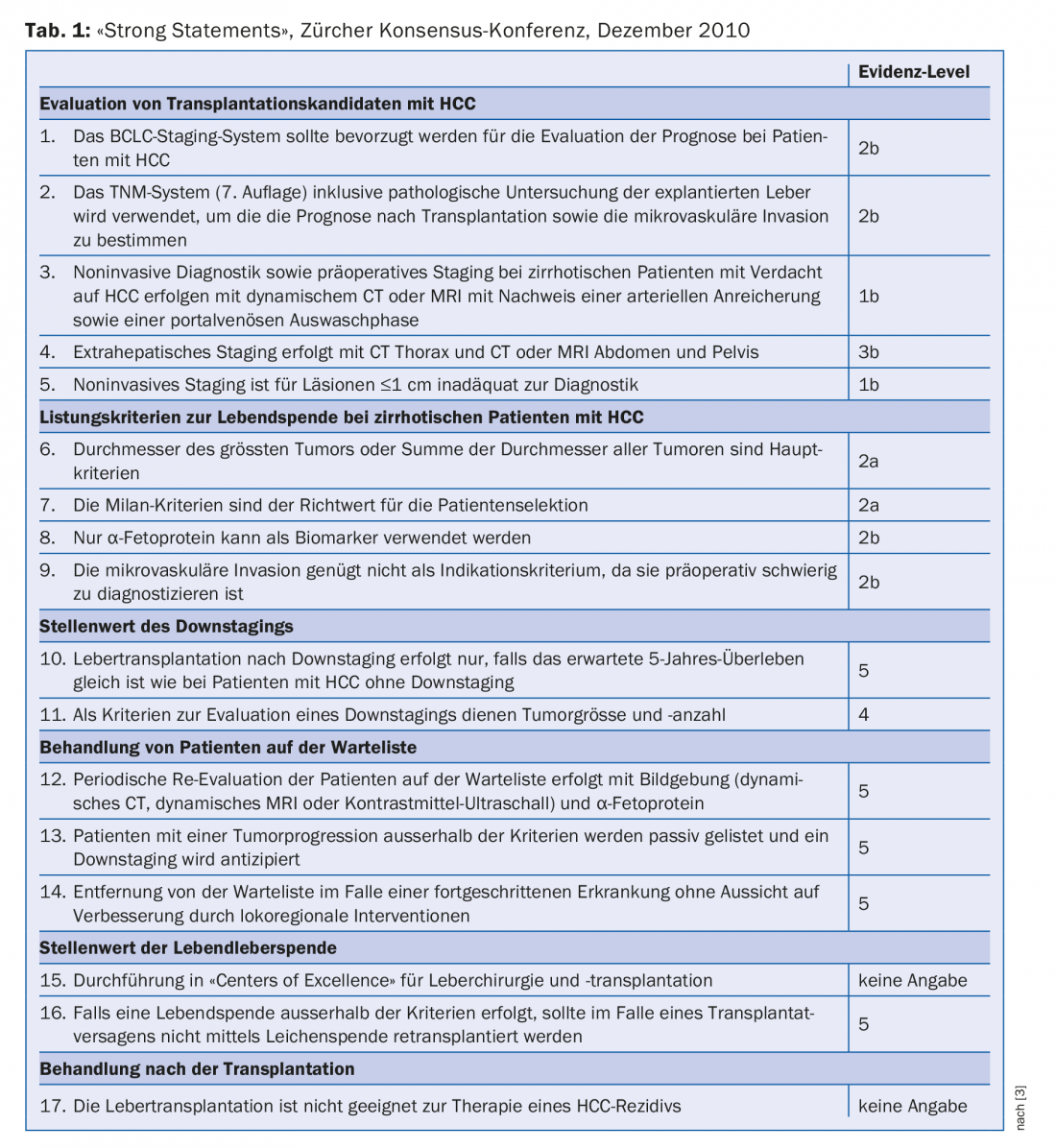
Nel dicembre 2010, si è tenuta a Zurigo una conferenza di consenso con esperti internazionali. L’obiettivo era quello di elaborare la pratica attuale del trapianto di fegato per l’HCC e di sviluppare linee guida accettate a livello internazionale. In totale sono state formulate 37 affermazioni e raccomandazioni. Questi riguardano le aree di: Valutazione dei candidati al trapianto di fegato, criteri per l’inserimento in lista di pazienti cirrotici e non cirrotici, ruolo del downstaging del tumore, trattamento dei pazienti in lista d’attesa, valore della donazione di fegato da vivente e trattamento post-trapianto. Le 17 raccomandazioni più importanti (“dichiarazioni forti”) sono riassunte nella Tabella 1 [3].
Messaggi da portare a casa
- L’incidenza del carcinoma epatocellulare (HCC) è in aumento in tutto il mondo.
- Le strategie di trattamento curativo comprendono la resezione chirurgica, l’ablazione e il trapianto di fegato.
- Dopo sorafenib, lenvatinib può essere utilizzato come terapia di prima linea.
- Il trapianto di fegato tramite donazione da cadavere o da vivente è una possibile opzione di trattamento per i pazienti con HCC e malattia epatica in fase terminale (ESLD).
- I pazienti in lista d’attesa per il trapianto beneficiano di terapie ponte costituite da chemioembolizzazione transarteriosa (TACE), ablazione con radiofrequenza (RFA) e iniezione percutanea di etanolo (PEI). Il ruolo della SIRT è oggetto di ricerca attuale.
- Le raccomandazioni valide a livello internazionale per il trapianto di fegato nei pazienti con HCC sono state formulate alla Conferenza di Consenso di Zurigo nel dicembre 2010.
Letteratura:
- Parkin DM, et al: Statistiche globali sul cancro, 2002. CA Cancer J Clin 2005; 55: 74-108.
- Dutkowski P, et al: Sfide al trapianto di fegato e strategie per migliorare i risultati. Gastroenterologia 2015 Feb; 148(2): 307-323.
- Clavien PA, et al: Raccomandazioni per il trapianto di fegato per il carcinoma epatocellulare: rapporto di una conferenza di consenso internazionale. The Lancet Oncology 2012; 13: e11-22.
- Bruix J, Reig M, Sherman M: Diagnosi, stadiazione e trattamento dei pazienti con carcinoma epatocellulare basati sull’evidenza. Gastroenterologia 2016; 150: 835-853.
- Llovet JM, et al: Sorafenib nel carcinoma epatocellulare avanzato. The New England Journal of Medicine 2008; 359: 378-390.
- Bruix J, et al: Regorafenib per i pazienti con carcinoma epatocellulare che sono progrediti con il trattamento con sorafenib (RESORCE): uno studio di fase 3, randomizzato, in doppio cieco, controllato con placebo. Lancet 2017; 389: 56-66.
- Petrowsky H, Busuttil RW: Resezione o ablazione del piccolo carcinoma epatocellulare: qual è il trattamento migliore? Giornale di Epatologia 2008; 49: 502-504.
- Mazzaferro V, et al: Ablazione con radiofrequenza di un piccolo carcinoma epatocellulare in pazienti cirrotici in attesa di trapianto di fegato: uno studio prospettico. Annali di Chirurgia 2004; 240: 900-909.
- Vilgrain V, et al: Efficacia e sicurezza della radioterapia interna selettiva con microsfere di resina di ittrio-90 rispetto a sorafenib nel carcinoma epatocellulare localmente avanzato e non operabile (SARAH): uno studio randomizzato controllato di fase 3 in aperto. The Lancet Oncology 2017; 18: 1624-1636.
- Capussotti L, et al: Resezione epatica per il carcinoma epatocellulare nella cirrosi: analisi di mortalità, morbilità e sopravvivenza – un’esperienza europea di un singolo centro. European journal of surgical oncology: la rivista della Società Europea di Oncologia Chirurgica e dell’Associazione Britannica di Oncologia Chirurgica 2005; 31: 986-993.
- Cucchetti A, et al: L’ipertensione portale è una controindicazione alla resezione epatica? Annali di chirurgia 2009; 250: 922-928.
- Abu Hilal M, et al: Le linee guida di consenso di Southampton per la chirurgia epatica laparoscopica: dall’indicazione all’implementazione. Annali di chirurgia 2017. DOI: 10.1097/SLA.00000000002524 [Epub ahead of print].
- Vivarelli M, et al: Resezione chirurgica rispetto all’ablazione percutanea con radiofrequenza nel trattamento del carcinoma epatocellulare su fegato cirrotico. Annali di Chirurgia 2004; 240: 102-107.
- Guglielmi A, et al: Ablazione con radiofrequenza rispetto alla resezione chirurgica per il trattamento del carcinoma epatocellulare nella cirrosi. Journal of gastrointestinal surgery: official journal of the Society for Surgery of the Alimentary Tract 2008; 12: 192-198.
- Clavien PA, et al: Strategie per una chirurgia epatica più sicura e per il trapianto parziale di fegato. N Engl J Med 2007; 356: 1545-1559.
- Chua TC, et al: Resezione epatica per il carcinoma epatocellulare trapiantabile per i pazienti che rientrano nei criteri di Milano e UCSF. Am J Clin Oncol 2012; 35: 141-145.
- Bismuth H, et al: Resezione epatica rispetto al trapianto per il carcinoma epatocellulare nei pazienti cirrotici. Annali di chirurgia 1993; 218: 145-151.
- Mazzaferro V, et al: Trapianto di fegato per il trattamento di piccoli carcinomi epatocellulari in pazienti con cirrosi. N Engl J Med 1996; 334: 693-699.
- Yao FY, et al: Trapianto di fegato per il carcinoma epatocellulare: l’espansione dei limiti di dimensione del tumore non ha un impatto negativo sulla sopravvivenza. Epatologia 2001; 33: 1394-1403.
- Mazzaferro V, et al: Previsione della sopravvivenza dopo il trapianto di fegato nei pazienti con carcinoma epatocellulare oltre i criteri di Milano: un’analisi retrospettiva, esplorativa. The Lancet Oncology 2009; 10: 35-43.
- Agopian V, Petrowsky H: Trapianto di fegato per tumori maligni. In: Fong Y, et al. (Eds.): Cancro epatobiliare. People’s Medical Publishing House 2014; 293-316.
PRATICA GP 2018; 13(1): 14-19











