Les maladies cardiovasculaires (MCV) restent la première cause de mortalité dans le monde. Les dernières lignes directrices sur la prévention de l’HKE indiquent dans quelle mesure l’augmentation du cholestérol des lipoprotéines de basse densité (LDL-C) est l’un des principaux contributeurs à l’HKE athérosclérotique. En conséquence, une réduction efficace du LDL-C est indiquée.
Les maladies cardiovasculaires (MCV) restent la première cause de mortalité dans le monde [1]. Les dernières statistiques de l’Organisation mondiale de la santé (OMS) montrent que 17,9 millions de personnes meurent chaque année de l’ACD dans le monde, ce qui représente, selon les estimations, 32% de tous les décès. Environ 85% d’entre eux sont dus à des infarctus du myocarde (crises cardiaques) et à des accidents vasculaires cérébraux.
Les dernières lignes directrices sur la prévention de l’HKE indiquent dans quelle mesure l’augmentation du cholestérol des lipoprotéines de basse densité (LDL-C) est l’un des principaux contributeurs à l’HKE athérosclérotique [2]. Étant donné que les concentrations élevées de LDL-C répondent à une réduction pharmacologique, les directives européennes et américaines applicables aux troubles lipidiques ont mis en avant des objectifs de traitement dans différentes catégories de patients afin de souligner la nécessité d’une réduction bénéfique du LDL-C chez les patients présentant un risque élevé d’HKE ou chez les patients présentant un HKE existant. Les statines ont été établies pendant près de deux décennies comme l’étalon-or pour le traitement du cholestérol en prévention primaire et secondaire. Ces dernières années, l’ézétimibe a été le deuxième médicament à être ajouté au traitement par statine. L’ézétimibe inhibe l’absorption intestinale du cholestérol, ce qui permet une réduction supplémentaire du LDL-C.
Malgré le succès des statines, les données des registres montrent que les traitements actuellement disponibles sont sous-utilisés. L’étude NOR-COR (NORwegian CORonary) publiée en 2017 a montré que chez les patients ayant survécu à un infarctus aigu du myocarde (crise cardiaque), 57% avaient un taux de LDL-C supérieur à 1,8 mmol/l ; 22% supérieur à 2,5 mmol/l ; et 10% supérieur à 3,0 mmol/l, à un moment situé entre 2 et 36 mois après la crise cardiaque [3]. Dans l’étude POLASPIRE, menée en 2017-2018 dans le cadre de l’étude EUROASPIRE V, les valeurs cibles pour le LDL-C n’ont été atteintes que par 20% des femmes et 25% des hommes [4]. Selon les directives actuelles, ces patients doivent viser un taux de LDL-C de 1,4 mmol/l ou moins [2]. Atteindre les recommandations actuelles pour des concentrations de LDL-C encore plus basses représente un défi majeur dans la pratique clinique.
Parmi les groupes de personnes à haut risque, on trouve les personnes atteintes d’hypercholestérolémie familiale (HF). En raison de leur taux de cholestérol élevé dès la naissance, les patients atteints d’HF présentent un risque d’ECD beaucoup plus élevé que les personnes dont l’hypercholestérolémie est apparue plus tard [5]. La plupart des patients atteints de FH ne parviennent pas à atteindre leurs objectifs de traitement du LDL-C. Dans un groupe de personnes norvégiennes, 25% des patients en prévention primaire et seulement 8% des patients en prévention secondaire ont atteint des objectifs de LDL-C inférieurs respectivement à 2,5 mmol/l et à 1,8 mmol/l dans le cadre d’un traitement principalement par statines et ézétimibe [6]. Comme pour la prévention secondaire, les objectifs de traitement des FH ont été considérablement réduits dans les lignes directrices communes pour la prise en charge des dyslipidémies de 2019 de la Société européenne de cardiologie (ESC) et de la Société européenne d’athérosclérose (EAS), pour atteindre un C-LDL <1,8 mmol/l en prévention primaire et <1,4 mmol/l en prévention secondaire, ce qui souligne la nécessité de nouvelles options de traitement [7].
Un autre problème de la cardiologie préventive est le risque résiduel d’événements récurrents chez les patients souffrant d’un ECA établi, malgré les traitements préventifs actuels. Récemment, le rôle des lipoprotéines riches en triglycérides dans le développement de l’athérosclérose et de l’HKE a été reconnu [7]. Ces particules peuvent être les médiateurs de l’accumulation de cholestérol au sein de l’intima artérielle et déclencher des processus pro-inflammatoires. Alors que les fibrates ont des propriétés significatives de réduction des triglycérides, leur succès dans la réduction des événements cardiovasculaires est limité, ce qui conduit à s’intéresser aux médicaments qui modifient ou réduisent les risques cardiovasculaires liés à ces lipoprotéines. Un autre facteur qui augmente le risque résiduel est l’augmentation de la concentration de lipoprotéine(a) [Lp(a)]. Lp(a) est une particule de type LDL génétiquement déterminée, caractérisée par l’ajout d’apolipoprotéine(a) [apo(a)] à une particule à base d’apolipoprotéine B100. Jusqu’à 20% de la population présente un niveau qui pourrait augmenter son risque d’HKE. Les grands traitements hypolipémiants ont peu d’effet sur les concentrations de Lp(a), mais de nouvelles thérapies basées sur des gènes ciblant spécifiquement l’apo(a) sont en cours de développement.
Dans l’article suivant, nous allons donner un aperçu des preuves pour les principaux hypolipémiants récemment présentés ou en cours de développement, après l’introduction des statines et de l’ézétimibe.
Inhibiteur de la proprotéine convertase subtilisine/kexine de type 9 (PCSK9)
PCSK9 est une enzyme exprimée dans de nombreux tissus et cellules. Il se lie au récepteur des LDL sur les membranes des hépatocytes, ce qui vise à ce que le récepteur se dégrade intracellulairement dans les lysosomes. Les récepteurs LDL qui ne sont pas liés à PCSK9 peuvent être remis en circulation plus de 100 fois. Le blocage de PCSK9 entraîne une augmentation des récepteurs LDL fonctionnels, une augmentation du transport des particules LDL de l’espace extracellulaire vers l’espace intracellulaire, et donc une diminution de la concentration de LDL-C dans le sang. (Fig. 1). Les deux premiers inhibiteurs de PCSK9, l’alirocumab et l’évolocumab, ont été approuvés en 2015 par l’Agence européenne des médicaments (EMA) et la Food and Drug Administration (FDA) sous forme d’injections une fois toutes les deux semaines ou une fois par mois. Une méta-analyse récente chez des patients atteints d’HKE athéroscléreuse mais pas de FH, impliquant 66 478 patients dans 39 essais contrôlés randomisés, a montré que les inhibiteurs de PCSK9 permettent d’obtenir une réduction du LDL-C d’environ 60%. Cette réduction a été associée à une diminution du risque d’infarctus du myocarde (risque relatif [RR], 0,80 ; intervalle de confiance à 95% [KI], 0,74-0,86 ; p<0,0001), d’accident vasculaire cérébral ischémique (RR, 0,78 ; 95% IC, 0,67-0,89 ; p=0,0005), et la revascularisation coronarienne (RR, 0,83 ; 95% IC, 0,78-0,89 ; p<0,0001), en comparaison avec les témoins. Cependant, les effets de l’inhibition de PCSK9 sur la mortalité générale et la mort cardio-vasculaire n’étaient pas statistiquement significatifs pendant la période d’observation moyenne de 2,3 ans ; une période qui était peut-être trop courte pour démontrer des effets sur la mortalité. Cependant, le tout dernier travail sur PCSK9, qui fait suite à l’une des plus grandes études de phase III, a eu une durée d’observation de 8,4 ans et a montré une réduction significative de la mortalité cardiovasculaire de 23% par rapport au placebo [8]. L’utilisation de ces inhibiteurs de PCSK9 n’a pas été associée à un risque accru d’événements neurocognitifs indésirables, d’augmentation des taux d’enzymes hépatiques, de rhabdomyolyse ou de diabète sucré d’apparition récente [8].
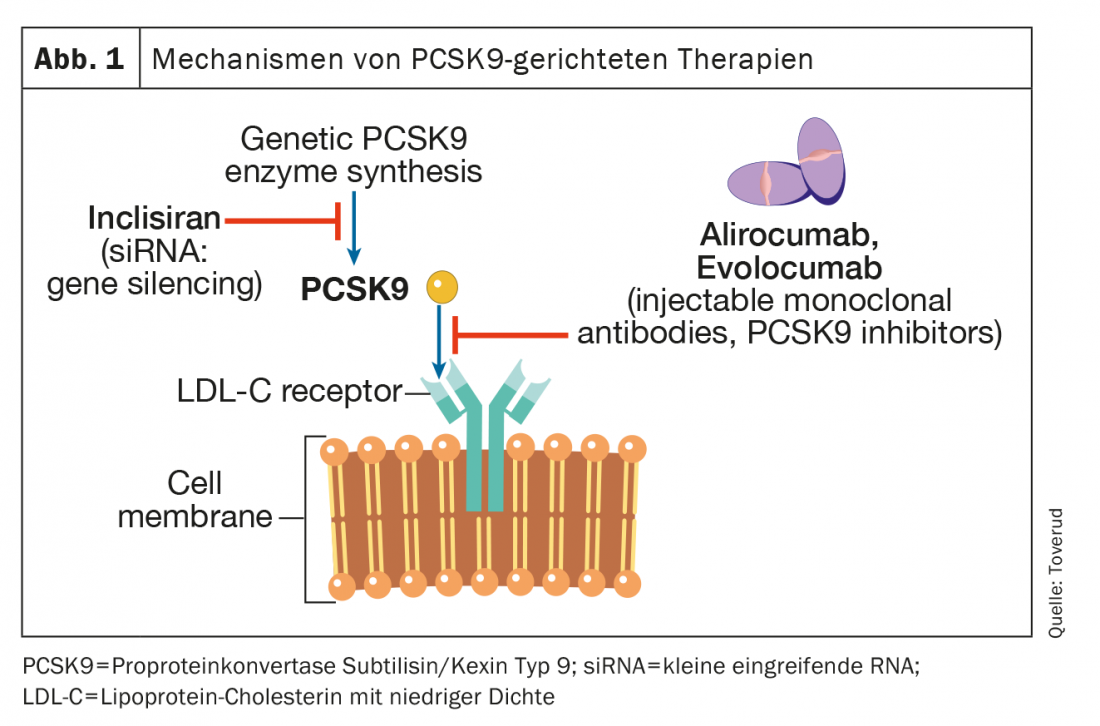
Dans des études randomisées en double aveugle avec l’alirocumab et l’évolocumab chez des patients atteints de FH hétérozygote suivant un traitement hypolipémiant stable, principalement avec des statines et de l’ézétimibe, les concentrations de LDL-C ont été réduites de 50-60 à environ 1,8 mmol/l [9,10]. Environ 60% des patients peuvent atteindre des objectifs de traitement du LDL-C inférieurs à 1,8 mmol/l [8,9]. Les résultats des essais thérapeutiques ouverts à long terme avec l’alirozumab et l’évolocumab ont été encourageants, avec une baisse durable des taux de LDL-C, un faible taux d’abandon en raison d’effets secondaires, et une faible prévalence d’anticorps anti-médicaments [11,12]. Dans le cas de la maladie rare qu’est l’HF homozygote (c’est-à-dire des mutations causant l’HF héritées des deux parents), il ne subsiste que peu ou pas d’activité résiduelle des récepteurs LDL. Par conséquent, les médicaments qui agissent en régulant à la hausse les récepteurs LDL, y compris les statines et l’ézétimibe, n’ont qu’un effet limité. Les inhibiteurs de PCSK9 régulent également les récepteurs LDL vers le haut, mais chez les patients FH homozygotes qui disposent d’une certaine fonction résiduelle du récepteur LDL, les inhibiteurs de PCSK9 peuvent être efficaces à des degrés divers [13,14].
Inclisiran
L’Inclisiran (Leqvio®) est un petit ARN interférent (siRNA) qui inhibe la traduction de la protéine PCSK9 (Fig. 1). L’efficacité de ce médicament a été évaluée en complément des statines dans trois études incluant des patients soit avec une FH hétérozygote, soit avec une HKE existante [15]. Le critère d’évaluation principal de ces études était la réduction des taux de LDL-C, et le médicament ou le placebo a été administré par voie sous-cutanée au début de l’étude et aux mois 3, 9 et 15. Au total, la réduction des taux de LDL-C a été d’environ 45%. Jusqu’à présent, aucune étude n’a documenté de bénéfice en termes de morbidité ou de mortalité, mais des études sont en cours. Inclisiran a été approuvé pour la commercialisation par l’EMA en 2020 et par la FDA en 2021. Il est intéressant de noter que le National Institute for Health and Care Excellence (NICE) au Royaume-Uni a approuvé son utilisation dans la pratique générale au Royaume-Uni avant même la publication de toute étude de résultats. L’un des avantages de l’Inclisiran est sa pharmacocinétique, qui entraîne une réduction durable des concentrations de LDL-C. L’Inclisiran peut être administré par voie orale ou par voie intraveineuse. Inclisiran est administré à 0 et 3 mois, puis deux fois par an, ce qui garantit une meilleure observance (respect du traitement). D’autre part, d’éventuels événements indésirables peuvent persister, mais son profil de sécurité est à ce jour excellent. Dans toutes les études, l’inclisiran a été utilisé en association avec un traitement hypolipémiant éprouvé.
Lomitapid
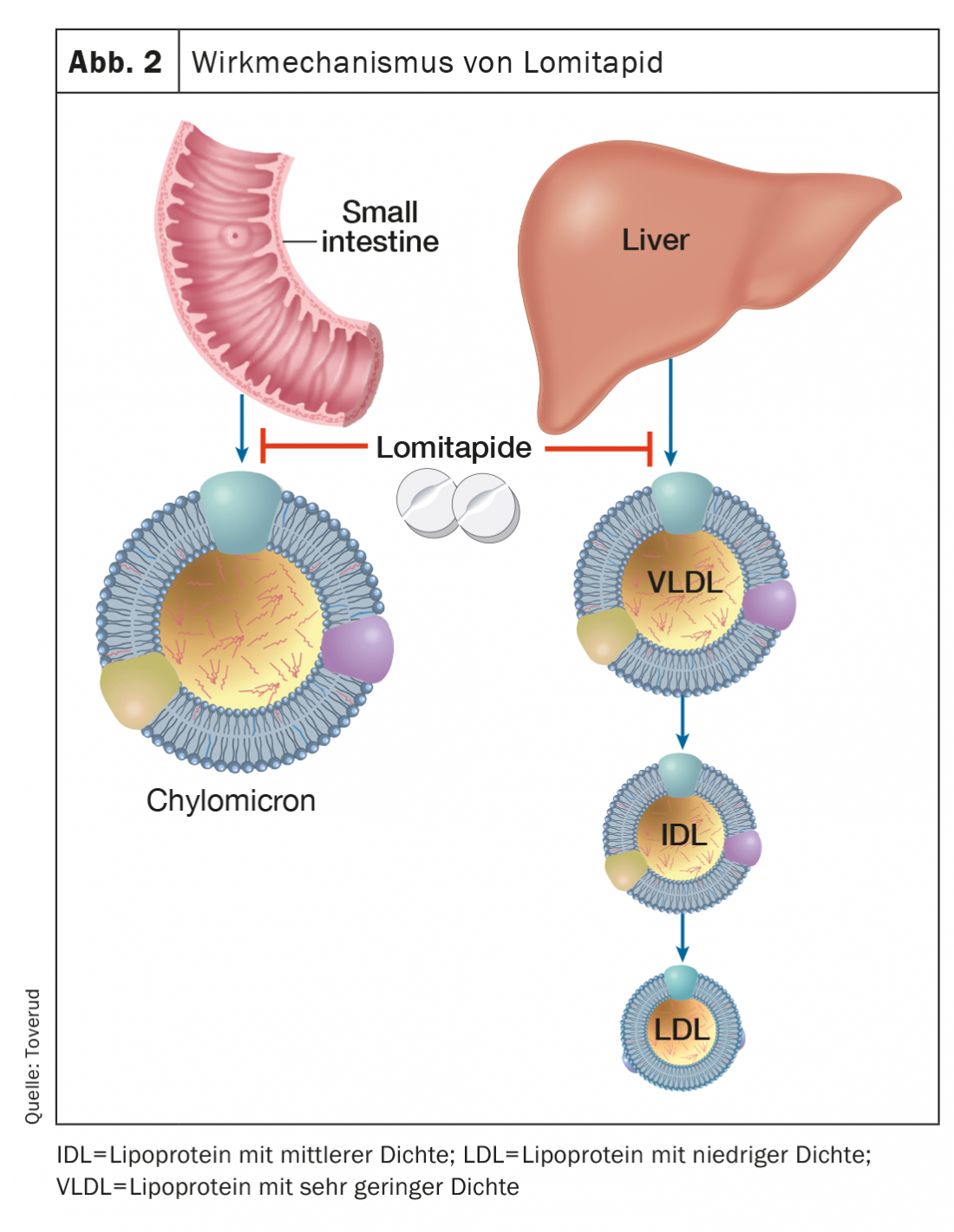
Le lomitapide, un inhibiteur de la protéine microsomale de transfert des triglycérides, inhibe la formation d’apolipoprotéine B, qui contient des lipoprotéines dans l’intestin et le foie, et réduit ainsi le LDL-C sérique, indépendamment des récepteurs de LDL (figure 2). En fonction de la dose, les concentrations de LDL-C peuvent être réduites d’environ 50% [16]. Un traitement supplémentaire par lomitapide peut allonger les intervalles entre les aphérèses de LDL chez des patients sélectionnés et motivés atteints de FH homozygote. Les effets secondaires incluent des troubles gastro-intestinaux, une augmentation des enzymes hépatiques et une augmentation des graisses hépatiques. Le lomitapide (Lojuxta®) a été approuvé en 2013 pour le traitement de la FH homozygote chez les adultes. D’autre part, les coûts sont très élevés, ce qui limite la disponibilité.
Acide bempédoïque
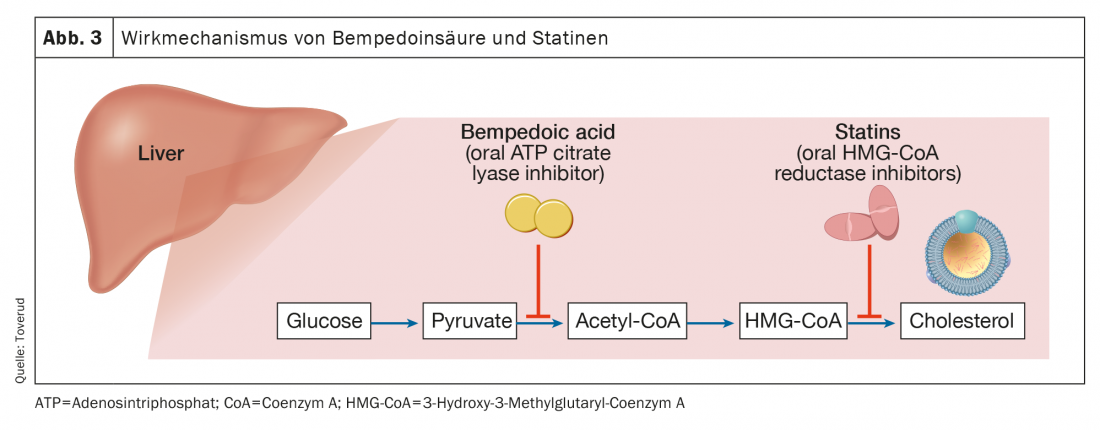
L’acide bempédoïque est autorisé dans l’Union européenne (Nilemdo®) et aux États-Unis (Nexletol®) pour le traitement de l’hypercholestérolémie. En tant que promédicament, l’acide bempédoïque nécessite une activation par l’acyl- CoA synthétase-1 à très longue chaîne, qui est principalement exprimée dans le foie (mais pas dans les muscles squelettiques). Le métabolite actif inhibe l’adénosine triphosphate citrate lyase, une enzyme essentielle dans la voie de synthèse du cholestérol avant la 3-hydroxy-3-méthylglutaryl-CoA réductase (figure 3). Comme avec les statines, l’inhibition de la synthèse du cholestérol entraîne une régulation à la hausse des récepteurs LDL et donc la clairance des particules LDL. Avec une demi-vie de 15 à 24 heures, l’acide bempédoïque peut être administré par voie orale une fois par jour. En monothérapie, l’acide bempédoïque a réduit les concentrations de LDL-C jusqu’à 25% (soustraction du placebo) chez les patients ayant des valeurs initiales de 3,4-5,7 mmol/l [17].
Comme indiqué précédemment, il est devenu nécessaire d’obtenir des réductions du LDL-C plus importantes que celles obtenues avec les statines seules, et l’acide bempédoïque pourrait jouer un rôle. Chez les patients recevant un traitement de fond par statine, dont les taux de LDL-C sont restés entre 3,0 et 5,7 mmol/l, l’acide bempédonique 180 mg par jour a continué à réduire le LDL-C de ~20%, bien qu’il ait ciblé la même voie de biosynthèse du cholestérol que les statines, mais via différentes enzymes [18]. Les taux d’événements indésirables, y compris les symptômes liés aux muscles, étaient similaires à ceux observés avec le placebo [19]. De même, une réduction de 17-18 du LDL-C a été observée chez des patients souffrant de maladie cardiovasculaire athéroscléreuse ou de FH ou des deux, dont le LDL-C est resté >1,8 mmol/l avec un traitement lipidique maximal toléré (y compris une statine) [20]. Une réduction équivalente a été observée dans une étude parallèle portant sur des patients similaires présentant des valeurs de LDL-C > 2,6 mmol/l lors de leur premier examen, dans laquelle les patients n’avaient pas besoin de prendre une statine pour participer à l’étude [21]. Les effets secondaires fréquents de l’acide bempédoïque sont une augmentation de l’acide urique [20,21] et une augmentation de la goutte [21,22]. Une tendance à la détérioration de la fonction rénale a été indiquée dans une méta-analyse récente [21].
Ces dernières années, la nécessité de contrôler les lipides chez les patients qui ne peuvent pas tolérer les statines est apparue. Alors que les essais contrôlés randomisés montrent de faibles taux de symptômes musculaires, les données d’observation indiquent que jusqu’à un tiers des patients traités par statine font état d’une intolérance absolue ou d’une incapacité à prendre des doses adéquates pour atteindre les objectifs de LDL-C [22]. Chez un nombre considérable de patients, les symptômes considérés comme des effets secondaires des statines sont probablement des effets nocebo. Des études menées chez des patients présentant des symptômes musculaires au cours d’un traitement par statine montrent que la plupart des personnes ne sont pas capables de distinguer les phases de traitement par placebo des phases de traitement par statine [23,24]. Des études ont été ciblées sur l’utilisation de l’acide bempédonique chez les patients intolérants aux statines [25] et comme traitement d’appoint à l’ézétimibe [26]. Chez les patients intolérants aux statines, des études ont été menées chez des patients présentant des valeurs de LDL-C de 4,1 mmol/l, dont 21% observés [25]. Dans une étude portant sur des patients intolérants aux statines qui prenaient de l’ézétimibe, dont un tiers prenait une statine à faible dose, les concentrations de LDL-C ont été réduites de >28% [27]. L’acide bempédoïque a été bien toléré par ces groupes de patients, sans augmentation des symptômes musculaires.
Compte tenu du coût des inhibiteurs de PCSK9, des études de suivi ont tenté d’atteindre une concentration de LDL-C aussi faible que celle garantie par les inhibiteurs de PCSK9. Dans une étude portant sur une dose fixe d’acide bempédoïque plus ézétimibe, chez des patients à haut risque cardiovasculaire ayant un taux initial moyen de LDL-C de 3,9 mmol/l malgré un traitement maximal par statine, les réductions du taux de LDL-C ont été importantes (>38%), bien que plus faibles que celles attendues avec un inhibiteur de PCSK9 [28]. La trithérapie acide bempédoïque, ézétimibe et atorvastatine (20 mg/jour) a permis d’obtenir une réduction du C-LDL >64% à peu près équivalente à celle attendue avec un inhibiteur du PCSK9 [29], bien qu’aucune étude tête-bêche n’ait été publiée. L’ajout d’acide bempédoïque en plus du traitement de fond par évolocumab 420 mg administré une fois par mois a considérablement réduit le LDL-C de près de 30% [29].
En général, les réductions des taux de LDL-C avec l’acide bempédoïque semblent être légèrement plus importantes dans les groupes de patients qui ne prennent pas de statine [18–20]. En ce qui concerne les autres fractions lipidiques, l’acide bempédoïque réduit l’apolipoprotéine B, les triglycérides et les concentrations de cholestérol lipoprotéique non haute densité (non-HDL-C). Les baisses des concentrations de CRP observées dans plusieurs études peuvent être prometteuses, mais nécessitent une compréhension plus approfondie du mécanisme [21,22,26].
Le rôle que l’acide bempédoïque est appelé à jouer à l’avenir semble concerner (1) les patients présentant une intolérance aux statines, combinée à d’autres hypolipémiants tolérés, et (2) les patients nécessitant des traitements supplémentaires pour atteindre les objectifs de C-LDL. L’étude en cours sur les résultats cardiovasculaires (CLEAR Outcome) chez les patients présentant des antécédents ou un risque élevé d’HKE, une intolérance aux statines et des valeurs de LDL-C ≥2,6 mmol/l permettra de clarifier davantage le rôle du médicament et de déterminer si les réductions potentielles des critères d’évaluation cliniques concernent uniquement la réduction des lipides ou également la réduction de la CRP.
En raison de leur coût élevé, la disponibilité des inhibiteurs de PCSK9 est limitée, comme nous l’avons mentionné. Avec l’arrivée des biosimilaires et d’autres formes d’inhibition de PCSK9, les prix pourraient baisser à l’avenir et ce traitement efficace et bien toléré pourrait être mis à la disposition d’un plus grand nombre de patients.
Triglycérides/hyperlipidémie combinée – thérapies ciblées
Des triglycérides élevés malgré des traitements visant à réduire le LDL-C sont l’un des problèmes les plus fréquemment rencontrés dans la pratique clinique. Les patients atteints d’hypertriglycéridémie peuvent présenter un risque résiduel élevé de maladie cardiovasculaire [30]. Étant donné que le mode de vie s’avère être la principale cause d’hypertriglycéridémie chez les patients atteints du syndrome métabolique, d’obésité abdominale ou de diabète sucré de type 2 (DT2), ainsi que chez les personnes qui consomment trop d’alcool ou sont physiquement inactives, que peut faire de plus un médecin pour s’attaquer à ces facteurs de risque ? Si l’alimentation, l’activité physique et la perte de poids sont les pierres angulaires du traitement, la génétique et d’autres facteurs non modifiables jouent également un rôle. Par exemple, les patients atteints d’hyperlipidémie combinée familiale sont fréquents en pratique clinique et peuvent présenter une hypertriglycéridémie malgré un poids corporel normal [31]. Le syndrome d’hyperchylomicronémie familiale monogénique est une maladie très rare.
Les preuves épidémiologiques et génétiques ont étayé l’hypothèse selon laquelle des variantes de plusieurs gènes clés du métabolisme des triglycérides qui affectent les triglycérides et les lipoprotéines riches en triglycérides et résiduelles sont liées de manière causale aux maladies cardiovasculaires et à la mortalité générale [32]. Grâce à ces preuves, de nouvelles thérapies ciblant ces manifestations ont vu le jour.
Acide eicosapentaénoïque
Les compléments d’huile de poisson sont vantés depuis des décennies pour leurs effets cardiovasculaires positifs. Ils ont également été assez largement utilisés en pratique clinique pour réduire les concentrations de triglycérides, mais les études sur les acides gras oméga-3 n’ont pas prouvé leur protection en termes de HKE [33]. C’est pourquoi les résultats de l’étude REDUCE-IT (Reduction of Cardioascular Eents with Icosapent Ethyl-Interention Trial, Réduction des événements cardiovasculaires avec l’étude d’intervention sur l’éthyle d’Icosapent) ont été surprenants. Les patients recevant 4 g d’icosapent-éthyl ou une huile minérale contenant un placebo par jour ont montré une réduction de 25% du critère d’évaluation primaire d’un mélange de décès cardiovasculaire, d’infarctus du myocarde non fatal (crise cardiaque), d’accident vasculaire cérébral non fatal, de revascularisation coronarienne ou d’angor instable [34]. Des analyses supplémentaires ont montré un bénéfice cohérent pour tous les sous-groupes de patients et une réduction de 31% des événements ischémiques (initiaux et ultérieurs) [35]. La majorité des patients inclus dans l’étude étaient basés sur une HKE existante (71%) ; près de 60% d’entre eux étaient diabétiques et le taux moyen de triglycérides était de 2,4 mmol/l. Les résultats de l’étude ont montré que le taux de triglycérides était supérieur à la moyenne. Ainsi, la baisse impressionnante s’est produite lors d’événements survenus dans un groupe de patients à haut risque cardiovasculaire, dont bien plus de 90% étaient traités par des statines d’intensité moyenne ou élevée.
Depuis cette publication, les questions se sont concentrées sur la différence entre l’icosapent-éthyle, utilisé dans l’étude REDUCE-IT, et l’acide oméga-3 carboxylique, qui est un mélange d’acide eicosapentaénoïque (EPA) et d’acide docosahexaénoïque. Ce composé a été utilisé à la dose de 4 g/jour dans l’étude STRENGTH (Statin Residual Risk Reduction with Epanoa in High Cardioascular Risk Patients with Hypertriglyceridemia , réduction du risque résiduel de statine avec Epanova chez les patients atteints d’hypertriglycéridémie et présentant un risque cardiovasculaire élevé), une étude qui n’a pas montré de diminution des événements cardiovasculaires [36]. Il n’a pas encore été possible de déterminer complètement si ces différences peuvent être attribuées à d’éventuels dommages causés par l’acide docosahexaénoïque ou au dosage plus élevé d’EPA dans l’étude REDUCE-IT par rapport à l’étude STRENGTH. Une autre explication proposée réside dans le choix du placebo dans l’étude REDUCE-IT. Dans le groupe témoin des huiles minérales, les taux de LDL-C, d’apolipoprotéine B et de protéine C-réactive ont augmenté respectivement de 10,9%, 7,8% et 32,3%, ce qui suggère que les bénéfices de l’icosapent-éthyl pourraient avoir été partiellement confondus avec les dommages dans le groupe témoin [34,37]. L’EPA peut toutefois posséder des propriétés qui atténuent certaines de ces différences.
Les mécanismes des bénéfices observés dans l’étude REDUCE-IT peuvent être multifactoriels, car les réductions du risque observées ont dépassé les attentes en termes de degré de réduction des triglycérides. En moyenne, le niveau de triglycérides a diminué de 18,3% (-0,44 mmol/l) dans le groupe icosapent-éthyl, alors qu’il a augmenté de 2,2% dans le groupe placebo. En raison des fluctuations des triglycérides, environ 10% des participants avaient des valeurs normales, mais les réductions de risque étaient constantes pour toutes les valeurs de triglycérides à l’état initial. Les acides gras oméga-3 peuvent réduire l’inflammation, influencer les arythmies cardiaques en modulant la fluidité membranaire et freiner la formation et la progression de la plaque d’athérosclérose [38]. Si, d’une part, une réduction significative de 30% des morts subites cardiaques a été observée dans le groupe icosapent-éthyl dans l’étude REDUCE-IT (une analyse tertiaire), le taux de fibrillation auriculaire était nettement plus élevé dans le groupe icosapent-éthyl que dans le groupe placebo (5,3% contre 3,9%) [34].
Malgré quelques incertitudes, un examen de l’icosapent-éthyl (Vazkepa®) par l’EMA en 2021 pour l’approbation du médicament en tant que traitement visant à réduire le risque d’événements cardiovasculaires chez les patients à haut risque traités par statine et présentant des triglycérides élevés (≥1,7 mmol/l) et une HKE existante (ou un diabète et un ou plusieurs facteurs de risque cardiovasculaire supplémentaires).
Pemafibrate
Les fibrates sont des agonistes des récepteurs activés par les proliférateurs de peroxysomes (PPAR) qui sont utilisés depuis des décennies comme médicaments hypoglycémiants. Comme la plupart des études ont inclus un large éventail de participants, leurs effets cardioprotecteurs ont été remis en question et sont principalement observés dans des sous-groupes présentant une hypertriglycéridémie [39]. Le pemafibrate se distingue comme un nouveau modulateur PPAR-α hautement sélectif qui entraîne des baisses significatives des triglycérides et des particules de cholestérol résiduelles. Cependant, une étude récente n’a pas trouvé de réductions significatives chez les non-HDL-C [40], ce qui suggère que les effets bénéfiques potentiels pourraient être principalement liés à des réductions des triglycérides et des résidus de triglycérides. L’étude en cours PROMINENT (Pemafibrate to Reduce Cardio ascular Outcomes by Reducing Triglycerides in Patients with Diabetes, Pemafibrate pour réduire les résultats cardiovasculaires en réduisant les triglycérides chez les patients diabétiques) a inclus plus de 10 000 participants avec un DT2 (prévention primaire ou secondaire), des triglycérides de 2,26-5,64 mmol/l et des taux de HDL-C <1,03 mmol/l, randomisés pour recevoir du pemafibrate ou un placebo, le critère d’évaluation de l’étude étant déterminé par les événements. Les résultats seront présentés prochainement [41]. Des résultats positifs pourraient améliorer considérablement le traitement des patients atteints de DT2.
Apolipoprotéine C-III et thérapies protéiques de type angiopoïétine
Le contrôle du métabolisme des triglycérides implique un certain nombre de protéines et de voies enzymatiques. Les triglycérides des chylomicrons et les lipoprotéines de très faible densité sont soumis à une lipolyse intravasculaire par la lipoprotéine lipase pour libérer des acides gras libres qui sont utilisés ou stockés comme combustible. Les protéines centrales qui régulent ces processus sont l’apolipoprotéine C-III (ApoCIII), la protéine 3 de type angiopoïétine (ANGPTL3), et ANGPTL4, qui sont toutes de puissants inhibiteurs de la lipoprotéine lipase (Figure 4).
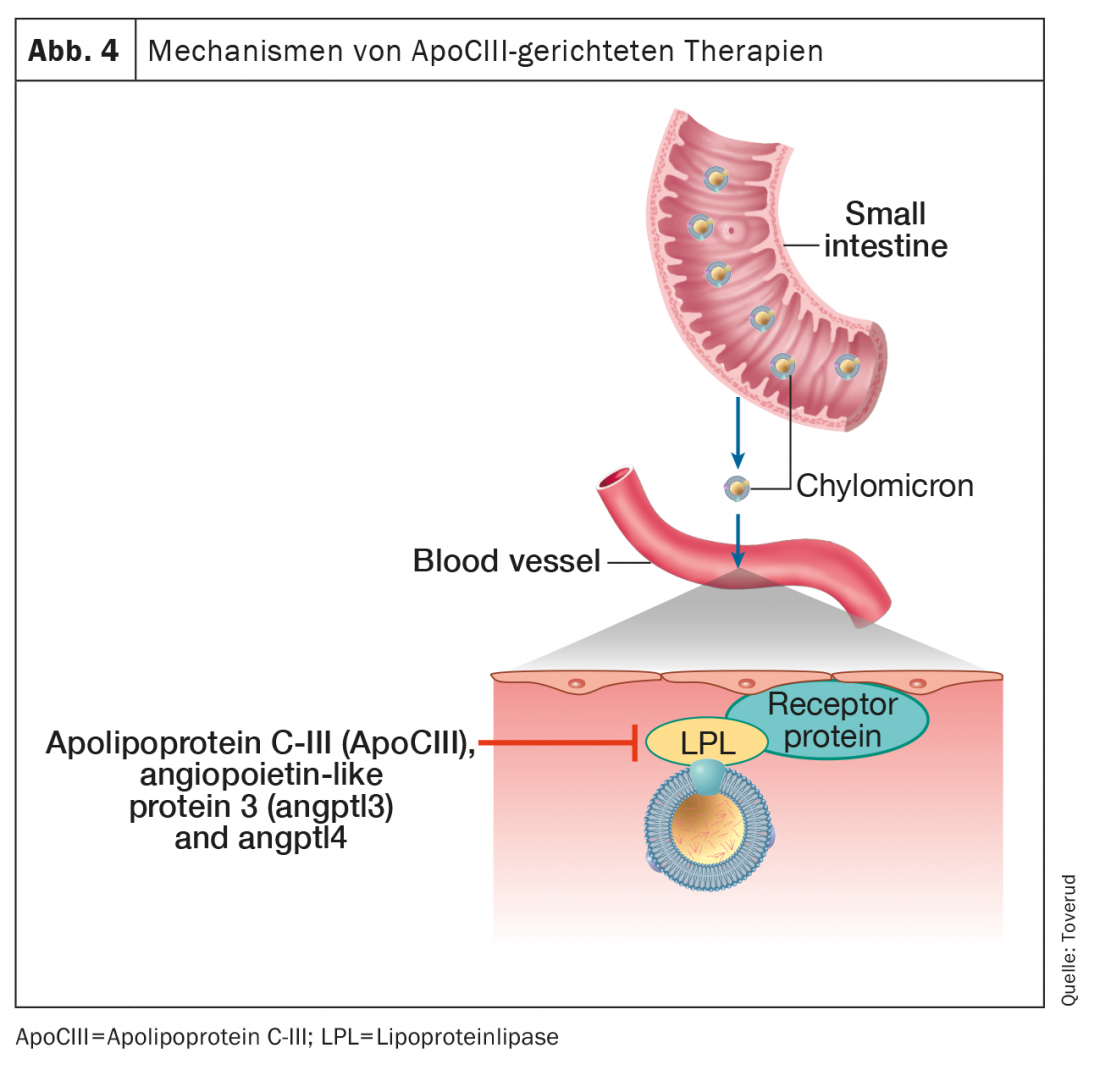
Des preuves génétiques associent les variantes de perte de fonction de l’ApoCIII à des taux de triglycérides réduits et à un risque cardiovasculaire [42]. De plus, l’ApoCIII semble contribuer à l’athérogénicité de plusieurs lipoprotéines auxquelles il adhère, y compris le HDL [43]. En particulier, le faible risque de HKE chez les hétérozygotes présentant une perte de fonction de l’ApoCIII semble être médiatisé par son association avec un faible cholestérol résiduel plutôt qu’avec un faible LDL-C [44], ce qui établit davantage le rôle des résidus de triglycérides dans l’athérosclérose. Ces connaissances en génétique et en physiopathologie ont agi comme des catalyseurs clés pour le développement de médicaments thérapeutiques contre l’hypertriglycéridémie par inhibition de l’ApoCIII.
Une étude récente a montré que les concentrations d’ANGPTL3 restaient des facteurs déterminants indépendants des événements cardiovasculaires, après ajustement des facteurs de risque traditionnels et des médicaments hypolipémiants [45].
En conséquence, il a été démontré que les mutations de perte de fonction dans le gène ANGPTL3 sont associées à une hypobêta-lipoprotéinémie et à une diminution des triglycérides, des LDL-C et HDL-C et du risque de maladie coronarienne [44], tandis que les mutations dans le gène ANGPTL4 sont associées à une diminution des triglycérides et à une augmentation du cholestérol HDL [45]. Les patients déficients en ANGPTL3 n’ont pas montré d’athérosclérose coronarienne [46], ce qui a conduit à la conclusion que les bloqueurs d’ANGPTL3 pourraient être des agents prometteurs de réduction des risques. D’autre part, le développement d’inhibiteurs de l’angptl4 a été entravé par l’observation de lésions lipogranulomateuses dans l’intestin de souris déficientes en angptl4.
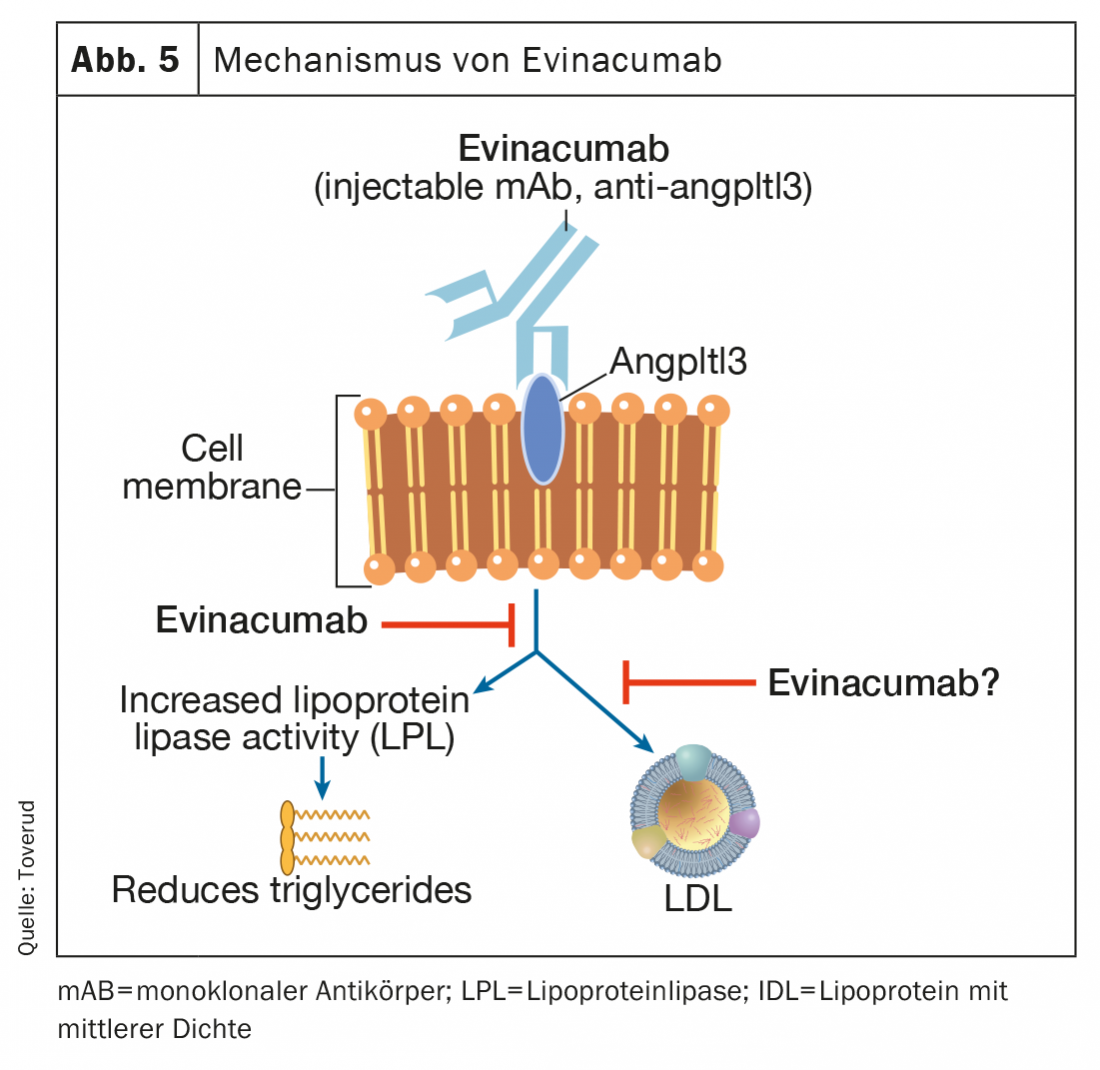
Evinacumab
L’évinacumab est un anticorps monoclonal entièrement humain qui se lie aux inhibiteurs de l’angptl3 et les inhibe, augmentant ainsi l’activité de la lipoprotéine lipase (Fig. 5). L’évinacumab réduit les taux élevés de triglycérides, mais pas chez les patients présentant des triglycérides très élevés en raison du manque d’activité lipoprotéine lipase dans le syndrome d’hyperchylomicronémie familiale rare [47,48]. L’évinacumab réduit également les taux de LDL-C par un mécanisme indépendant des récepteurs de LDL, qui n’est pas entièrement compris. Dans une récente étude de phase 3 menée chez des patients atteints de FH homozygote, les perfusions intraveineuses mensuelles d’évinacumab ont réduit les taux de LDL-C de 47% (49% par rapport au placebo) et semblent constituer une nouvelle option thérapeutique prometteuse pour ces patients difficiles à traiter [49]. Les symptômes pseudo-grippaux étaient plus fréquents chez les patients recevant l’évinacumab. Les effets secondaires à long terme liés à l’athérosclérose et aux grossesses sont enregistrés à partir d’un registre continu des utilisateurs. Evinacumab (Evkeeza®) a été approuvé en 2021 pour le traitement de la FH homozygote à partir de 12 ans.
Vupanorsen
Le vupanorsen est un oligonucléotide antisens sur l’ARNm ANGPTL3 qui est développé comme traitement potentiel des dyslipidémies [50]. Chez les patients atteints de diabète, de stéatose hépatique (foie gras) et d’hypertriglycéridémie, le médicament a réduit de manière significative les triglycérides ainsi que le cholestérol total et non-HDL, sans réduire le nombre de plaquettes [51].
Volanesorsen
Le volanesorsen est un oligonucléotide antisens contre l’ARNm de l’apo-CIII qui réduit fortement les concentrations de triglycérides et d’apoCIII par des voies indépendantes de la lipoprotéine lipase (Fig. 4). Des essais cliniques randomisés et contrôlés ont montré une réduction d’environ 70% des taux de triglycérides et une diminution du risque de pancréatite aiguë associée à l’hypertriglycéridémie [52]. Un pas en avant considérable a été fait dans le traitement des maladies rares chez les patients atteints du syndrome de chylomicronémie familiale, une maladie génétique rare et potentiellement mortelle due à la perte de l’activité lipoprotéine lipase, caractérisée par une chylomicronémie avec pancréatite récurrente et peu d’options thérapeutiques. Volanesorsen a réduit les taux de triglycérides de 77% et la plupart des participants ont atteint des taux de triglycérides inférieurs à 8,5 mmol, un seuil associé à un risque considérablement réduit de pancréatite [53]. Volansorsen a réduit l’apolipoprotéine B-48 de 76%, mais a augmenté le LDL-C de 136% et l’apolipoprotéine B totale de 20%. Bien que ces résultats puissent refléter un risque cardiovasculaire potentiellement accru, les niveaux de lipoprotéines athérogènes étaient très faibles, comme cela est typiquement observé chez les patients atteints de chylomicronémie familiale.
L’un des principaux effets indésirables du volanesorsen est la thrombocytopénie, qui a conduit la FDA à refuser l’autorisation de mise sur le marché, ainsi que des préoccupations concernant les hémorragies graves. La thrombocytopénie est toutefois réversible en arrêtant le médicament. L’EMA a approuvé le volanesorsen (Waylivra®) chez les patients adultes atteints du syndrome de chylomicronémie familiale en 2019.
Olezarsen
Olezarsen est un oligonucléotide antisens qui cible l’ARNm de l’ApoCIII hépatique afin d’inhiber la production de la protéine ApoCIII. (Fig. 4). Dans une étude récente, le traitement par olezarsen pendant 6 à 12 mois a réduit les triglycérides de 23 à 60 de façon dose-dépendante, sans modification du nombre de plaquettes, du foie ou de la fonction rénale, chez des participants présentant des triglycérides élevés et un risque cardiovasculaire élevé ou une maladie cardiovasculaire. [51].
Traitements contre l’hyperlipoprotéinémie (A)
Le lien entre l’augmentation de la Lp(a) et les maladies cardiovasculaires a été établi par des études après que la molécule a été identifiée en 1968 par Berg à Oslo, Norvège. Une méta-analyse d’études prospectives a montré une augmentation approximative du risque de maladie coronarienne de 1,16 (1,11-1,22) par concentration de Lp(a) 3,5 fois plus élevée, qui ne diminue que légèrement à 1,13 (1,09-1,18) après ajustement [54].
Des liens ont également été établis entre la Lp(a) et la mortalité, ainsi que les accidents vasculaires cérébraux, la maladie artérielle périphérique et la sténose valvulaire aortique calcifiée. Cette brève revue ne vise que les thérapies spécifiques pour l’apo(a). On pense que, bien que certaines études aient montré qu’une réduction de la Lp(a) de 20% à 25% ne représentait pas une réduction du risque cardiovasculaire au-delà de la réduction simultanée du LDL-C, cette observation pourrait s’expliquer par l’hypothèse selon laquelle de fortes réductions des valeurs absolues sont nécessaires, comme l’ont montré des études sur les nouveaux traitements suivants [55].
Pelacarsen
Le pelacarsen est l’oligonucléotide antisens qui cible la production hépatique d’apo(a) et qui a fait le plus de progrès dans les études achevées ou en cours (Fig. 6). Comparé au placebo, le pélacarsen a réduit les concentrations de Lp(a) de façon dose-dépendante et constante jusqu’à 80% chez les patients présentant des taux élevés et une HKE existante [56].
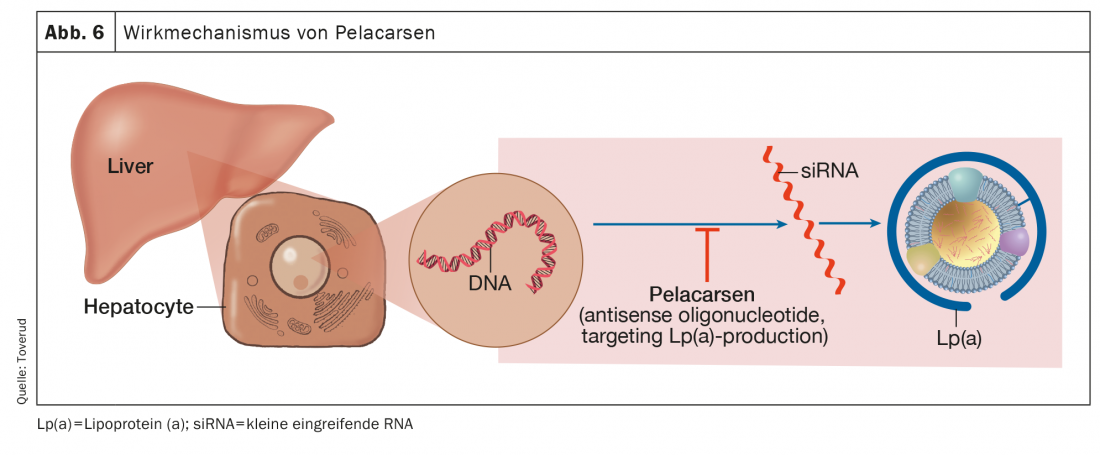
En outre, des réductions des phospholipides oxydés ont été observées sur l’apolipoprotéine B et l’apo(a), des composants de la Lp(a) ayant une activité pro-inflammatoire probable. L’étude Lp(a) HORIZON est une étude multicentrique, randomisée, en double aveugle, contrôlée par placebo, visant à évaluer l’effet du pélacarsen sur les événements cardiovasculaires chez les patients présentant une HKE existante et des concentrations de LP(a) ≥175 nmol/l [57].
Thérapie ARN à petite échelle
L’olpasiran, une petite molécule d’intervention développée pour inhiber directement l’ARN messager de la Lp(a), a montré des réductions importantes, dose-dépendantes et durables de 71% à 97% des concentrations de Lp(a), avec des effets qui ont duré plusieurs mois [58]. Récemment, les résultats d’une étude d’escalade d’un autre petit traitement ARN invasif (SLN360), qui inhibe la traduction du gène codant pour l’apo(A) dans les hépatocytes et qui a également été administré en dose unique, ont été connus. Des réductions moyennes de 98% de la Lp(a) ont été observées dans le groupe qui a reçu la dose la plus élevée jusqu’à 150 jours [59]. Les questions de sécurité liées à ces deux traitements nécessiteront des études plus longues et de plus grande envergure.
Conclusion
En résumé, il existe un besoin non satisfait de traitements hypolipémiants plus efficaces et d’un élargissement de l’arsenal thérapeutique actuel. Les progrès récents de la pharmacothérapie suggèrent un certain nombre de voies mécanistiques et pharmacologiques possibles, utilisées dans le but d’amener davantage de patients à atteindre les objectifs lipidiques. Le domaine progresse plus rapidement qu’au cours des dernières décennies et il peut y avoir des changements importants dans la façon dont nous aborderons le fardeau mondial de l’athérosclérose à l’avenir.
Source : Ce travail est une publication secondaire, une traduction de l’article original en anglais publié dans la revue “Kardiol.Pol. publié en anglais. La référence est : Kardiol.Pol 2022 ; 80(7-8) : 741-749. doi : 10.33963/KP.a2022.0117.
Nous remercions Kari C. Toverud (Certified Medical Illustrator) pour les figurines.
Messages Take-Home
- L’athérosclérose reste la première cause de mortalité dans le monde.
- Une grande partie de l’apparition et du développement de l’athérosclérose est causée par la dyslipidémie.
- Avec l’arrivée des statines, de l’ézétimibe et plus récemment des inhibiteurs de la proprotéine convertase subtilisine/kexine de type 9 (PCSK9), les médecins de toutes les spécialités ont accès à un arsenal thérapeutique pour s’attaquer à ce moteur physiopathologique important.
- Néanmoins, il existe toujours un grand besoin non satisfait de stratégies d’optimisation pour la réduction pharmacothérapeutique des lipides.
- Ils se focalisent sur une réduction des triglycérides (TG) ou de la lipoprotéine (a) [Lp(a)].
Littérature :
- OMS : Sujets de santé dans les maladies cardiovasculaires 2021. Disponible en ligne : www.who.int/news-room/fact-sheets/detail/cardiovascular-diseases-(cvds) (Access : April 28, 2022).
- Atar D, Jukema JW, Molemans B, et al : New cardiovascular prevention guidelines : How to optimally manage dyslipidaemia and cardiovascular risk in 2021 in patients needing secondary prevention ? Atherosclerosis 2021 ; 319 : 51-61, doi : 10.1016/j.atherosclerosis.2020.12.013, indexed in Pubmed : 33476944.
- Sverre E, Peersen K, Husebye E, et al : Unfavourable risk factor control after coronary events in routine clinical practice. BMC Cardiovasc Disord 2017 ; 17(1) : 40, doi : 10.1186/s12872-016-0387-z, indexed in Pubmed : 28109259.
- Setny M, Jankowski P, Kamiński K, et al. : Secondary prevention of coronary heart disease in Poland : does sex matter ? Résultats de l’enquête POLASPIRE. Pol Arch Intern Med 2022 ; 132(3), doi : 10.20452/pamw.16179, indexed in Pubmed : 34935325.
- Mundal L, Igland J, Ose L, et al. : Cardiovascular disease mortality in patients with genetically verified family hypercholesterolemia in Norway during 1992-2013. Eur J Prev Cardiol 2017 ; 24(2) : 137-144, doi : 10.1177/2047487316676135, indexed in Pubmed : 27794106.
- Bogsrud MP, Græsdal A, Johansen D, et al : LDL-cholesterol goal achieve- ment, cardiovascular disease, and attributed risk of Lp(a) in a large cohort of predominantly genetically verified family hypercholesterolemia. J Clin Lipidol. 2019 ; 13(2) : 279-286, doi : 10.1016/j.jacl.2019.01.010, indexed in Pubmed : 30910667.
- Mach F, Baigent C, Catapano AL, et al : ESC Scientific Document Group. 2019 ESC/EAS Guidelines for the management of dyslipidaemias : lipid modification to reduce cardiovascular risk. Eur Heart J. 2020 ; 41(1) : 111-188, doi : 10.1093/eurheartj/ehz455, indexed in Pubmed : 31504418.
- O’Donoghue ML, Giugliano RP, Atar D, et al : Long-Term Evolocumab in Patients With Established Atherosclerotic Cardiovascular Disease. Circulation 2022 Oct 11 ; 146(15) : 1109-1119. doi : 10.1093/eurheartj/ehz430, indexed in Pubmed : 31270529.
- Kastelein JJP, Ginsberg HN, Langslet G, et al : ODYSSEY FH I et FH II : 78 week results with alirocumab treatment in 735 patients with heterozy- gous family hypercholesterolaemia. Eur Heart J 2015 ; 36(43) : 2996-3003, doi : 10.1093/eurheartj/ehv370, indexed in Pubmed : 26330422.
- Raal FJ, Stein EA, Dufour R, et al : RUTHERFORD-2 Investigators. PCSK9 in- hibition with evolocumab (AMG 145) in heterozygous family hyper- cholesterolaemia (RUTHERFORD-2) : a randomised, double-blind, placebo-controlled trial. Lancet 2015 ; 385(9965) : 331-340, doi : 10.1016/S0140-6736(14)61399-4, indexed in Pubmed : 25282519.
- Farnier M, Hovingh GK, Langslet G, et al : Long-term safety and efficacy of alirocumab in patients with heterozygous family hypercholesterolemia : An open-label extension of the ODYSSEY program. Atherosclerosis 2018 ; 278 : 307-314, doi : 10.1016/j.atherosclerosis.2018.08.036, indexed in Pubmed : 30293878.
- Koren MJ, Sabatine MS, Giugliano RP, et al : Long-term efficacy and safety of evolocumab in patients with hypercholesterolemia. J Am Coll Cardiol 2019 ; 74(17) : 2132-2146, doi : 10.1016/j.jacc.2019.08.1024, indexed in Pubmed : 31648705.
- Santos RD, Stein EA, Hovingh GK, et al : Long-term evolocumab in patients with family hypercholesterolemia. J Am Coll Cardiol 2020 ; 75(6) : 565-574, doi : 10.1016/j.jacc.2019.12.020, indexed in Pubmed : 32057369.
- Blom DJ, Harada-Shiba M, Rubba P, et al : Efficacité et sécurité de l’alirocumab chez les adultes atteints d’hypercholestérolémie familiale homozygote : l’essai ODYS- SEY HoFH. J Am Coll Cardiol 2020 ; 76(2) : 131-142, doi : 10.1016/j. jacc.2020.05.027, indexed in Pubmed : 32646561.
- Santulli G, Jankauskas SS, Gambardella J : Inclisiran : un nouveau jalon sur la route du PCSK9 pour lutter contre le risque cardiovasculaire. Eur Heart J Cardiovasc Pharmacother 2021 ; 7(3) : e11-e12, doi : 10.1093/ehjcvp/pvab014, indexed in Pubmed : 33655296.
- Cuchel M, Bloedon LT, Szapary PO, et al : Inhibition of microsomal triglyceride transfer protein in family hypercholesterolemia. N Engl J Med 2007 ; 356(2) : 148-156, doi : 10.1056/NEJMoa061189, indexed in Pubmed : 17215532.
- Ballantyne CM, Davidson MH, Macdougall DE, et al : Efficacité et sécurité d’un nouveau modulateur double de l’adénosine triphosphate-citrate lyase et de l’adénosine monophosphate-activated protein kinase chez les patients atteints d’hypercholestérolémie : résultats d’un essai multicentrique, randomisé, en double aveugle, contrôlé par placebo, en groupes parallèles. J Am Coll Cardiol 2013 ; 62(13) : 1154-1162, doi : 10.1016/j.jacc.2013.05.050, indexed in Pubmed : 23770179.
- Ballantyne CM, McKenney JM, MacDougall DE, et al : Effect of ETC-1002 on serum low-density lipoprotein cholesterol in hypercholesterolemic patients receiving statin therapy. Am J Cardiol 2016 ; 117(12) : 1928-1933, doi : 10.1016/j.amjcard.2016.03.043, indexed in Pubmed : 27138185.
- Ray KK, Bays HE, Catapano AL, et al : CLEAR Harmony Trial. Sécurité et efficacité de l’acide bempédoïque pour réduire le cholestérol LDL. N Engl J Med 2019 ; 380(11) : 1022-1032, doi : 10.1056/NEJMoa1803917, indexé dans Pubmed : 30865796.
- Goldberg AC, Leiter LA, Stroes ESG, et al : Effect of bempedoic acid vs placebo added to maximally tolerated statins on low-density lipoprotein cholesterol in patients at high risk for cardiovascular disease : the CLEAR wisdom randomized clinical trial. JAMA 2019 ; 322(18) : 1780-1788, doi : 10.1001/jama.2019.16585, indexed in Pubmed : 31714986.
- Lin Y, Parco C, Karathanos A, et al : Efficacité clinique et résultats de sécurité de l’acide bempédoïque pour le traitement de réduction du LDL-C chez les patients à haut risque cardiovasculaire : une revue systématique et une méta-analyse. BMJ Open. 2022 ; 12(2) : e048893, doi : 10.1136/bmjopen-2021-048893, indexed in Pubmed : 35210334.
- Bytyçi I, Penson PE, Mikhailidis DP, et al : Prevalence of statin intolerance : a meta-analysis. Eur Heart J 2022 [Epub ahead of print]: ehac015, doi : 10.1093/eurheartj/ehac015, indexed in Pubmed : 35169843.
- Wood FA, Howard JP, Finegold JA, et al : N-of-1 trial of a statin, placebo, or no treatment to assess side effects. N Engl J Med 2020 ; 383(22) : 2182-2184, doi : 10.1056/NEJMc2031173, indexed in Pubmed : 33196154.
- Herrett E, Williamson E, Brack K, et al : StatinWISE Trial Group. Statin treat- ment and muscle symptoms : series of randomised, placebo controlled n-of-1 trials. BMJ. 2021 ; 372 : n135, doi : 10.1136/bmj.n135, indexed in Pubmed : 33627334.
- Laufs U, Banach M, Mancini GB, et al : Efficacité et sécurité de l’acide bempédoïque chez les patients atteints d’hypercholestérolémie et intolérants aux statines. J Am Heart Assoc 2019 ; 8(7) : e011662, doi : 10.1161/JAHA.118.011662, indexed in Pubmed : 30922146.
- Ballantyne CM, Banach M, Mancini GB, et al : Efficacité et sécurité de l’acide bempédoïque ajouté à l’ézétimibe chez les patients intolérants aux statines et souffrant d’hypercholestérolémie : une étude randomisée et contrôlée par placebo. Atherosclerosis 2018 ; 277 : 195-203, doi : 10.1016/j.atherosclerosis.2018.06.002, indexed in Pubmed : 29910030.
- Ballantyne CM, Laufs U, Ray KK, et al : Bempedoic acid plus ezetimibe fixed-dose combination in patients with hypercholesterolemia and high CVD risk treated with maximally tolerated statin therapy. Eur J Prev Cardiol 2020 ; 27(6) : 593-603, doi : 10.1177/2047487319864671, indexed in Pubmed : 31357887.
- Rubino J, MacDougall DE, Sterling LR, et al : Combination of bempedoic acid, ezetimibe, and atorvastatin in patients with hypercholesterolemia : A randomized clinical trial. Atherosclerosis 2021 ; 320 : 122-128, doi : 10.1016/j.atherosclerosis.2020.12.023, indexed in Pubmed : 33514449.
- McKenney J, MacDougall D, Sterling L, et al : Lipid lowering with bempe- doic acid added to proprotein convertase subtilisin/kexin type 9 inhibitor therapy : a randomized controlled trial. J Clin Lipidol 2019 ; 13(3) : e55-e56, doi : 10.1016/j.jacl.2019.04.092.
- Soehnlein O, Libby P. Targeting inflammation in atherosclerosis – from experimental insights to the clinic. Nature Rev 2021 ; 20(8) : 589-610, doi : 10.1038/s41573-021-00198-1, indexed in Pubmed : 33976384.
- Ginsberg HN, Packard CJ, Chapman MJ, et al : Triglyceride-rich lipopro- teins and their remnants : metabolic insights, role in atherosclerotic cardiovascular disease, and emerging therapeutic strategies-a consensus statement from the European Atherosclerosis Society. Eur Heart J 2021 ; 42(47) : 4791-4806, doi : 10.1093/eurheartj/ehab551, indexed in Pubmed : 34472586.
- Bello-Chavolla OY, Kuri-García A, Ríos-Ríos M, et al : Familial combined hyperlipidemia : current knowledge, perspectives, and controversies. Rev In- vest Clin. 2018 ; 70(5) : 224-236, doi : 10.1007/springerreference_35144, indexed in Pubmed : 30307446.
- Aung T, Halsey J, Kromhout D, et al : Omega-3 Treatment Trialists’ Collaboration. Associations of omega-3 fatty acid supplement use with cardiovascular disease risks : meta-analysis of 10 trials involving 77 917 individuals. JAMA Cardiol 2018 ; 3(3) : 225-234, doi : 10.1001/jamacardio.2017.5205, indexed in Pubmed : 29387889.
- Bhatt DL, Steg PG, Miller M, et al. : REDUCE-IT Investigators. Réduction du risque cardiovasculaire avec l’éthyle icosapent pour l’hypertriglycéridémie. N Engl J Med. 2019 ; 380(1) : 11-22, doi : 10.1056/NEJMoa1812792, indexed in Pubmed : 30415628.
- Peterson BE, Bhatt DL, Steg PhG, et al. : REDUCE-IT Investigators, RE- DUCE-IT Investigators, REDUCE-IT Investigators. Effets de l’éthyle icosapent sur les événements ischémiques totaux : de REDUCE-IT. J Am Coll Cardiol 2019 ; 73(22) : 2791-2802, doi : 10.1016/j.jacc.2019.02.032, indexed in Pubmed : 30898607.
- Nicholls SJ, Lincoff AM, Garcia M, et al : Effect of high-dose omega-3 fatty acids vs corn oil on major adverse cardiovascular events in patients at high cardiovascular risk : the STRENGTH randomized clinical trial. JAMA 2020 ; 324(22) : 2268-2280, doi : 10.1001/jama.2020.22258, indexed in Pubmed : 33190147.
- Doi T, Langsted A, Nordestgaard BG : Une explication possible pour les résultats contrastés de REDUCE-IT vs. STRENGTH : étude de cohorte mimant des modèles d’essai. Eur Heart J 2021 ; 42(47) : 4807-4817, doi : 10.1093/eu-rheartj/ehab555, indexed in Pubmed : 34455435.
- Mason RP, Libby P, Bhatt DL : Emerging mechanisms of cardiovascular protection for the omega-3 fatty acid eicosapentaenoic acid. Arterio- scler Thromb Vasc Biol 2020 ; 40(5) : 1135-1147, doi : 10.1161/ATVBA-HA.119.313286, indexed in Pubmed : 32212849.
- Liu ZL, Li GQ, Bensoussan A, et al : Effects of fibrates on cardiovascular outcomes : a systematic review and meta-analysis. Lancet 2010 ; 375(9729) : 1875-1884, doi : 10.1016/S0140-6736(10)60656-3, indexed in Pubmed : 20462635.
- Ginsberg HN, Hounslow NJ, Senko Y, et al : Efficacité et sécurité du K-877 (pe-mafibrate), un modulateur sélectif de la pparα, chez les patients européens sous traitement par statine. Diabetes Care 2022 ; 45(4) : 898-908, doi : 10.2337/dc21-1288, indexed in Pubmed : 35238894.
- Pradhan AD, Paynter NP, Everett BM, et al : Rationale and design of the pemafibrate to reduce cardiovascular outcomes by reducing triglycerides in patients with diabetes (PROMINENT) study. Am Heart J 2018 ; 206 : 80-93, doi : 10.1016/j.ahj.2018.09.011, indexed in Pubmed : 30342298.
- Dib I, Khalil A, Chouaib R, et al : Apolipoprotéine C-III et maladies cardiovasculaires : quand la génétique rencontre les pathologies moléculaires. Mol Biol Rep 2021 ; 48(1) : 875-886, doi : 10.1007/s11033-020-06071-5, indexed in Pubmed : 33389539.
- Wulff AB, Nordestgaard BG, Tybjærg-Hansen A. APOC3 loss-of-function mutations, remnant cholesterol, low-density lipoprotein cholesterol, and cardiovascular risk : mediation- and meta-analyses of 137 895 individuals. Arterioscler Thromb Vasc Biol 2018 ; 38(3) : 660-668, doi : 10.1161/AT- VBAHA.117.310473, indexed in Pubmed : 29348120.
- Stitziel NO, Khera AV, Wang X, et al : PROMIS and Myocardial Infarction Genetics Consortium Investigators. Déficience de l’ANGPTL3 et protection contre la maladie coronarienne. J Am Coll Cardiol 2017 ; 69(16) : 2054-2063, doi : 10.1016/j.jacc.2017.02.030, indexed in Pubmed : 28385496.
- Dewey FE, Gusarova V, O’Dushlaine C, et al : Inactivating variants in ANGPTL4 and risk of coronary artery disease. N Engl J Med 2016 ; 374(12) : 1123-1133, doi : 10.1056/NEJMoa1510926, indexed in Pubmed : 26933753.
- Hussain A, Sun C, Selvin E, et al : Triglyceride-rich lipoproteins, apolipo- protein C-III, angiopoietin-like protein 3, and cardiovascular events in older adults : Atherosclerosis Risk in Communities (ARIC) study. Eur J Prev Cardiol 2022 ; 29(2) : e53-e64, doi : 10.1093/eurjpc/zwaa152, indexed in Pubmed : 33580780.
- Ahmad Z, Banerjee P, Hamon S, et al : Inhibition of angiopoietin-like protein 3 with a monoclonal antibody reduces triglycerides in hypertri- glyceridemia. Circulation 2019 ; 140(6) : 470-486, doi : 10.1161/CIRCULATIONAHA.118.039107, indexed in Pubmed : 31242752.
- Ahmad Z, Pordy R, Rader D, et al : Inhibition of angiopoietin-like protein 3 with evinacumab in subjects with high and severe hypertriglyceridemia. J Am Coll Cardiol 2021 ; 78(2) : 193-195, doi : 10.1016/j.jacc.2021.04.091, indexed in Pubmed : 34238441.
- Raal FJ, Rosenson RS, Reeskamp LF, et al. : ELIPSE HoFH Investiga- tors. Evinacumab pour l’hypercholestérolémie familiale homozygote. N Engl J Med 2020 ; 383(8) : 711-720, doi : 10.1056/NEJMoa2004215, indexed in Pubmed : 32813947.
- Gaudet D, Karwatowska-Prokopczuk E, Baum SJ, et al : Vupanorsen, an N-acetyl galactosamine-conjugated antisense drug to ANGPTL3 mRNA, lowers triglycerides and atherogenic lipoproteins in patients with dia- betes, hepatic steatosis and hypertriglyceridaemia. Eur Heart J 2020 ; 41(40) : 3936-3945, doi : 10.1093/eurheartj/ehaa689, indexed in Pubmed : 32860031.
- Tardif JC, Karwatowska-Prokopczuk E, Amour ES, et al : Apolipoprotein C-III reduction in subjects with moderate hypertriglyceridaemia and at high cardiovascular risk. Eur Heart J. 2022 ; 43(14) : 1401-1412, doi : 10.1093/eu- rheartj/ehab820, indexed in Pubmed : 35025993.
- Gelrud A, Digenio A, Alexander V, et al : Treatment with volanesorsen reduced triglycerides and pancreatititis in patients with FCS and sHTG vs placebo : results of the APPROACH and COMPASS studies. Atherosclerosis ; 32(Suppl 2018) : 157-158.
- Witztum JL, Gaudet D, Freedman SD, et al : Volanesorsen et niveaux de triglycérides dans le syndrome de chylomicronémie familiale. N Engl J Med. 2019 ; 381(6) : 531-542, doi : 10.1056/nejmoa1715944, indexed in Pubmed : 31390500.
- Erqou S, Kaptoge S, Perry PL, et al : Emerging Risk Factors Collaboration. Concentration de lipoprotéine(s) a et risque de maladie coronarienne, d’accident vasculaire cérébral, et de mortalité non vasculaire. JAMA 2009 ; 302(4) : 412-423, doi : 10.1001/jama.2009.1063, indexé dans Pubmed : 19622820.
- Ference BA : The potential clinical benefit of lowering lipoprotein(a). JAMA 2022 [Epub ahead of print], doi : 10.1001/jama.2022.5333, indexed in Pubmed : 35368050.
- Tsimikas S, Karwatowska-Prokopczuk E, Xia S, et al. : AKCEA-APO(a)-LRx Study Investigators. Réduction de la lipoprotéine (a) chez les personnes atteintes de maladies cardiovasculaires. N Engl J Med 2020 ; 382(3) : 244-255, doi : 10.1056/NEJ-Moa1905239, indexed in Pubmed : 31893580.
- Assessing the Impact of Lipoprotein (a) Lowering with Pelacarsen (TQJ230) on Major Cardiovascular Events in Patients With CVD. https://clinicaltrials.gov/ct2/show/NCT04023552 (avril 28, 2022).
- Koren MJ, Moriarty PM, Baum SJ, et al : Développement préclinique et essai de phase 1 d’un nouveau siRNA ciblant la lipoprotéine(a). Nat Med 2022 ; 28(1) : 96-103, doi : 10.1038/s41591-021-01634-w, indexed in Pubmed : 35027752.
- Nissen SE, Wolski K, Balog C, et al : Single ascending dose study of a short interfering RNA targeting lipoprotein (a) production in individuals with elevated plasma lipoprotein(a) levels. JAMA 2022 [Epub ahead of print], doi : 10.1001/jama.2022.5050, indexed in Pubmed : 35368052.
CARDIOVASC 2022 ; 21(4) : 6-15











