L’artériopathie oblitérante périphérique (AOP) peut, dans le pire des cas, entraîner des occlusions vasculaires et nécessiter des amputations ; le risque d’infarctus du myocarde ou d’accident vasculaire cérébral est également nettement plus élevé chez les personnes touchées. Pourtant, ce grave trouble circulatoire des vaisseaux sanguins irriguant les extrémités n’est souvent pas diagnostiqué et n’est pas traité de manière adéquate. Dans ce contexte, les possibilités thérapeutiques sont multiples.
Des études montrent que les patients atteints d’une simple AOPV sont sous-traités en ce qui concerne leurs facteurs de risque et les maladies associées, selon le Dr Jan-Tobias Hensel, médecin-chef, Clinique médicale universitaire, Hôpital cantonal de Bâle-Campagne [1,2]. Et ce, bien que la prévalence de l’APVP symptomatique ou manifeste chez les patients âgés de 45 à 75 ans dans la population générale soit de 8,2% (hommes) et de 5,5% (femmes) [3]. Les groupes à risque comprennent les personnes de plus de 65 ans et les patients de plus de 50 ans présentant des facteurs de risque d’athérosclérose, c’est-à-dire le diabète sucré, la consommation de nicotine, la dyslipidémie, l’hypertension artérielle ou des antécédents familiaux positifs. En outre, cela inclut les patients de tout âge souffrant de diabète sucré et d’un autre facteur de risque d’athérosclérose, ainsi que les patients présentant une athérosclérose connue dans un autre organe, comme une maladie coronarienne, une sténose carotidienne, une sténose de la sous-clavière, une sténose de l’artère rénale ou une sténose de l’artère mésentérique. Chez les patients de plus de 65 ans, 21% ont un indice brachial de la cheville (ABI) <0,9 ou une AOPV manifeste. En outre, l’APVP est associée à une mortalité nettement plus élevée, tant chez les patients symptomatiques que chez les patients asymptomatiques [4].
Anamnèse et examen clinique
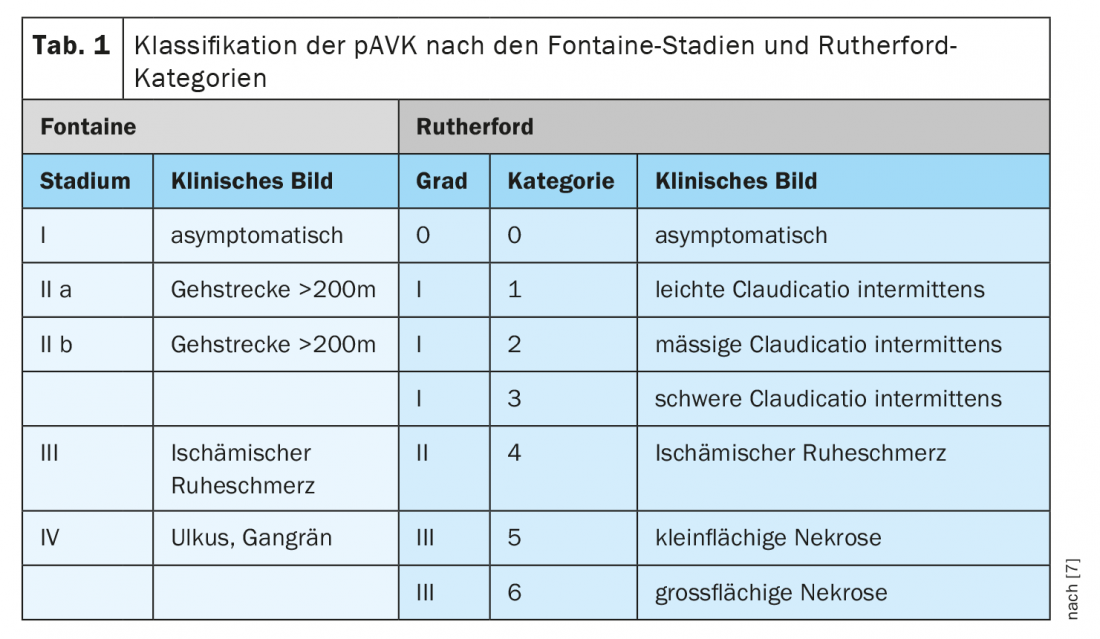
L’APVP résulte d’un rétrécissement des artères des membres ou de l’aorte, généralement dû à des dépôts d’artériosclérose. Un certain nombre d’influences peuvent favoriser ces processus, comme le tabagisme, l’obésité et le manque d’activité physique. Classiquement, l’APVP se caractérise par une claudication intermittente, la fameuse maladie du lèche-vitrine, signe d’une situation de circulation périphérique limitée. Une sensation de fatigue ainsi que des tensions, des crampes musculaires ou des douleurs dans les membres inférieurs apparaissent, qui peuvent être reproduites par un effort physique et s’améliorent avec un repos systématique [5]. Bien que l’AOPV soit couramment appelée “maladie du lèche-vitrine”, il convient de noter qu’environ deux tiers des patients présentant une AOPV confirmée ne présentent pas les symptômes classiques de la claudication, mais des symptômes “atypiques” ou sont asymptomatiques [6]. La classification de l’AOPV selon Fontaine ou Rutherford va de l’AOPV asymptomatique à la douleur ischémique au repos et aux manifestations nécrotiques, en passant par la limitation de la distance de marche (tab. 1) [7] Par définition, la douleur ischémique au repos survient au-dessus de >2 semaines, surtout la nuit, ce qui peut s’expliquer par une diminution du débit cardiaque et donc de la perfusion du membre.
L’examen clinique ne doit pas négliger l’état du pouls et le bruit du flux. Bien que la seule palpation du pouls, avec une sensibilité de 20%, ne soit pas suffisante pour détecter une AOPV, l’état du pouls doit être vérifié dans les territoires vasculaires inguinal, fosse poplitée, tibial et pédieux. La sensibilité des bruits d’écoulement est de 75%, la spécificité de 40% en combinaison avec la palpation du pouls.
Un autre examen clinique permettant d’établir le diagnostic d’une AOPV est le test de positionnement de Ratschow, qui fournit les premières indications sur l’étendue fonctionnelle de la maladie occlusive. Le test de Ratschow peut être très révélateur en termes de diagnostic différentiel, explique le Dr Hensel. Pour ce faire, le patient est allongé sur le dos et on lui demande de lever les jambes à la verticale et d’effectuer des mouvements circulaires au niveau de la cheville pendant deux minutes. Le patient est ensuite invité à s’asseoir, les jambes pendent librement de la table. Les patients en bonne santé ne ressentent aucune douleur pendant les mouvements, une fois assis, le pied rougit dans les cinq secondes et les veines se remplissent dans les cinq secondes suivantes. En cas d’AOPV, la jambe affectée se dégonfle déjà pendant la phase de mouvement. Il faut un certain temps avant que la jambe concernée ne rougisse après s’être assise, ce qui retarde le remplissage des veines.
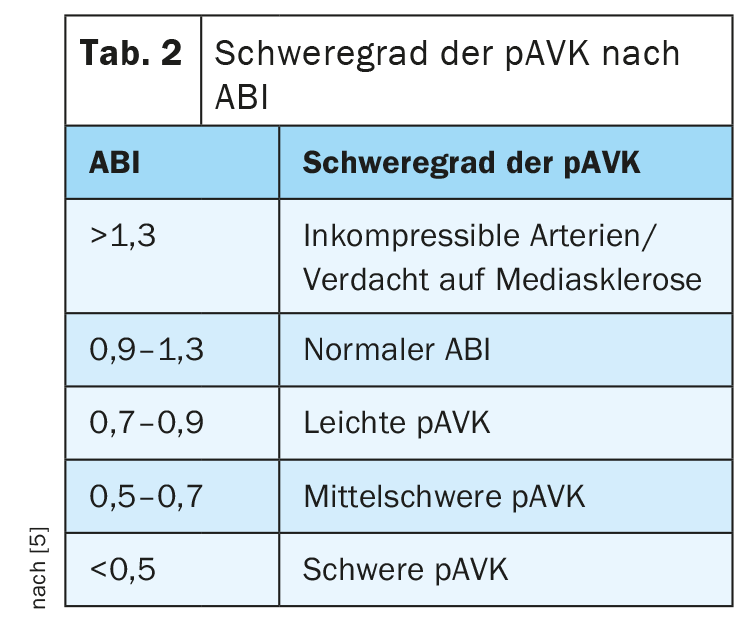
L’indice brachial de la cheville (ABI) peut également servir à estimer le risque cardiovasculaire et à évaluer l’évolution d’une AOP, les valeurs pathologiques présentant une spécificité élevée mais une faible sensibilité. Chez les patients en bonne santé vasculaire, l’ABI se situe entre 0,9 et 1,3, une valeur ABI inférieure à 0,9 est pathognomonique d’une AOPV (tableau 2) [8].
En cas de suspicion clinique, il convient de procéder à un examen en urgence
Les signes cliniques de l’ischémie aiguë des membres inférieurs comprennent les 6P de Pratt : douleur, pâleur, absence de pouls, paralysie, paresthésie et prostration, ainsi que l’étiologie cardiaque ou artérielle ou l’occlusion des reconstructions artérielles. Dans ces cas, une revascularisation interventionnelle ou chirurgicale doit être effectuée le plus rapidement possible. Dans le cas idéal, on obtient une inhibition de la progression de l’athérosclérose, la réduction du risque d’événements vasculaires périphériques, ainsi que la réduction des événements cardiovasculaires et cérébrovasculaires, la réduction de la douleur et l’amélioration de la capacité à l’effort, de la marche et de la qualité de vie font également partie des objectifs thérapeutiques. Selon les directives S3, les reconstructions artérielles par chirurgie vasculaire et endovasculaire doivent être le résultat d’une évaluation interdisciplinaire raisonnable du coût, du risque et de l’événement, en fonction du stade de la maladie [7].
L’entraînement régulier à la marche présente des avantages
L’entraînement structuré à la marche est le traitement non médicamenteux le plus important pour traiter de manière cohérente les facteurs de risque cardiovasculaire, ce qui a été démontré dans diverses revues Cochrane [7]. De plus, le résultat fonctionnel à long terme de l’entraînement à la marche n’est pas inférieur aux interventions vasculaires seules chez les patients souffrant de claudication [9]. Il y a une augmentation significative de la capacité de marche sur le tapis roulant et une diminution de la claudication après l’entraînement à la marche [10]. Il convient toutefois de noter que l’efficacité d’un entraînement quotidien à la marche non supervisé est nettement inférieure à celle d’un programme d’entraînement structuré et supervisé.
Aperçu des mesures de base
des changements de style de vie : Les bases du traitement de base comprennent principalement l’exercice physique, la perte de poids, l’optimisation de l’alimentation ainsi qu’un entraînement à la marche effectué de manière autonome ou structurée. En outre, chaque visite chez le médecin doit être l’occasion de recommander l’arrêt de la nicotine, éventuellement par le biais d’un soutien médicamenteux.
Hypertension artérielle : En cas d’hypertension, la pression artérielle cible <doit être de 140/90 mmHg. Si elle est tolérée, une thérapie intensive présente également des avantages, comme cela a été démontré par exemple dans l’étude SPRINT (“Systolic Pressure Intervention Trial”) [13]. Sinon, il est préférable d’utiliser des inhibiteurs de l’ECA et des antagonistes de l’ATII [7].
Dyslipidémie : en cas de dyslipidémie, la LDL cible <doit être de 1,4 mmol/l². Pour les patients qui n’atteignent pas les valeurs cibles de LDL malgré un traitement par statine toléré au maximum, les inhibiteurs de PCSK9 peuvent être envisagés comme option thérapeutique supplémentaire. [12]. Pour cela, il faut toutefois en faire la demande auprès du médecin-conseil (angiologie, cardiologie, endocrinologie, néphrologie, neurologie). En outre, une instruction spécifique du patient est nécessaire pour l’application.
Diabète sucré : pour le diabète sucré également, il devrait y avoir une fourchette cible d’HbA1c en fonction de l’âge/des comorbidités (6,5-7%/<7,5%). Et il faut veiller à un soin méticuleux des pieds et, le cas échéant, recourir à des semelles orthopédiques qui soulagent la pression, notamment en cas de polyneuropathie.
Artériosclérose : en cas d’artériosclérose, l’aspirine ou le clopidogrel doivent être utilisés en monothérapie en raison de l’agrégation plaquettaire. En outre, Xarelto vascular® est également disponible (2,5 mg 1-0-1 en plus de l’aspérine). Xarelto vascular® est une option valide lorsque la double antiagrégation plaquettaire n’est plus nécessaire. Ce sont surtout les jeunes patients à haut risque <65 ans qui bénéficient de cette administration de médicaments. Les patients âgés >75 ans présentent un risque accru de saignement [11].
Littérature :
- Hensel JT : Maladies artérielles périphériques. Journées de formation continue des médecins généralistes, 08.09.2021.
- Hirsch AT, et al : Gaps in public knowledge of peripheral arterial disease : the first national PAD public awareness survey. Circulation 2007, doi : 10.1161/CIRCULATIONAHA.107.725101.
- Kröger K, et al : Prevalence of peripheral arterial disease – results of the Heinz Nixdorf recall study. Eur J Epidemiol 2006, doi : 10.1007/s10654-006-0015-9.
- Diehm C, et al : High All-Cause Mortality in Patients with Peripheral Arterial Disease in Primary Care : Five-Year Results of the getabi Study. Circulation 2007.
- Gerhard-Herman MD, et al. : 2016 AHA/ACC Guideline on the Management of Patients with Lower Extremity Peripheral Artery Disease : Executive Summary. Vasc Med 2017, doi : 10.1177/1358863X17701592.
- Hirsch, AT et al : Peripheral arterial disease detection, awareness, and treatment in primary care. JAMA 2001, doi : 10.1001/jama.286.11.1317.
- Société allemande d’angiologie – Société de médecine vasculaire : S3-Leitline zur Diagnostik, Therapie und Nachsorge der peripheren arterllen Verschlusskrankheit. www.awmf.org/uploads/tx_szleitlinien/065-003l_S3_PAVK_periphere_arterielle_Verschlusskrankheit_2020-05.pdf.
- Jeanneret-Gris C : Maladie artérielle occlusive périphérique (MAOP). Le diagnostic différentiel le plus important dans la douleur à la jambe. Phlébologie 2014, doi : 10.12687/phleb2241-6-2014.
- Nordanstig J. et al. : Performance de marche et qualité de vie liée à la santé après traitement invasif ou endovasculaire invasif versus non invasif pour claudication intermittente. Eur J Vasc Endovasc Surg 2011, doi : 10.1016/j.ejvs.2011.02.019. Epub 2011 Mar 11.
- Nicolai SP, et al : Multicenter randomized clinical trial of supervised exercise therapy with or without feedback versus walking advice for intermittent claudication. J Vasc Surg 2010, doi : 10.1016/j.jvs.2010.02.022. Epub 2010 May 15.
- Steffel J, et al. : Rapport d’experts suisses sur l’utilisation pratique du rivaroxaban 2,5 mg 2×/jour plus ASS pour le traitement des patients atteints de maladie coronarienne (MC) et/ou de maladie artérielle périphérique. https://dreicast.com/wp-content/uploads/2021/01/3_Schweizer-Experten-Bericht_Xarelto-vascular.pdf.
- Gencer B, et al : Expected impact of applying new 2013 AHA/ACC cholesterol guidelines criteria on the recommended lipid target achievement after acute coronary syndromes. Atherosclerosis 2015, doi : 10.1016/j.atherosclerosis.2014.12.049.
- Wright JT Jr, et al : A randomized trial of intensive versus standard blood pressure control. Groupe de recherche SPRINT. N Engl J Med 2015 ; 373(22) : 2103-2116.
PRATIQUE DU MÉDECIN DE FAMILLE 2021 ; 16(12) : 26-27