L’antigène membranaire spécifique de la prostate (PSMA) joue un rôle de plus en plus important, et pas seulement dans le diagnostic du cancer de la prostate. Le radioligand 117Lutetium-PSMA-617offre également une nouvelle option thérapeutique pour le cancer de la prostate avancé résistant à la castration (mCRPC). Celle-ci pourrait bientôt atteindre des stades plus précoces de la maladie et des lignes de traitement.
La radiothérapie au 117Lutetium-PSMA-617a suscité un grand intérêt lors de tous les grands congrès d’oncologie de cette année. Une raison suffisante pour qu’une session spéciale lui soit consacrée lors de l’ Advanced Prostate Cancer Consensus Conference (APCCC), qui s’est tenue le 9 octobre. Outre les résultats des études actuelles, les défis cliniques et les espoirs pour l’avenir ont été discutés à cette occasion, tant dans le domaine du traitement basé sur la PSMA que dans celui du diagnostic.
PSMA : Petit guide de référence
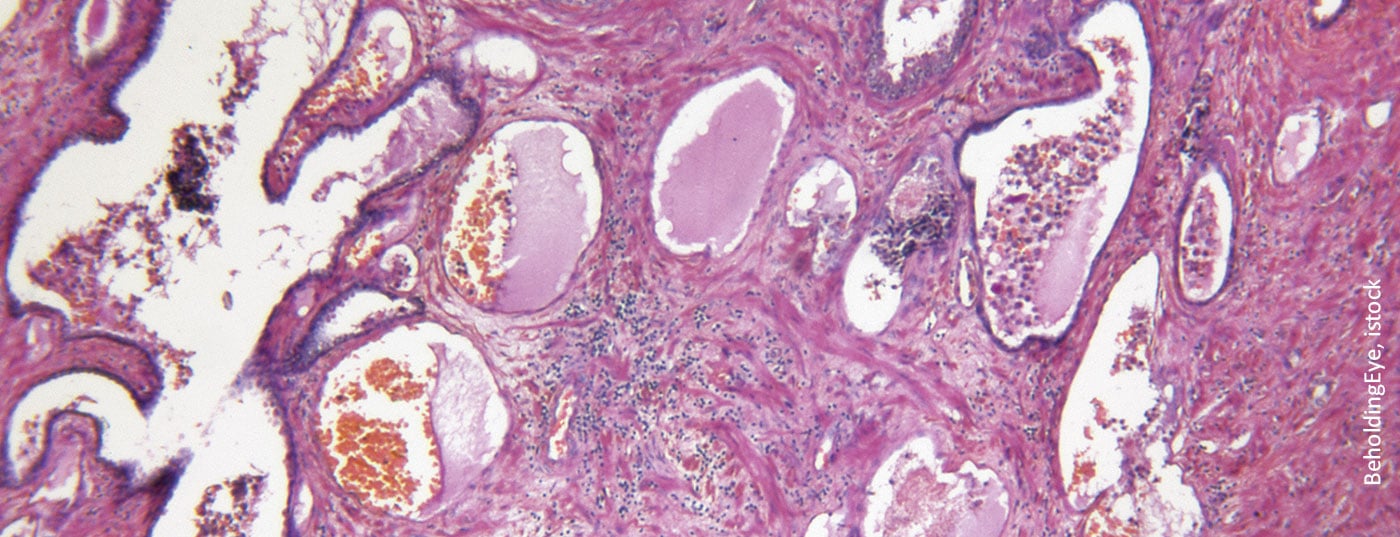
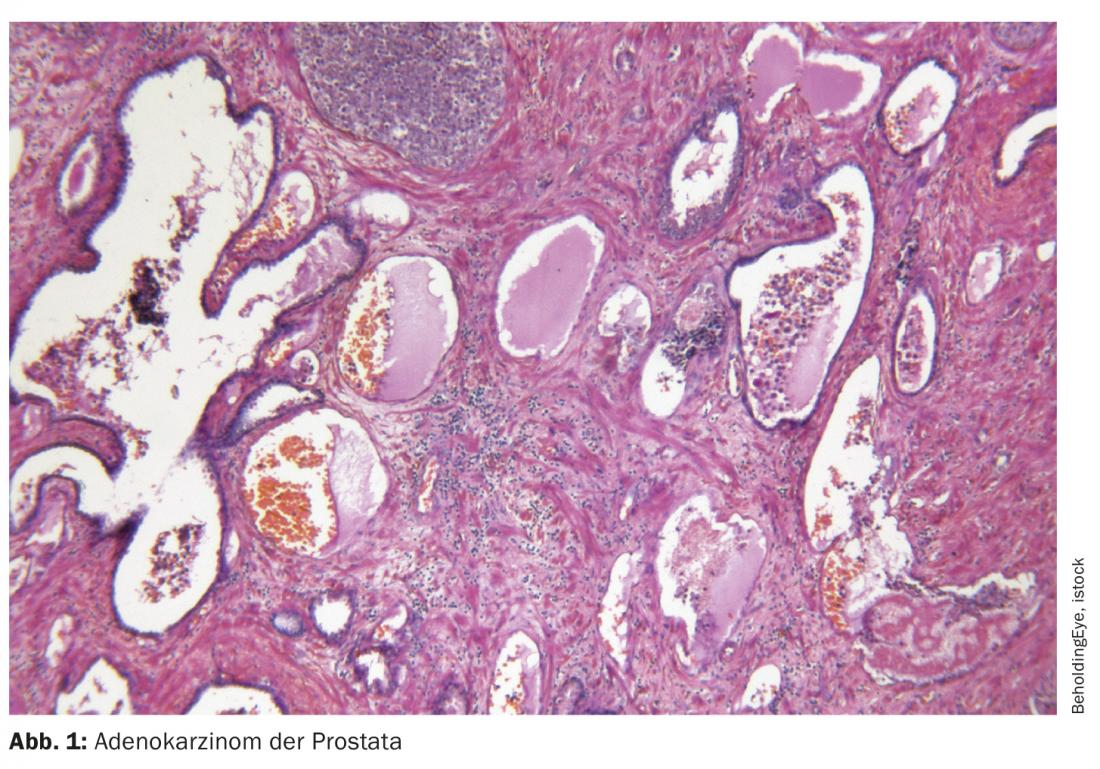
L’antigène membranaire spécifique de la prostate (PSMA) est une protéine transmembranaire ayant la fonction enzymatique d’une folathydrolase-carboxypeptidase. Il possède un domaine cytoplasmique court et un domaine extracellulaire long, ainsi qu’une région transmembranaire hydrophobe [1,2]. La PSMA est exprimée en particulier, mais pas exclusivement, dans les cellules épithéliales de la prostate. Dans le cas du cancer de la prostate, on observe une surexpression jusqu’à 1000 fois supérieure à celle des autres types de tissus. La protéine la plus susceptible de servir à l’absorption de l’acide folique et du glutamate, mais son rôle exact n’a pas encore été élucidé à ce jour. Outre la prostate, la PSMA est physiologiquement présente dans les glandes lacrymales et salivaires ainsi que dans l’intestin grêle. Une expression légèrement plus faible est détectée dans le foie, la rate et les ganglions parasympathiques, ce qui peut parfois conduire à des résultats faussement positifs dans l’imagerie basée sur la PSMA [3]. De plus, comme les traceurs utilisés sont éliminés par voie rénale, leur absorption par les reins, les uretères et la vessie est inévitable.
Il existe des différences intra- et interindividuelles marquées dans l’expression de la PSMA, qui ont une grande importance en clinique. D’une part, sans PSMA, la cible thérapeutique fait défaut, d’autre part, les lésions PSMA négatives ne peuvent pas être détectées par l’imagerie basée sur le PSMA. Jusqu’à 10% des patients ne présentent aucune expression ou seulement une expression minimale. En général, elle est plus élevée dans le mCRPC que dans le cancer de la prostate sensible à la castration (CSPC). Des niveaux plus élevés de PSMA sont associés à un score de Gleason plus élevé et à une moins bonne survie globale [4]. Souvent, certains foyers d’un patient expriment la PSMA, tandis que d’autres restent invisibles sur la TEP PSMA – un défi clinique.
La PSMA a été identifiée comme une cible thérapeutique et diagnostique potentielle il y a plus de 30 ans. Dès 1996, un anticorps monoclonal dirigé contre la PSMA a reçu la première autorisation de la FDA : ProstaScint®. Celui-ci s’est toutefois révélé peu fiable lors des essais cliniques, car il se lie au domaine cytoplasmique de la PSMA et ne s’installe donc que dans les cellules cancéreuses apoptotiques. Les approches récentes qui ciblent la PSMA sont donc basées sur une attaque du domaine extracellulaire de la protéine transmembranaire.
L’interaction du récepteur des androgènes avec la PSMA est intéressante. Par exemple, le traitement par déprivation androgénique (ADT) entraîne généralement une augmentation de l’expression de PSMA, tant dans les cas sensibles à la castration que dans les cas résistants à la castration [5,6]. Certaines métastases n’apparaissent même pas à l’imagerie PSMA avant l’ADT. En raison de la réponse tumorale, le cancer de la prostate sensible à la castration (CSPC) produit des effets opposés de l’ADT sur l’imagerie PSMA : le nombre de cellules tumorales diminue, mais celles-ci présentent une expression plus élevée de PSMA.
PSMA dans l’imagerie
En attendant, le PSMA-PET est une méthode d’imagerie robuste avec un processus clairement défini et une bonne disponibilité mondiale. Des guidelines existent depuis 2017 et une mise à jour est attendue en 2022 [7]. Néanmoins, l’utilisation optimale n’est pas définitivement établie et il existe quelques défis cliniques. Il existe notamment un grand nombre de traceurs qui n’ont pas été suffisamment comparés entre eux jusqu’à présent (aperçu 1). Quelques comparaisons sur un petit nombre de patients montrent des résultats similaires pour les différentes substances [8,9]. Les données les plus robustes existent pour la comparaison entre le 18F-PSMA-1007et le 68Ga-PSMA-11, probablement parce que ces traceurs sont les plus répandus. Dans ce cadre, il a été démontré que le 18F-PSMA-1007donne plus de résultats faussement positifs. En particulier, les lésions osseuses ne peuvent pas être détectées avec certitude par le 18F-PSMA-1007en raison de l’accumulation physiologique dans la moelle osseuse. Il convient donc, en particulier pour ce traceur, de recourir à une imagerie supplémentaire telle que l’IRM ou le scanner pour interpréter les images. D’autre part, le 18F-PSMA-1007s’est révélé extrêmement utile dans l’évaluation des conditions locorégionales [10]. En ce qui concerne la sensibilité, il ne semble pas y avoir d’inconvénient à utiliser un traceur [11]. En fin de compte, différents traceurs sont probablement plus appropriés en fonction du setting – un domaine dans lequel il reste encore beaucoup à explorer.

Outre le manque de caractérisation précise de différents traceurs, le PSMA-PET présente également d’autres défis, notamment financiers. Quelle que soit la substance utilisée, la sensibilité de la méthode n’est jamais de 100%. De plus, l’évaluation fiable des images nécessite une certaine expérience – expérience qui ne va pas de soi compte tenu de la nouveauté. La PSMA n’est en aucun cas spécifique au cancer, à la prostate ou même au cancer de la prostate. La place clinique de l’imagerie basée sur la PSMA et son impact sur la pratique clinique doivent également être clarifiés à l’avenir.
Ainsi, la question brûlante est de savoir si le PSMA-PET est vraiment la meilleure modalité pour un staging fiable. Il est difficile de répondre à cette question, d’autant plus que jusqu’à présent, presque tous les essais cliniques ont utilisé l’imagerie conventionnelle pour évaluer le stade de la tumeur et que les comparaisons randomisées font défaut. Remplacer ou compléter l’imagerie classique par une TEP PSMA pourrait avoir des conséquences durables et difficiles à évaluer sur la prise en charge clinique, y compris le traitement, et donc sur le résultat. Si, par exemple, des métastases non encore détectées sont identifiées par cette méthode, le risque de surtraitement n’est pas le moindre. D’autre part, il existe probablement des patients qui bénéficieraient d’une évaluation plus précise du stade de leur maladie et donc d’une intensification du traitement. L’objectif doit rester d’identifier, grâce à l’imagerie, les personnes qui ont réellement besoin d’une augmentation de l’intensité et d’améliorer ainsi leurs résultats cliniques.
Pour illustrer cette problématique, quelques chiffres impressionnants ont été présentés à l’APCCC. Ainsi, 98% des patients atteints de CRPC considérés comme M0 dans le staging conventionnel présentent des lésions au PSMA-PET, dont 24% sont à nouveau locales et 76% N1/M1 [12]. Au total, environ la moitié des patients initialement M0 deviennent donc des patients M1 – un upstaging qui a des conséquences. En effet, même si les options de traitement sont similaires pour le CRPC métastatique et non métastatique, l’option de l’apalutamide ou du darolutamide est perdue selon le statut actuel de l’autorisation de mise sur le marché [13]. Avec les nouvelles modalités d’imagerie, la gestion clinique doit toujours être remise en question et adaptée – un processus qui est actuellement en plein essor dans le cas du cancer de la prostate. Il ne fait aucun doute que la TEP PSMA est supérieure en termes de spécificité et de sensibilité à la TDM conventionnelle et à la TEP à la choline, qui étaient utilisées jusqu’en 2016. Cependant, la valeur clinique reste à déterminer, idéalement dans le cadre d’essais cliniques randomisés.
Radiothérapie à base de PSMA
Autant l’utilisation de la TEP PSMA peut être controversée dans le staging, autant elle est claire dans la sélection des patients pour le traitement par radioligands ciblés par la PSMA. En tant que tel, le 117Lutetium-PSMA-617est déjà accessible dans des centres spécialisés en Suisse dans le cadre d’un programme d’utilisation compassionnelle, même si une autorisation de Swissmedic n’a pas encore été délivrée [13]. Jusqu’à présent, ce traitement est utilisé après l’échec d’un agent de ciblage AR et d’un taxane (docétaxel) dans le mCRPC. La séquence thérapeutique idéale avec le cabazitaxel n’est pas encore claire à l’heure actuelle et doit être évaluée individuellement. En raison de sa nature différente, cette thérapie a un fort potentiel pour compléter de manière optimale les possibilités existantes. De plus, avec un taux d’expression d’environ 87% dans le mCRPC, la PSMA constitue une cible quasi ubiquitaire, y compris un biomarqueur de réponse. Le traitement ciblé sur la PSMA pourrait donc être une option pour un grand nombre de personnes atteintes à l’avenir – et l’identification des patients appropriés ne serait pas particulièrement compliquée.
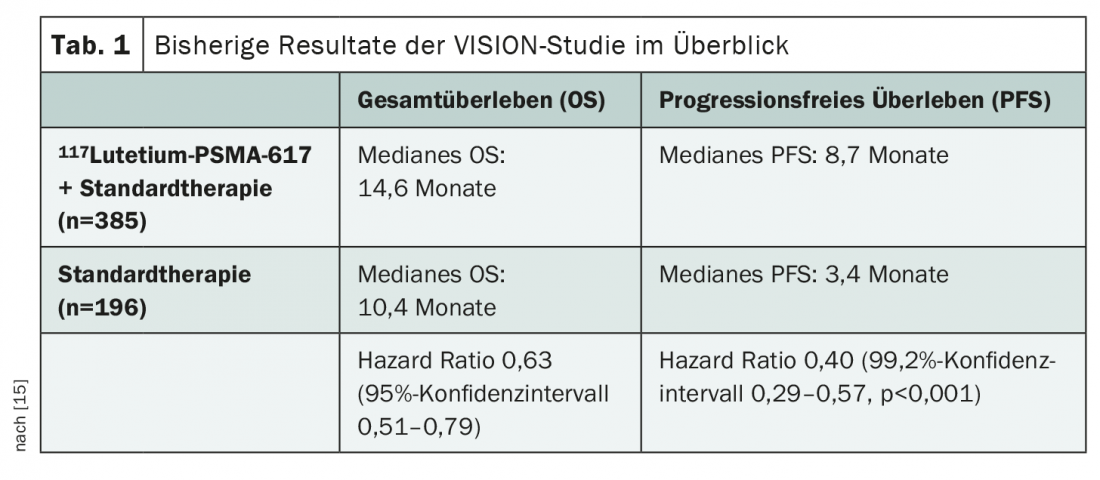
La plupart des données disponibles à ce jour sur le 117Lutetium-PSMA-617proviennent de l’étude VISION, récemment publiée et présentée lors de divers congrès [14,15]. Cette étude porte sur l’ajout du 117Lutetium-PSMA-617au traitement standard du mCRPC après un prétraitement par au moins un bloqueur des récepteurs aux androgènes et un régime de chimiothérapie à base de taxane, en cas de TEP/TDM au 68gallium-PSMA-11positif. Des avantages significatifs ont déjà été observés en termes de survie globale (SG) et de survie sans progression (SSP) dans tous les sous-groupes (tableau 1). Compte tenu de l’efficacité démontrée du traitement par 117Lutetium-PSMA-617dans ce cadre, diverses autres questions se posent à présent. Par exemple, le moment optimal pour le traitement doit encore être déterminé. Le 117Lutetium-PSMA-617doit-il être utilisé avant, avec ou après la chimiothérapie ? Et le traitement par radioligands pourrait-il être utilisé à des stades plus précoces de la maladie, par exemple dans le CSPC ou dans les cas non métastatiques ? Qu’en est-il des options thérapeutiques suivantes ? Il n’existe pas non plus de données fiables à ce jour pour évaluer la toxicité à long terme, en particulier la suppression de la moelle osseuse. Cette question devrait prendre de plus en plus d’importance au fur et à mesure que les tests seront effectués à des stades de plus en plus précoces de la maladie et dans des lignes de traitement.
Certaines études examinent actuellement la séquence de traitement optimale en utilisant le 117Lutetium-PSMA-617. Par exemple, l’étude PSMAfore, qui teste l’efficacité du radioligand dans le mCRPC après un bloqueur des récepteurs aux androgènes mais avant la chimiothérapie, est en cours. L’étude PSMAddition, qui évalue l’ajout du 117Lutetium-PSMA-617au traitement standard du mCSPC en première ligne, examine une application encore plus précoce. Une étude est également en cours dans le cadre d’un traitement néoadjuvant : LuTectomy. Alors que le bénéfice dans le mCRPC après une chimiothérapie à base de taxanes est désormais prouvé, l’utilisation dans les lignes de traitement antérieures et les stades de la maladie sera démontrée au cours des prochaines années.
La sélection des patients, une clé ?
Les experts de l’APCCC ont attribué le fait que la plupart des patients de l’étude VISION n’ont pu obtenir qu’une diminution du PSA de <50% grâce au traitement au 117Lutetium-PSMA-617, entre autres, à la mauvaise sélection des patients jusqu’à présent. Il est probable que tous les patients inclus n’ont pas bénéficié du traitement supplémentaire. Cela pourrait indiquer que d’autres méthodes de sélection des patients devraient être utilisées en plus de la TEP PSMA afin d’obtenir une efficacité clinique optimale. Il peut s’agir d’un problème génétique, mais une TEP-FDG supplémentaire est également une option.
Le profil génétique dans le cancer de la prostate est extrêmement hétérogène, par exemple, la maladie métastatique de novo présente souvent un profil génétique moins favorable avec un moins bon résultat [16]. Ces patients répondent moins bien à un certain nombre de traitements, ce qui pourrait également s’avérer vrai pour le traitement au 117Lutetium-PSMA-617. Il n’existe cependant pas de données fiables à ce sujet, ce qui justifie la détermination du profil génétique dans le cadre d’études cliniques. Ainsi, à l’avenir, le profil génétique pourrait être pris en compte dans les décisions de traitement, en plus de l’expression de la PSMA.
Il n’est pas non plus clair si, en plus du PSMA, un FDG-PET doit être utilisé pour la sélection des patients. Il n’a pas été réalisé dans l’étude VISION [14] – contrairement à l’étude TheraP qui a comparé le traitement par 117Lutetium-PSMA-617au cabazitaxel dans le mCRPC [17]. L’ajout du FDG-PET a entraîné d’une part un plus grand nombre d’exclusions de l’étude – et d’autre part un taux de réponse plus élevé au traitement au 117Lutetium-PSMA-617, soit 66% (VISION : 46%). Cela est probablement dû au fait que les patients qui, en plus des métastases exprimant la PSMA, présentaient également des métastases sans expression correspondante, ont pu être identifiés et exclus grâce au FDG-PET. Outre un avantage potentiel dans la sélection des patients, la réalisation d’un FDG-PET présente également des avantages dans la caractérisation plus précise de la maladie et l’optimisation des sites de prélèvement de la biopsie. Par exemple, les symptômes causés par les métastases peuvent être mieux attribués et traités correctement à un stade précoce. En général, l’hétérogénéité intra-individuelle du cancer de la prostate métastatique constitue une limite importante au traitement par radioligands. Celle-ci peut être détectée par un FDG-PET supplémentaire.
Musique d’avenir : des combinaisons et de nouvelles substances actives
Le développement du 117Lutetium-PSMA-617pose les bases d’une nouvelle option thérapeutique pour le cancer de la prostate. Il s’agira de les étudier plus en détail dans les années à venir et de les caractériser en fonction de leur potentiel. Les combinaisons thérapeutiques optimales ainsi que les séquences doivent encore être trouvées. Il existe en outre des approches thérapeutiques alternatives qui ciblent également la PSMA.
Un vaste champ de recherche s’ouvre dans le domaine des thérapies combinées possibles avec le 117Lutetium-PSMA-617. Des combinaisons de médicaments appropriées pourraient notamment prévenir les résistances dues à l’hétérogénéité de la maladie. Actuellement, des associations avec l’enzalutamide en première ligne (ENZA-P), ainsi que l’olaparib (LuPARP) et le pembrolizumab (PRINCE) en deuxième ligne sont à l’étude dans le mCRPC. Les choses évoluent également en ce qui concerne d’éventuels traitements ultérieurs. Ici, l’accent est mis en particulier sur les émetteurs α. Ceux-ci pourraient d’une part être utilisés après l’émetteur β 117Lutetium-PSMA-617et d’autre part constituer une alternative plus efficace et moins agressive à ce dernier. En effet, les émetteurs α provoquent un transfert d’énergie plus important à une portée plus courte. Les substances 225Act-PSMA-617, 225Act-J591et 227Thorium-PSMA-TTCsont actuellement étudiées dans le cadre d’études de phase I. Les résultats de ces études sont présentés dans le tableau ci-dessous.
Les cellules CAR-T et les anticorps bispécifiques (BiTE, Bispecific T-Cell Engagers), comme l’acapatamab, constituent des classes alternatives de médicaments ciblant le PSMA. Actuellement, elles n’en sont qu’à leurs débuts et leur développement s’avère également difficile compte tenu du stade avancé de la maladie et de la grande vulnérabilité de la population de patients. Néanmoins, les premiers résultats des études de phase I sont porteurs d’espoir, avec des taux de réponse de 34% [18]. Nous restons attentifs.
Source : PSMA in diagnostics and therapy. Session 2, Advanced Prostate Cancer Consensus Conference (APCCC) en ligne, 09.10.2021.
Littérature :
- Rajasekaran AK, Anilkumar G, Christiansen JJ : Is prostate-specific membrane antigen a multifunctional protein ? Am J Physiol Cell Physiol. 2005 ; 288(5) : C975-981.
- Sengupta S, et al : Comparaison des ligands de l’antigène membranaire spécifique de la prostate dans la recherche de traduction clinique pour le diagnostic du cancer de la prostate. Cancer Rep (Hoboken). 2019 ; 2(4) : e1169.
- Hofman MS, et al : Prostate-specific Membrane Antigen PET : utilité clinique dans le cancer de la prostate, les modèles normaux, les perles, et les pitfalls. Radiographics. 2018 ; 38(1) : 200-217.
- Paschalis A, et al. : Hétérogénéité de l’antigène membranaire spécifique de la prostate et défauts de réparation de l’ADN dans le cancer de la prostate. Eur Urol. 2019 ; 76(4) : 469-478.
- Bakht MK, et al : Influence du traitement par privation d’androgènes sur la prise d’agents ciblés par la PSMA : opportunités et défis émergents. Nucl Med Mol Imaging. 2017 ; 51(3) : 202-211.
- Hope TA, et al : 68Ga-PSMA-11 PET Imaging of Response to Androgen Receptor Inhibition : First Human Experience. J Nucl Med. 2017 ; 58(1) : 81-4.
- Fendler WP, et al : (68)Ga-PSMA PET/CT : Joint EANM and SNMMI procedure guideline for prostate cancer imaging : version 1.0. Eur J Nucl Med Mol Imaging. 2017 ; 44(6) : 1014-1024.
- Giesel FL, et al : Comparaison intra-individuelle du (18)F-PSMA-1007 et du (18)F-DCFPyL PET/CT dans l’évaluation prospective des patients atteints d’un cancer de la prostate nouvellement diagnostiqué : une étude pilote. J Nucl Med. 2018 ; 59(7) : 1076-80.
- Dietlein M, et al : Comparaison de [(18)F]DCFPyL et [ (68)Ga]Ga-PSMA-HBED-CC pour l’imagerie PSMA-PET chez les patients atteints d’un cancer de la prostate en rémission. Mol Imaging Biol. 2015 ; 17(4) : 575-584.
- Dietlein F, et al : Comparaison intra-individuelle du (18)F-PSMA-1007 avec les ligands PSMA excrétés par voie rénale pour l’imagerie PSMA PET chez les patients atteints d’un cancer de la prostate en rémission. J Nucl Med. 2020 ; 61(5) : 729-734.
- Rauscher I, et al : Matched-Pair Comparison of (68)Ga-PSMA-11 PET/CT and (18)F-PSMA-1007 PET/CT : Frequency of Pitfalls and Detection Efficacy in Biochemical Recurrence After Radical Prostatectomy. J Nucl Med. 2020 ; 61(1) : 51-57.
- Fendler WP, et al : Prostate-Specific Membrane Antigen Ligand Positron Emission Tomography in Men with Nonmetastatic Castration-Resistant Prostate Cancer. Clin Cancer Res. 2019 ; 25(24) : 7448-7454.
- Information sur les médicaments de Swissmedic : www.swissmedicinfo.ch (dernier accès le 21.10.2021).
- Sartor O, et al : Lutetium-177-PSMA-617 pour le cancer de la prostate métastatique résistant à la castration. N Engl J Med. 2021 ; 385(12) : 1091-1103.
- Morris MJ, et al. : Étude de phase III du lutetium-177-PSMA-617 chez des patients atteints de cancer de la prostate métastatique résistant à la castration (VISION). ASCO Annual Meeting 2021, Plenary Session Genitourinary Cancer – Prostate, Testicular, and Penile, Abstract #LBA4.
- Deek MP, et al : The Mutational Landscape of Metastatic Castration-sensitive Prostate Cancer : The Spectrum Theory Revisited. Eur Urol. 2021 ; 80(5) : 632-640.
- Hofman MS, et al. : [(177)Lu]Lu-PSMA-617 versus cabazitaxel chez les patients atteints de cancer de la prostate métastatique résistant à la castration (TheraP) : un essai randomisé de phase 2, en ouvert. Lancet . 2021 ; 397(10276) : 797-804.
- Einsele H, et al : La plateforme BiTE (bispecific T-cell engager) : Développement et potentiel futur d’un traitement immuno-oncologique ciblé sur tous les types de tumeurs. Cancer . 2020 ; 126(14) : 3192-3201.
InFo ONKOLOGIE & HÄMATOLOGIE 2021 ; 9(6) : 26-28 (publié le 8.12.21, ahead of print)