Cancer de l’endomètre, sarcomes utérins, cancer du col de l’utérus – les tumeurs utérines sont aussi variées que les différentes cellules que l’on trouve dans l’utérus. En conséquence, la gestion diffère également de manière significative. Il est essentiel d’établir un diagnostic précis pour classifier les risques afin de garantir les meilleurs soins possibles.
Les tumeurs utérines touchent les femmes de différents âges et à différentes étapes de leur vie. L’origine des tumeurs est variée, comme les différentes cellules que l’on trouve dans l’utérus. Les processus malins se présentent souvent sous la forme d’une symptomatologie commune de saignement vaginal.
Dans cet article de synthèse, nous souhaitons aborder les différentes tumeurs utérines et donner une vue d’ensemble avec un aperçu des possibilités de traitement.
Cancer de l’endomètre
Le cancer de l’endomètre est l’une des tumeurs gynécologiques les plus fréquentes après le cancer du sein, avec l’enregistrement de 4634 cas dans le registre na-tional des cancers en Suisse entre 2013 et 2017. Dans un peu plus de 75% des cas, le cancer de l’endomètre est diagnostiqué en post-ménopause, après des saignements post-ménopausiques fréquents. Le facteur de risque du cancer de l’endomètre hormono-dépendant (type I) est l’excès d’œstrogènes. Cela se traduit par un risque accru en cas de traitement par œstrogènes seuls en post-ménopause (tibolone, tamoxifène, selon la durée d’utilisation, également traitement combiné avec un progestatif, thérapies de stimulation ovarienne) [1]. Une ménarche précoce et une ménopause tardive peuvent également favoriser le cancer de l’endomètre, tout comme l’obésité, un métabolisme du glucose perturbé et la présence d’un syndrome des ovaires polykystiques (SOPK). En cas d’antécédents familiaux positifs avec apparition d’un cancer de l’endomètre chez des parents du 1er degré, le risque de développer la maladie avant l’âge de 70 ans est de 3,5%, contre 3,1% dans la population normale [2]. Heureusement, le cancer de l’endomètre est souvent symptomatique à un stade précoce en termes de saignements post-ménopausiques, ce qui explique dans une certaine mesure le bon pronostic avec une probabilité de survie à 5 ans de 80%. Chez les patientes préménopausées présentant des saignements utérins anormaux, le risque d’hyperplasie avec atypies ou de carcinome est inférieur à 1,5%. Toutefois, après une tentative infructueuse de traitement conservateur, il convient ici aussi de procéder généreusement à une biopsie par pipelle ou à une hystéroscopie et à un curetage pour examen histologique.
Le gold standard du diagnostic reste l’hystéroscopie avec curetage, qui doit être réalisée en cas de saignement post-ménopausique avec un endomètre ≥3 mm. Les conditions utérines locales doivent être examinées par échographie transvaginale. Si les résultats ne sont pas clairs, un examen IRM du pelvis peut apporter des éclaircissements. Une imagerie supplémentaire par tomodensitométrie est indiquée dans les stades avancés ou en cas d’histologie agressive pour évaluer les conditions extra-utérines.
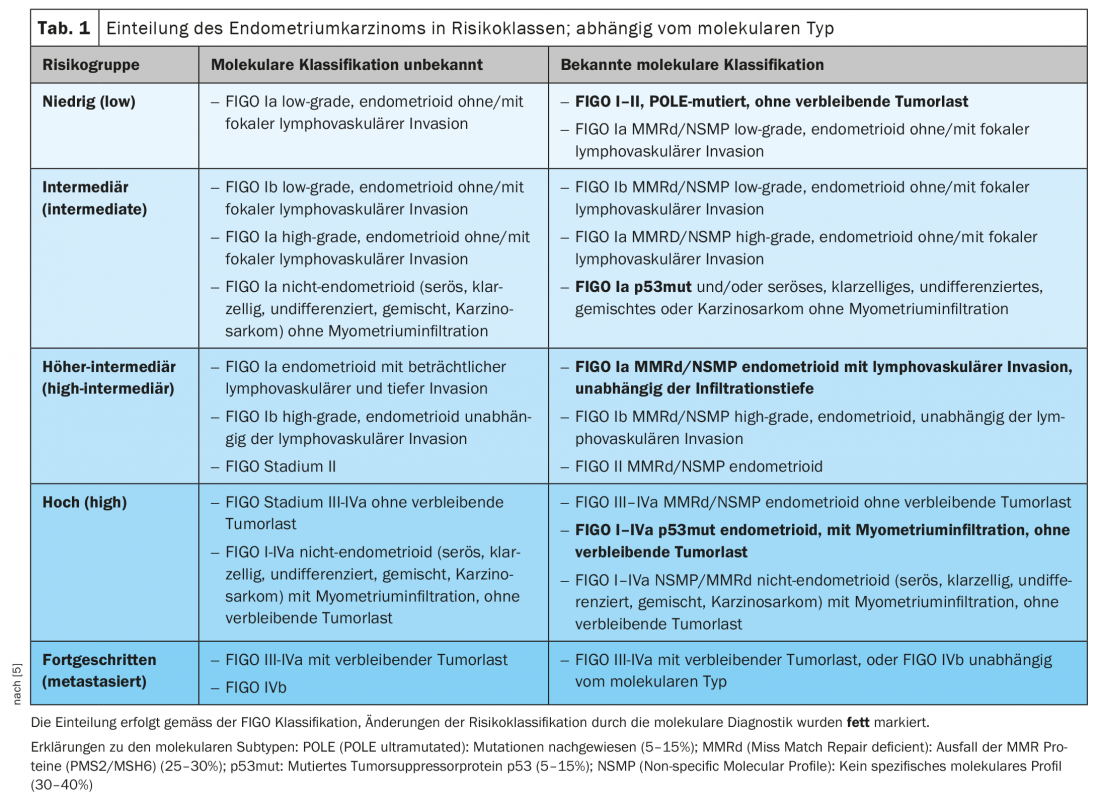
Le cancer de l’endomètre est classiquement divisé en deux types. Le type I, l’adénocarcinome endométrioïde, est hormonosensible, tandis que le type II est hormono-indépendant. Le groupe des carcinomes de type II se compose de carcinomes séreux ou à cellules claires plus agressifs et de carcinosarcomes et concerne une population plus âgée. L’analyse moléculaire du groupe TCGA (The Cancer Genome Atlas-Project) a permis de diviser le cancer de l’endomètre en quatre groupes moléculaires qui peuvent fournir une meilleure prédiction du pronostic et, à l’avenir, un traitement adapté. Dans l’édition 2020 de Pathologie de l’OMS, les cancers de l’endomètre sont désormais classés en POLE, MMRd (Mismatch Repair deficient), p53mut et NSMP (Non-specific Molecular Profile). Le pronostic est très favorable pour le mutant POLE, suivi du type instable microsatellite MMRd ; les carcinomes p53mut ont un pronostic significativement moins bon et se comportent de manière similaire au carcinome séreux de l’ovaire [3,4].
La classification des risques ESMO-ESGO-ESTRO a intégré les marqueurs moléculaires dans sa dernière édition 2021, de sorte que ces marqueurs sont désormais inclus dans la clinique (tableau 1) [5]. Dans les tumeurs avancées, les marqueurs moléculaires, en particulier le MMRd, permettent de nouvelles options thérapeutiques par le biais d’inhibiteurs de points de contrôle.
Le traitement chirurgical doit aujourd’hui être réalisé par hystérectomie laparoscopique avec annexectomie bilatérale. Chez les patientes préménopausées, les annexes peuvent être laissées en place aux stades précoces, après information sur les risques et en l’absence de mutation BRCA et de syndrome de Lynch. Le staging est effectué de manière chirurgicale. Celui-ci peut inclure une coupe rapide pour évaluer l’épaisseur de l’infiltration. La décision de procéder à une lymphonectomie pelvienne et para-aortique ainsi qu’à une omentectomie dépend du groupe de risque (intermédiaire-haut et haut risque) et du stade (pT1b, G3, type II, L1). La lymphonectomie doit toujours comprendre une lymphonectomie pelvienne et paraaortique, conformément au flux lymphatique de l’utérus. Les ganglions lymphatiques macroscopiquement visibles doivent également être retirés dans le cas des cancers de type I à un stade précoce.
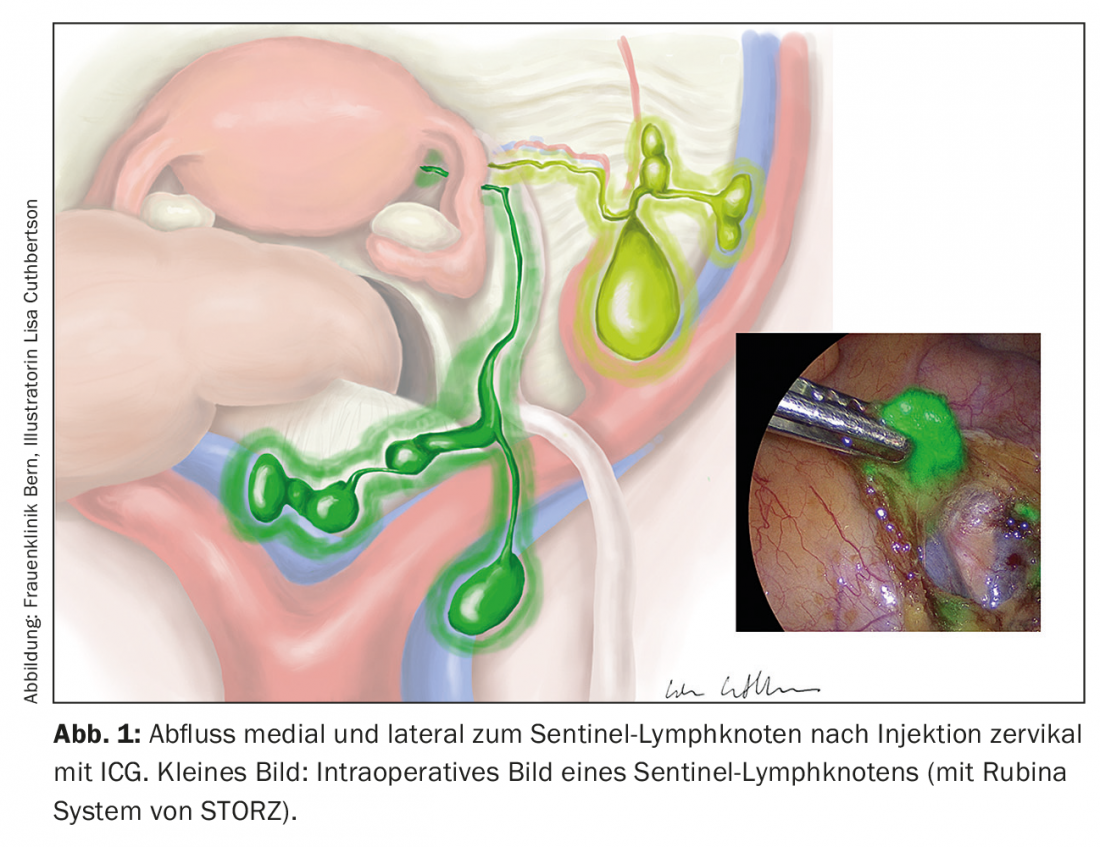
Le concept d’excision du ganglion sentinelle a fait l’objet de nombreuses études. Le vert d’indocyanine est appliqué au niveau cervical ou péritumoral et peut être visualisé en peropératoire par une technique d’imagerie proche infrarouge (Fig. 1). Cette technique n’entraîne pas d’augmentation de la morbidité et le taux de détection est supérieur à 90%, avec un taux de faux positifs de 5%. L’échographie par examen immunohistochimique des ganglions sentinelles négatifs peut apporter un bénéfice supplémentaire par la mise en évidence de micrométastases [6–8]. Dans les situations à haut risque, l’excision du ganglion sentinelle reste toutefois indiquée uniquement dans le cadre d’études.
Un traitement de préservation de la fertilité n’est envisageable qu’au stade IA, après exclusion d’une infiltration myométriale. Après information explicite, un traitement progestatif (minipilule ou DIU progestatif) est administré pendant six mois, suivi d’une tentative d’avoir un enfant. Dès que celui-ci est rempli, un staging chirurgical doit être effectué.
Sarcome utérin
Les sarcomes sont beaucoup moins fréquents que les cancers de l’endomètre, avec une incidence de 1,5-3/100 000, et une mortalité significativement plus élevée. Le taux de survie à 5 ans est inférieur à 50%. Les sarcomes peuvent prendre naissance dans le myomètre, le tissu conjonctif utérin ou le stroma endométrial. L’OMS distingue le léiomyosarcome (60-70%), le sarcome du stroma endométrial de bas ou haut grade (10% chacun), le sarcome utérin indifférencié (10%), l’adénosarcome et la variante maligne du PECome (tumeur épithélioïde périvasculaire) (tous deux beaucoup plus rares). Les facteurs de risque sont une ascendance africaine, la prise de tamoxifène et une mutation germinale du gène TP53, également appelée syndrome de Li-Fraumeni.
Cliniquement, les sarcomes se présentent souvent avec des saignements vaginaux, mais un utérus à croissance rapide peut également être un signe de la présence d’un sarcome. L’hystéroscopie, ainsi que des techniques d’imagerie plus poussées comme l’IRM, peuvent donner des indications sur la présence d’un sarcome, mais ne permettent pas de l’exclure. Souvent, les sarcomes sont découverts de manière fortuite lors de myomectomies ou d’hystérectomies, qui comportent un risque de distribution de cellules malignes, ce qui aggrave le pronostic. Une information préalable à toute opération est aujourd’hui la norme. En cas de suspicion clinique, la technique chirurgicale doit être adaptée en conséquence.
Le traitement du léiomyosarcome implique une hystérectomie totale. Une annexectomie et une lymphonectomie pelvienne et paraaortique systématique ne sont pas indiquées en premier lieu en cas de faible présence de métastases dans cette région, sauf si des anomalies peropératoires sont observées [9]. Il n’existe toujours pas de preuves suffisantes pour un traitement adjuvant après une résection R0. Une chimiothérapie adjuvante à la doxorubicine ou une combinaison de gemcitabine et de docétaxel sont des options individuelles sans recommandations claires. Une radiothérapie adjuvante doit être discutée en cas de résection chirurgicale incomplète. Dans les situations métastatiques primaires, la doxorubicine est utilisée. L’administration d’inhibiteurs de l’aromatase peut prolonger la survie sans progression après confirmation de l’expression des récepteurs hormonaux.
Dans le cas du stromasarcome endométrial de bas grade, le pronostic est bon, avec un taux de survie à 5 ans de 80 à 90%. En cas de statut positif des récepteurs hormonaux, celle-ci peut être améliorée par une annexectomie bilatérale ou un traitement endocrinien adjuvant à partir du stade III.
Le sarcome du stroma endométrial de haut grade et les sarcomes utérins indifférenciés ont un mauvais pronostic, avec une survie globale médiane de 1 à 3 ans. Il existe des recommandations thérapeutiques claires pour l’hystérectomie totale avec annexectomie bilatérale. Une radiothérapie percutanée est recommandée aux stades I et II. Il n’existe pas de données suffisantes sur la chimiothérapie ou la thérapie endocrinienne.
Cancer du col de l’utérus
En Suisse, on compte environ 250 nouveaux cas de cancer du col de l’utérus par an. Grâce au dépistage et, à l’avenir, à la vaccination contre le HPV, nous nous attendons à une nouvelle baisse de ces chiffres. Malheureusement, le cancer du col de l’utérus représente encore environ 1% de tous les décès par cancer. Le stade de la tumeur selon la FIGO au moment du diagnostic a une grande influence sur la survie globale à 5 ans. Celui-ci est de 21% au stade IV, et de 95% au stade I. Les facteurs de risque incluent la persistance d’une infection à HPV à haut risque avec d’éventuelles dysplasies cervicales, ainsi qu’une immunosuppression, l’abus de nicotine, une mauvaise hygiène sexuelle, des changements de partenaires sexuels et la prise prolongée de contraceptifs oraux. Cliniquement, cette néoplasie se manifeste également souvent par des saignements (post-coïtaux) typiques ou une modification du flux vaginal.
Le carcinome épidermoïde HPV-dépendant représente jusqu’à 80% des cas de carcinome du col de l’utérus. Les 20% restants se composent en grande partie de carcinomes adénosquameux et d’adénocarcinomes. Les sous-types histologiques plus rares sont les formes mixtes, les carcinomes neuroendocrines, séreux, papillaires et à cellules claires.
Le diagnostic est établi après un frottis cervico-utérin anormal par une confirmation histologique sous la forme d’une biopsie du col de l’utérus ou d’un curetage endocervical. Les conditions locales peuvent être évaluées par échographie transvaginale, échographie rénale pour exclure une hydronéphrose, ainsi que par IRM ou examen sous anesthésie par cystoscopie et/ou rectoscopie. Le PET-CT est utilisé en cas de suspicion primaire de métastases à distance ou en situation de récidive. Le staging clinique primaire du cancer du col de l’utérus a été complété en 2018 dans la classification FIGO actualisée par une combinaison de l’imagerie et de l’atteinte ganglionnaire [10]. Une atteinte ganglionnaire para-aortique ne peut pas être diagnostiquée avec une sensibilité suffisante au moyen du PET-CT, c’est pourquoi le statut ganglionnaire doit être déterminé en premier lieu de manière chirurgicale dans le cadre d’une lymphonectomie sentinelle, qui présente une sensibilité de 91,4% et une spécificité de 100%. En cas de tumeur de stade T1a1 sans invasion lymphovasculaire, d’ablation complète par conisation et de carcinome micro-invasif, la lymphonectomie sentinelle n’est pas nécessaire. Dans ces cas, une simple conisation ou une hystérectomie peut suffire.
La chirurgie ou la radiochimiothérapie peuvent être envisagées comme traitement primaire. Jusqu’à un stade tumoral FIGO IIA, une résection chirurgicale primaire par hystérectomie radicale ouverte est recommandée. L’indication d’une ovariectomie dépend du type histologique et du statut ménopausique.
L’étude prospective randomisée LACC, publiée en 2018, a comparé le résultat après une hystérectomie radicale peu invasive à celui après une laparotomie. Pour une taille de tumeur de ≥2 cm, on a constaté un moins bon résultat en termes d’intervalle sans récidive, un taux plus élevé de récidives locorégionales et également une survie globale significativement plus faible par rapport à l’hystérectomie radicale ouverte. L’étude n’a pas permis de déterminer si les cellules tumorales étaient dispersées par le manipulateur utérin utilisé lors de la laparoscopie ou par l’inflation de CO2 [11].
A partir du stade IIB ou en cas d’atteinte ganglionnaire avérée après une lymphonodectomie para-aortique, la radiochimiothérapie constitue le traitement standard. Une radiothérapie percutanée avec administration simultanée d’une chimiothérapie à base de cisplatine comme radiosensibilisateur est réalisée avant une curiethérapie intravaginale. Les études sur l’hystérectomie pratiquée secondairement après une chimiothérapie néoadjuvante n’ont montré aucun avantage.
Dans des cas sélectionnés, des radiothérapies adjuvantes avec chimiothérapie sont recommandées après un traitement chirurgical primaire. Cela vaut pour les résections R1, les infiltrations paramétriques, les métastases ganglionnaires ainsi que pour les facteurs de risque (L1, V1, G3, taille de la tumeur >4 cm). L’indication d’une curiethérapie vaginale doit être discutée en cas d’infiltration vaginale, de grosses tumeurs ainsi qu’en cas de situation L1 étendue. Le traitement palliatif comprend principalement une chimiothérapie à base de carboplatine et de taxol, associée au bevacizumab. Des inhibiteurs de points de contrôle peuvent également être utilisés dans ce cas.
Conclusion
En résumé, les tumeurs utérines englobent des entités très différentes et sont donc traitées différemment. Un diagnostic précis pour les classer est essentiel. Les marqueurs moléculaires sont de plus en plus importants, à la fois pour la classification des risques et pour l’adaptation des thérapies adjuvantes.
Messages Take-Home
- Les tumeurs utérines comprennent diverses entités dont la prise en charge diffère considérablement. Il est essentiel d’établir un diagnostic précis pour classifier les risques afin de garantir les meilleurs soins possibles.
- L’importance clinique des marqueurs moléculaires augmente de plus en plus, ceux-ci font partie depuis cette année de la classification des risques ESMO-ESGO-ESTRO du cancer de l’endomètre. Les marqueurs moléculaires permettent non seulement une évaluation plus précise du pronostic, mais aussi l’utilisation ciblée de traitements innovants tels que les inhibiteurs de points de contrôle, en particulier pour les tumeurs avancées.
- Le cancer de l’endomètre est l’une des tumeurs malignes gynécologiques les plus fréquentes et est diagnostiqué à 75% en post-ménopause. Il se manifeste généralement par des saignements vaginaux et est favorisé par un excès d’œstrogènes, notamment en cas de traitement au tamoxifène. En cas de saignement post-ménopausique et d’endomètre ≥3 mm, il convient dans tous les cas de réaliser une pipelle ou une hystéroscopie avec curetage pour confirmation histologique.
- Les sarcomes utérins, bien que moins fréquents que les cancers de l’endomètre, sont de moins bon pronostic. La prise de tamoxifène fait également partie des facteurs de risque. Les myomectomies et les hystérectomies comportent un risque de distribution de cellules malignes, c’est pourquoi la technique chirurgicale doit être adaptée en conséquence en cas de suspicion clinique.
- Le pronostic du cancer du col de l’utérus varie considérablement en fonction du stade de la tumeur.
- Dans les stades précoces jusqu’à FIGO IIA, l’hystérectomie radicale ouverte avec ou sans ovariectomie constitue le traitement de premier choix. A partir d’un stade IIB ou en cas d’atteinte ganglionnaire avérée, la radiochimiothérapie est utilisée en premier lieu. Une hystérectomie pratiquée secondairement n’apporte aucun avantage.
Littérature :
- Allen NE, et al : Menopausal hormone therapy and risk of endometrial carcinoma among postmenopausal women in the European Prospective Investigation Into Cancer and Nutrition. Am J Epidemiol. 2010 ; 172(12) : 1394-1403.
- Win AK, Reece JC, Ryan S : Historique familial et risque de cancer de l’endomètre : une revue systématique et une méta-analyse. Obstet Gynecol. 2015 ; 125(1) : 89-98.
- Kandoth C, et al. : Paysage mutationnel et importance de 12 types majeurs de cancer. Nature, 2013 ; 502(7471) : 333-339.
- Morice P, et al : Cancer de l’endomètre. Lancet . 2016 ; 387(10023) : 1094-1108.
- Concin N, et al : ESGO / ESTRO / ESP guidelines for the management of patients with endometrial carcinoma. Virchows Arch. 2021 ; 478(2) : 153-190.
- Rossi EC, et al : A comparison of sentinel lymph node biopsy to lymphadenectomy for endometrial cancer staging (FIRES trial) : a multicentre, prospective, cohort study. Lancet Oncol. 2017 ; 18(3) : 384-92.
- Papadia A, et al : Laparoscopic Indocyanine Green Sentinel Lymph Node Mapping in Endometrial Cancer. Ann Surg Oncol. 2016 ; 23(7) : 2206-2211.
- Imboden S, et al : Oncological safety and perioperative morbidity in low-risk endometrial cancer with sentinel lymph-node dissection. Eur J Surg Oncol. 2019 ; 45(9) : 1638-1643.
- Kapp DS, Shin JY, Chan JK : Facteurs pronostiques et survie chez 1396 patients atteints de léiomyosarcomes utérins : accent sur l’impact de la lymphadénectomie et de l’oophorectomie. Cancer. 2008 ; 112(4) : 820-830.
- Bhatla N, et al : Révision de la classification FIGO pour le carcinome du col de l’utérus. Int J Gynecol Obstet. 2019 ; 145(1) : 129-135.
- Ramirez PT, et al : Hystérectomie radicale mini-invasive versus abdominale pour le cancer du col de l’utérus. N Engl J Med 2018 ; 379(20) : 1895-1904.
InFo ONKOLOGIE & HÉMATOLOGIE 2021 ; 9(3) : 10-13