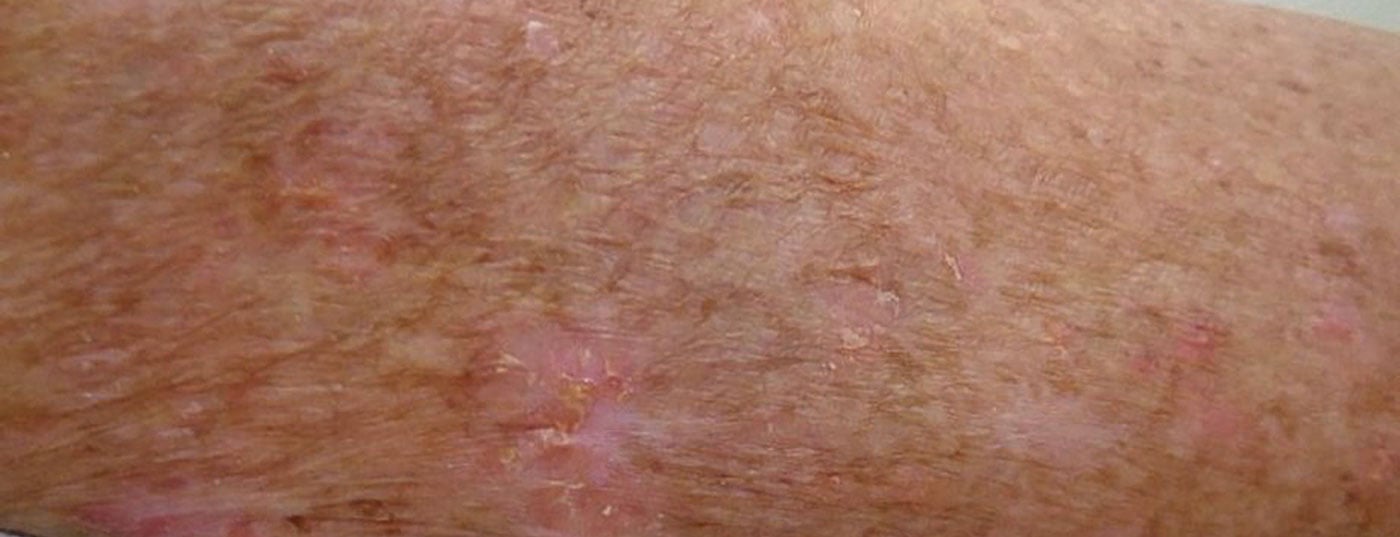
La prévalence des personnes actuellement atteintes de kératose actinique (KA) dans la population augmente avec l’âge. En fonction de l’exposition aux UV, le développement des AK est pertinent à partir de 40 ans. En Australie, jusqu’à 60% de cette tranche d’âge est touchée, alors que sous les latitudes européennes, on estime que 15 à 30% sont concernés. On peut s’attendre à un nombre de 70% de patients atteints d’AK à l’âge de 70 ans, le spectre allant de l’AK isolé à la carcinogenèse de terrain.
La prévalence, c’est-à-dire le taux de personnes actuellement atteintes dans la population, augmente avec l’âge. En fonction de l’exposition aux UV, le développement de kératoses actiniques (KA) est pertinent à partir de l’âge de 40 ans. En Australie, jusqu’à 60% de cette tranche d’âge est touchée, alors que sous les latitudes européennes, on estime que 15-30% sont concernés [1]. On peut s’attendre à un nombre de 70% de patients atteints d’AK à l’âge de 70 ans, le spectre allant de l’AK isolé à la carcinogenèse de terrain.
L’incidence, qui mesure le nombre de nouveaux cas en une année, est estimée par l’Institut Robert Koch à 229 750 nouveaux cas en 2016. La fréquence de la maladie chez 2844 patients vus consécutivement dans des cabinets de médecins généralistes suisses était de 25% [2]. La CA fait donc partie des diagnostics les plus fréquents en dermatologie et engage les patients et les médecins dans un partenariat de traitement. Dans ce contexte, l’éducation, la prévention, les thérapies ciblées sont nécessaires.
Pathogenèse
La lésion des kératinocytes de l’épiderme due aux UV est fondamentale. Les types de peau I et II favorisent constitutionnellement le développement des AK. Les autres prédispositions acquises sont les coups de soleil dans l’enfance et l’exposition cumulative aux UV. Les dommages moléculaires possibles liés aux UV sont expliqués dans une revue récente [1].
Les causes génétiques identifiées à ce jour sont les mutations de p53 et les mutations de l’oncogène Ras. p53 est actif dans le contrôle du cycle cellulaire. Les mutations de p53 empêchent l’apoptose nécessaire. L’implication de p53 dans la genèse des AK est supposée dans jusqu’à 80% des cas. L’immunosuppression, qu’elle soit d’origine médicamenteuse ou non, contribue également à l’augmentation de l’incidence des AC.
Dans une étude récente utilisant le séquençage de nouvelle génération, les papillomavirus bêta-humains (HPV), qui avaient été précédemment mis en évidence, n’ont pas montré d’importance significative dans les AK par rapport à la peau normale, mais les types Gamma1-HPV4 étaient nettement plus abondants dans les AK. Les conclusions sur la persistance du virus, les variations même de nouveaux types d’HPV, entre autres, en fonction de la localisation sont encore insuffisantes.
La prise d’hydrochlorothiazide a démontré un risque 1,2 fois plus élevé de carcinome basocellulaire (BCC) et un risque 4 fois plus élevé de carcinome épidermoïde (PEK). Une étude cas-témoins portant sur 400 patients atteints de maladies cardiovasculaires n’a pas montré de corrélation entre les AC et les diurétiques thiazidiques [3].
Classifications
La classification clinique d’Olsen, généralement utilisée, existe depuis 1991. Elle est utilisée dans les études et également dans les lignes directrices.
- Olsen grade I : léger – AK à peine visible et faiblement palpable,
- Olsen grade II : modéré – AK bien visible et palpable,
- Olsen grade III : AK fortement – clairement visible et fortement hyperkératosique [4].
La classification clinico-histologique et histologique de Cockerell et al. est également intéressante. 2000 et par Röwert-Huber et al. 2007 [5,6].
Cependant, l’absence actuelle d’une classification efficace se traduit notamment par des modifications spécifiques à chaque pays, comme la classification AK de la British Association of Dermatologists :
- AK grade 1 doux – patch à desquamation minimale,
- Grade 2 modéré – patch modérément écailleux,
- Grade 3 fort – lésion hyperkératosique.
Il est essentiel de reconnaître que les résultats cliniques et l’histologie correspondante ne sont pas nécessairement corrélés, c’est-à-dire qu’une augmentation des résultats cliniques ne correspond pas nécessairement à une augmentation du potentiel malin, par exemple en termes d’invasivité. Un autre point essentiel concernant la clinique et l’histologie est important : dans le cas d’une cancérologie de terrain, la biopsie d’une CA incluse ne doit pas être considérée comme représentative de l’environnement. C’est pourquoi les travaux actuels se tournent de plus en plus vers un traitement histologique des éventuels critères pronostiques pertinents. Travaux de Dirschka et al. sur le modèle de croissance des kératinocytes atypiques confirment le potentiel invasif des AK même initiales (grade I selon Olsen) [9].
Qu’est-ce que cela signifie pour le médecin traitant ? L’évaluation clinique primaire est toujours d’actualité. Les biopsies doivent être réalisées en urgence en cas d’incertitude ou de progression rapide d’une lésion. À l’heure actuelle, il existe une indication pour un traitement précoce et à grande échelle de tous les AK. Seule une meilleure évaluation et un pronostic scientifiquement fondé peuvent permettre de mieux cibler le traitement. Dans le cas des AK existants, l’objectif principal est d’éviter la progression vers un PEK invasif.
Prévention
La prévention primaire vise à empêcher l’apparition d’une AK. Dans le comportement individuel, cela signifie éviter les risques personnels. Mais il faut également s’adresser aux modifications de l’environnement qui peuvent être impliquées dans le développement de la maladie. Les actions associées comprennent par exemple la protection solaire dans les jardins d’enfants ou l’interdiction d’utiliser un solarium pour les moins de 18 ans (le 01.06.19, l’ordonnance relative à la loi fédérale sur la protection contre les dangers liés aux rayonnements non ionisants et au son, RS 814.711, est entrée en vigueur).
La prévention secondaire est axée sur le diagnostic précoce des AK. Des conseils aux patients et des thérapies rapides doivent permettre de guérir ou d’atténuer l’évolution de la maladie. Les examens de dépistage sont une possibilité. En Suisse, un dépistage gratuit du cancer de la peau est proposé tous les deux ans aux assurés à partir de 35 ans. Même si les AK ne font pas partie intégrante du dépistage du cancer de la peau, les taux de réussite sont élevés, en particulier dans les groupes de personnes âgées.
En ce qui concerne l’apparition possible de l’EPC, il convient de mentionner la prévention tertiaire en tant que pilier diagnostique et thérapie visant à éviter les séquelles. En cas d’AK multiples, le risque de développer un carcinome épidermoïde (CEP) au cours de la vie est évalué à 6-10% sur une période de 10 ans.
En ce qui concerne la pathogenèse, la protection solaire précoce et systématique est à privilégier. Une protection textile contre le soleil (couvre-chef, lunettes, vêtements) et l’utilisation adéquate de produits de protection contre les UV, qui doivent inclure une protection contre les UVA et les UVB, sont nécessaires. Les vêtements plus denses peuvent offrir un UV Protection Factor de 50, ce qui signifie que <1/50 des rayons UV passent, au maximum 2%. Pour une utilisation correcte des produits de protection contre les UV, il convient d’insister sur une application en temps voulu et sur une application suffisamment épaisse, uniforme et répétée. La durée de séjour autorisée calculable en fonction du type de peau ne peut donc pas être prolongée.
L’acceptation de la protection solaire augmente certes avec l’âge et précisément après la constatation des premiers dommages causés par les UV, mais elle peut être améliorée dans l’ensemble et en particulier chez les jeunes. Des campagnes régulières de protection solaire sont initiées en Suisse par la Ligue contre le cancer. Des brochures et de courtes vidéos informent sur les dangers d’une exposition excessive au soleil et sur les recommandations en matière de protection solaire. Par ailleurs, la campagne nationale contre le cancer de la peau, organisée par la Société suisse de dermatologie et de vénéréologie (SSDV), a lieu chaque année depuis 2006. Il s’agit notamment de sensibiliser la population à une protection solaire conséquente et à des examens de dépistage précoce.
En cas de risque élevé de cancer de la peau, par exemple chez les patients transplantés, il convient de déterminer le taux de vitamine D et, le cas échéant, de l’augmenter. peuvent être substitués. Une production suffisante de vitamine D a lieu lors d’une exposition modérée au soleil dans la vie quotidienne d’environ 20-25% du corps (par ex. visage, mains et bras) pendant au moins 5 minutes environ 2-3×/semaine [7].
La prévention par d’autres moyens tels que le sélénium, la vitamine A et le bêta-carotène ne sont pas recommandés comme mesures de prévention du cancer de la peau. La nicotinamide peut être utilisée à titre préventif, notamment pour le BCC et le PEK, chez les patients ayant déjà souffert d’un cancer de la peau non mélanique (NMSC) et chez les patients ayant subi une transplantation d’organe. Les études sur la caféine, en tant que facteur protecteur, et sur la nicotine et l’alcool, en tant que facteurs négatifs, ne sont pas convaincantes.
Clinique
Le spectre des lésions va d’une petite macule rouge, d’une kératose fixe peu ou nettement superposée, de lésions pigmentées, croûteuses ou atrophiques, jusqu’à une carcinose de terrain (figure 1). Cette dernière se caractérise par de multiples AK entourées de lésions cutanées visibles dues aux UV, avec notamment une peau tachée de rouge-brun-blanc et partiellement atrophique. Il n’existe cependant pas de définition commune de la cancérologie de terrain.
Les AK apparaissent principalement dans les zones de la peau exposées aux UV, comme le dessus du crâne sans cheveux, le front, les joues, le nez ou les oreilles (“terrasses solaires”). Mais on trouve également des AK dans le décolleté, le cou et les extrémités.
Diagnostic
Le diagnostic de l’AK est avant tout clinique, visuel et palpatoire. La dermatoscopie permet de mettre en évidence des signes caractéristiques. Des points blancs disposés en périfolliculaires selon un motif en trèfle sont décrits comme des “signes de rosette”. Le motif “strawberry” est typique d’une AK non pigmentée, caractérisé par des ouvertures folliculaires avec un bouchon kératosique entouré d’un pseudo-réseau rougeâtre. Les AK pigmentées présentent un pseudo-réseau brun à gris composé de multiples points ou sphères bruns à gris disposés autour des orifices folliculaires. La progression vers un CPE peut se manifester par des kératoses rugueuses et de minuscules inclusions croûteuses.
La microscopie confocale à balayage laser est une technique d’imagerie diagnostique qui permet, de manière non invasive, l’évaluation microscopique des couches supérieures de la peau avec une profondeur de pénétration d’environ 300 µm au moyen d’une source lumineuse ponctuelle monochromatique. Les AK se caractérisent par une perte de la structure normale en nid d’abeille avec atypies et pléomorphisme des kératinocytes épidermiques, parakératose et dilatation des vaisseaux sanguins. Dans certains cas, les hyperkératoses compactes surjacentes peuvent rendre l’analyse des structures profondes beaucoup plus difficile, ce qui peut limiter le diagnostic des carcinomes épidermoïdes invasifs.
Une autre technique d’imagerie est la tomographie par cohérence optique, qui utilise des rayons électromagnétiques dans le proche infrarouge (700-1300 nm). Il s’agit de créer des images de coupe en profondeur avec une profondeur de pénétration d’environ 1,5-2,6 mm et, en même temps, des images horizontales. Les AK présentent une acanthose avec une zone de jonction bien préservée. Dans les carcinomes épidermoïdes invasifs, la stratification régulière de l’épiderme est abolie et la zone de jonction ne peut plus être clairement délimitée. Une hyperkératose importante peut également conduire à des limitations du diagnostic. Les premières tentatives de consultation virtuelle sur la CA ont été publiées. Après avoir donné au patient des conseils critiques et des instructions sur la CA, des clichés d’ensemble et des clichés rapprochés réguliers constituent une base pour une éventuelle prise en charge [8].
Thérapie
L’indication du traitement de l’AC doit être posée en tenant compte du tableau clinique, des facteurs de risque, des comorbidités, de l’espérance de vie, du souhait du patient et de l’observance. Le score AKASI peut être utilisé pour la classification clinique de la gravité et l’objectivation des résultats du traitement de l’AK au niveau de la tête [9].
La dernière “ligne directrice S3 sur la kératose actinique et le carcinome épidermoïde de la peau” offre un aperçu des options de traitement approuvées, des indications et des paramètres d’utilisation [10]. Deux grands blocs sont à considérer : les procédures non invasives et les procédures invasives / mécano-destructives. En ce qui concerne les patients transplantés immunodéprimés et les patients atteints de maladies professionnelles, des critères de traitement modifiés, qui ne sont pas présentés ici, apparaissent [10].
Procédures non invasives
Procédures topiques à base de médicaments
Pour une évaluation individuelle, les critères de décision et les recommandations possibles de la ligne directrice sont brièvement décrits ci-dessous. En ce qui concerne les mécanismes d’action et les effets secondaires, nous vous invitons à consulter la littérature actuelle disponible en ligne (tableau 1) [11].
3% de diclofénac dans 2,5% d’acide hyaluronique peut être utilisé sur des surfaces plus importantes à chaque fois sur l’ensemble du corps. L’avantage de cette option de traitement est qu’elle présente un faible spectre d’effets secondaires. Une utilisation 2× par jour pendant 60-90 jours jusqu’à un maximum de 8g par jour est possible. Selon les lignes directrices, 3% de diclofénac dans 2,5% d’acide hyaluronique doit être proposé pour les AK uniques ou multiples de grade I-II selon Olsen chez les patients immunocompétents ou en cas de carcinose de terrain [10]. Le taux de réponse varie entre 25% et 89%, en fonction des résultats cliniques. En cas d’évolution sur plusieurs années, cette option de traitement a souvent déjà été utilisée, de sorte que d’autres options doivent être envisagées.
La crème 5-fluorouracile 5% doit être proposée pour le traitement des AK uniques et multiples de grade I-II selon la ligne directrice d’Olsen. Un traitement ciblé sur le terrain avec la crème 5-fluorouracil 5% peut être utilisé en cas de carcinose de terrain [10]. 5% de 5-FU en application biquotidienne pendant 2 à 4 semaines peut provoquer des effets secondaires tels que des rougeurs, des démangeaisons, des brûlures, des érosions, des ulcérations et des croûtes. Des réactions locales plus fortes sont plutôt observées dans les peaux atrophiées dues au vieillissement ou à la prise d’anticoagulants. Des études ont démontré un très bon taux de réponse et des résultats à long terme, y compris en termes de récidives [12]. Les taux de réponse présentent une large fourchette, allant de 38% à 96%.
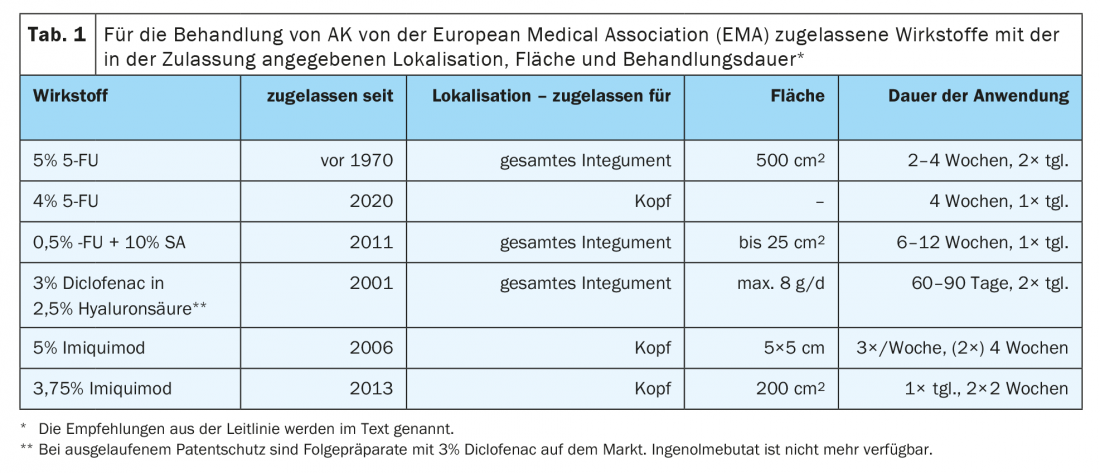
4% Le 5-FU est également autorisé pour la tête et est utilisé pour les AK de grade I-II. Avec une efficacité comparable à celle du 5-FU à 5%, l’utilisation n’est qu’une fois par jour et promet des effets secondaires moins prononcés, ce qui conduit à une meilleure adhésion du patient au traitement [13]. 0,5% de 5-FU avec 10% de SA a été approuvé en premier lieu pour le traitement lésionnel des AK. En post-autorisation, pour les AK de grade I et II, la comparaison avec un traitement par placebo dans le cadre des thérapies ciblées sur le terrain montre une guérison complète de 75% des lésions après 8 semaines et une guérison complète dans 50% des cas. La durée du traitement est généralement de 6 à 12 semaines. 0,5% FU avec 10% SA doit être appliqué quotidiennement à l’aide d’un pinceau. Il forme un film à peine visible et s’accompagne d’une bonne tolérance.
L’imiquimod est autorisé pour une utilisation au niveau de la tête. 3,75% L’imiquimod présente ici une réponse fiable et durable, notamment en cas de réaction nettement inflammatoire. Les effets secondaires typiques sont le prurit, la douleur locale et la formation de croûtes. C’est pourquoi des intervalles thérapeutiques plus courts ont été établis avec un rythme “2 on – 2 off – 2 on”. Cela signifie une application 1× par jour pendant 2 semaines et, après une pause de 2 semaines, une nouvelle application pendant 2 semaines. Cela se traduit par une bonne adhésion des patients au traitement lorsqu’il est utilisé de manière adaptée aux effets secondaires. Selon les lignes directrices, la crème Imiquimod 3,75% doit être proposée sur le terrain pour les AK multiples de grade I-II selon Olsen, ainsi qu’en cas de carcinose sur le terrain chez les personnes immunocompétentes au niveau du visage ou des capillaires non poilus [10]. Les taux de réponse varient entre 34% et 82%.
Le traitement de l’AK avec 5% d’imiquimod est possible, mais en termes de fréquence de traitement, il est passé derrière la concentration de 3,75% d’imiquimod en raison d’effets secondaires plus importants. L’utilisation dans le cadre d’un traitement combiné du BCC superficiaire, pour lequel 5% d’imiquimod est autorisé, et des AK existants reste à envisager.
La PDT est basée sur la conversion de l’acide 5-aminolévulinique (5-ALA) et de l’acide méthylaminolévulinique (MAL) en un métabolite photoactif, la protoporphyrine IX, qui s’accumule dans les cellules néoplasiques et est activée par la lumière. Il en résulte la formation d’espèces acides réactives qui induisent notamment l’apoptose. Différents types d’agents externes et de sources lumineuses sont disponibles pour la PDT. La ligne directrice résume : Une thérapie photodynamique conventionnelle avec l’acide 5-aminolévulinique ou son ester méthylique (5-ALA ou MAL) doit être proposée sur le terrain pour les AK uniques ou multiples de grade I-II selon Olsen et en cas de carcinose sur le terrain [10].
La crème contenant du MAL peut être utilisée en tant que médicament prêt à l’emploi et doit être appliquée sur la zone à traiter avec une épaisseur de 1 mm. Après 3 heures d’occlusion, l’irradiation à 570-670 nm (75 J/cm2) ou alternativement à 630 nm (37 J/cm2) est réalisable. Si l’AK n’est pas complètement guérie, une nouvelle application peut avoir lieu après 12 semaines. L’ALA est disponible sous forme de patch et de gel contenant une nanoémulsion d’ALA (BF-200 ALA). Jusqu’à 6 patchs ALA de 4 cm2 peuvent être utilisés simultanément. Ils peuvent être utilisés pour des AK uniques ou multiples. Quatre heures après l’incubation, on procède à l’exposition à une lampe à lumière rouge à spectre étroit (630 nm).
Le gel BF-200 ALA est approuvé pour les lésions et le champ. Le tube de 2 g suffit pour une application de 1 mm d’épaisseur sur une zone de 20 cm2. Après 3 heures d’occlusion, on procède à l’irradiation avec une lampe rouge à large spectre ou à spectre étroit. BF-200 ALA est également approuvé pour une utilisation sur les extrémités, le tronc et le cou depuis 03/2020. Formulé par Swiss medic en 2018, l’utilisation de BF-200 ALA est la suivante : “Traitement des kératoses actiniques (KA) d’intensité légère à modérée sur le visage et le cuir chevelu (grade I-II selon Olsen) et des carcinoses de terrain chez l’adulte”. Une combinaison de la PDT avec des thérapies locales, d’une part dans le sens d’une desquamation et d’une kératolyse ou d’autre part dans le sens thérapeutique avec l’imiquimod ou le 5-FU, peut améliorer l’efficacité.
La PDT à la lumière du jour peut être utilisée aussi bien avec une crème contenant du MAL qu’avec le gel BF-200 ALA. La diminution de la douleur lors d’un tel traitement est due à l’afflux plus lent de protoporphyrine IX avec un temps d’incubation plus court (<30 minutes) et une exposition subséquente (2 heures). Le MAL en combinaison avec la lumière du jour (MAL-PDT en lumière du jour) doit être proposé sur le terrain pour les AK non pigmentés, uniques ou multiples, de grade I-II selon Olsen, ainsi que pour les carcinomes du champ sur le visage et les capillaires chez les personnes immunocompétentes [10]. La nouveauté est la PDT à la lumière du jour à domicile, dans laquelle les patients appliquent eux-mêmes le photosensibilisateur et s’exposent ensuite à la lumière du jour.
Les méta-analyses servent en quelque sorte à classer les thérapies : Les succès thérapeutiques ont montré le taux de guérison le plus élevé pour le BF-200 ALA avec 75,8%, suivi par 5% de 5-FU avec 59,9%, les patchs ALA avec 56,8%, 5% d’imiquimod avec 56,3%, 3,75% d’imiquimod avec 39,9% et 3% de diclofénac dans 2,5% d’acide hyaluronique avec 24,7% [14]. Dans une autre méta-analyse, la PDT a également montré le plus grand succès en termes de guérison, suivie par 5% de 5-FU, 5% d’imiquimod et 3% de diclofénac dans 2,5% d’acide hyaluronique [8].
Procédures invasives et mécaniques
La cryochirurgie est une procédure très répandue, souvent combinée à des thérapies locales ou à la PDT. Avec de l’azote liquide de -196 ˚C, on vise une température de -25˚C dans la zone cutanée traitée par tampon de contact ou par pulvérisation. Ceci est généralement obtenu par une application de 15 à 60 secondes et 2 fois le temps de givrage. Toutefois, des normes claires ne sont pas établies. Elle est recommandée en fonction des lésions pour les AK uniques ou multiples de grade I-III selon Olsen chez les personnes immunocompétentes [10]. Il n’est pas rare qu’elle laisse des zones de peau hypopigmentées, de sorte que les considérations esthétiques peuvent également être prises en compte en fonction de l’âge et de l’évolution de la maladie.
Le domaine des procédures chirurgicales est plutôt celui des CA disséminées, en particulier celles qui sont plus étendues. La ligne directrice recommande l’ablation chirurgicale des AK de grade I-III selon Olsen pour des lésions isolées, aussi bien chez les patients immunocompétents que chez les patients immunodéprimés, par exemple par curetage, par ablation à plat ou par excision complète [10]. L’un des avantages de cette méthode est qu’elle permet de confirmer le diagnostic en même temps. Une mise en garde est faite contre l’excision du shave et la détection insuffisante des structures profondes. Comparées aux procédures non invasives, ces méthodes sont moins bien notées sur le plan esthétique, ne serait-ce qu’en raison de l’apparition de cicatrices.
Les procédures au laser sont volontiers utilisées en raison de leur bonne faisabilité et doivent être proposées, selon les lignes directrices, pour les AK uniques ou multiples de grade I-III selon Olsen, ainsi qu’en cas de cancérogénèse de terrain chez les patients immunocompétents. Les AK peuvent être éliminés rapidement et de manière ciblée à l’aide d’unlaser Er:YAG ouCO2. Il est recommandé de procéder à un examen histologique complémentaire et de réaliser une documentation photographique. Une thérapie au laser suivie d’un traitement local, par exemple avec 5% de 5-FU, permet une meilleure pénétration du médicament [15].
Un résumé intéressant de Steeb et al. se penche sur la question “The more the better ?” Il a été démontré qu’une thérapie combinée peut augmenter l’efficacité du succès thérapeutique. En particulier, il peut être utile de combiner une thérapie orientée vers les lésions et une thérapie orientée vers le champ. Une augmentation significative du succès est encore soumise à la critique sans études supplémentaires [16].
Développements
La tibanibuline est une nouvelle molécule de synthèse qui a reçu l’approbation de la FDA pour les AK de la tête depuis décembre 2020. La polymérisation de la tubuline est inhibée. Viennent ensuite l’arrêt du cycle cellulaire (phase G2/M) et l’apoptose. Dans deux études de phase III contrôlées par placebo, des taux de réponse complète de 44% et 54% sont rapportés au 57e jour, ce qui est significativement meilleur que l’effet placebo (5%, 13%) [17]. 1% de tibanibuline est appliqué localement sur environ 25 cm2 une fois par jour pendant 5 jours. Au jour 8, on observe un érythème, une desquamation, un prurit et une douleur, d’intensité légère à modérée et rapidement régressifs.
Dans le groupe des flavonoïdes, sous-groupe des polyphénols et appartenant aux catéchines, le développement d’une sinécatéchine (extrait de thé vert) pour le traitement de l’AK est en cours. Comme approche thérapeutique causale, on peut citer les effets antioxydants, anti-inflammatoires et anticarcinogènes des catéchines. L’effet antiprolifératif sur les kératinocytes, y compris dans le cadre d’une photocarcinogenèse, a été démontré [18]. Les données thérapeutiques fondées sur des preuves pour les AK doivent encore être générées.
Quatre autres substances sont nommées dans un développement potentiel pour le traitement de l’AK [19]: Le dobésilate de potassium a un effet anti-inflammatoire, anti-angiogénique et anti-tumoral en tant qu’inhibiteur des signaux du FGF et de la synthèse des prostaglandines. Des taux de réponse d’environ 60% pour les AK ont été publiés dans une étude de phase II plus ancienne. Le tuvatexib est un modulateur de l’hexokinase 2 Comp-1. L’interaction avec l’hexokinase au niveau des mitochondries entraîne l’apoptose. Comme le 5-FU, le paclitaxel a été annoncé comme médicament de chimiothérapie à usage local. Il se lie à la β-tubuline et inhibe le cytosquelette. Il existe une “preuve de principe” pour le paclitaxel, sous forme de particules submicroniques à usage local, ainsi que pour le “furosémide plus digoxine”, mais sans qu’aucune autre étude n’ait été menée sur les AC.
Résumé
Les kératoses actiniques (KA) restent un sujet d’avenir en raison d’une incidence toujours croissante. En ce qui concerne les évolutions chroniques de la maladie, le patient vieillissant nécessitant une prise en charge thérapeutique à long terme, l’information précoce et la prévention primaire et secondaire gagnent en importance.
Les développements actuels concernant la pathogenèse, l’évaluation des risques, l’évaluation critique des classifications, les mesures préventives et le diagnostic sont esquissés. Les options et concepts thérapeutiques sont décrits sur la base du guide S3 “Kératose actinique et carcinome épidermoïde” de la peau. La situation actuelle ainsi que les thérapies futures possibles sont présentées.
Messages Take-Home
- Le diagnostic de l’AK est avant tout clinique.
- La notion de cancérogénèse de terrain ne repose pas actuellement sur une définition claire.
- Les gradings AK précédents ne sont pas corrélés de manière fiable avec le risque d’invasivité.
- L’indication du traitement dépend de nombreux critères individuels et sert, outre la rémission, à éviter la progression ainsi que le développement de CPE.
- La prévention et les thérapies sont établies sur une large base, comme les lignes directrices et les mesures de politique de santé.
Littérature :
- Reinehr CPH, Bakos RM : Actinic keratoses : review of clinical, dermoscopic, and therapeutic aspects. An Bras Dermatol 2019 Nov-Dec ; 94(6) : 637-657 ; doi : 10.1016/j.abd.2019.10.004.
- Dziunycz PJ, Schuller E, Hofbauer GFL : Prevalence of Actinic Keratosis in Patients Attendant General Practitioners in Switzerland. Dermatology 2018 ; 234(5-6) : 214-219 ; doi : 10.1159/000491820.
- Warszawik-Hendzel O, Olszewska M, Rakowska A, et al. : Cardiovascular Drug Use and Risk of Actinic Keratosis : A Case-Control Study. Dermatol Ther 2020 ; 10 : 735-743 ; doi : 10.1007/s13555-020-00405-8.
- Olsen EA, Abernethy ML, Kulp-Shorten C, et al : A double-blind, vehicle-controlled study evaluating masoprocol cream in the treatment of actinic keratoses on the head and neck. J Am Acad Dermatol 1991 May ; 24(5 Pt 1) : 738-743 ; doi : 10.1016/0190-9622(91)70113-g.
- Cockerell CJ. : Histopathologie du carcinome spinocellulaire intraépidermique incipient (“kératose actinique”). J Am Acad Dermatol 2000 Jan ; 42(1 Pt 2) : 11-17 ; doi : 10.1067/mjd.2000.103344.
- Röwert-Huber J, Patel MJ, Forschner T, et al : La kératose actinique est un carcinome spinocellulaire in situ précoce : une proposition de reclassification. Br J Dermatol 2007 May ; 156 Suppl 3 : 8-12 ; doi : 10.1111/j.1365-2133.2007.07860.x. Erratum in : Br J Dermatol 2007 Aug ; 157(2) : 431.
- Holick MF : Vitamine D : une perspective de santé D-Lightful. Nutr Rev 2008 Oct ; 66(10 Suppl 2) : S182-194 ; doi : 10.1111/j.1753-4887.2008.00104.x.
- Dhariwal S, Hari T, Kaur K, et al : Consultation virtuelle pour la kératose actinique. BJGP Open 2020 Oct 27 ; 4(4) : bjgpopen20X101126 ; doi : 10.3399/bjgpopen20X101126.
- Dirschka T, Pellacani G, Micali G, et al : A proposed scoring system for assessing the severity of actinic keratosis on the head : actinic keratosis area and severity index. J Eur Acad Dermatol Venereol 2017 Aug ; 31(8) : 1295-1302 ; doi : 10.1111/jdv.14267.
- Programme de lignes directrices en oncologie. Lignes directrices S3 sur la kératose actinique et le carcinome épidermoïde de la peau 2019. Numéro d’enregistrement AWMF:032/0220L, www.leitlinienprogramm-onkologie.de/leitlinien/aktinische-keratosen-und-plattenepithelkarzinom-der-haut.
- Nashan D, Hüning S, Heppt MV, et al : Kératoses actiniques : lignes directrices actuelles et recommandations pratiques. Hautarzt 2020 ; 71 : 463-475.
- Walker JL, Siegel JA, Sachar M, et al : 5-Fluorouracil for Actinic Keratosis Treatment and Chemoprevention : A Randomized Controlled Trial. J Invest Dermatol 2017 Jun ; 137(6) : 1367-1370 ; doi : 10.1016/j.jid.2016.12.029.
- Dohil MA : Efficacité, sécurité et tolérance de la crème 5-fluorouracile à 4% dans une nouvelle crème aqueuse brevetée contenant de l’huile de noix de pécan une fois par jour par rapport à la crème 5-fluorouracile à 5% deux fois par jour : Relever le défi dans le traitement de la kératose actinique. J Drugs Dermatol 2016 Oct 1 ; 15(10) : 1218-1224.
- Vegter S, Tolley K : A network meta-analysis of the relative efficacy of treatments for actinic keratosis of the face or scalp in Europe. PLoS One 2014 Jun 3 ; 9(6) : e96829 ; doi : 10.1371/journal.pone.0096829.
- Nguyen BT, Gan SD, Konnikov N, Liang CA : Traitement des carcinomes basocellulaires superficiels et des carcinomes épidermoïdes in situ sur le tronc et les extrémités par application ablative fractionnée assistée par laser de fluorouracile topique. J Am Acad Dermatol 2015 Mar ; 72(3) : 558-560 ; doi : 10.1016/j.jaad.2014.11.033.
- Steeb T, Wessely A, Leiter U, et al : The more the better ? An appraisal of combination therapies for actinic keratosis. J Eur Acad Dermatol Venereol 2020 Apr ; 34(4) : 727-732 ; doi : 10.1111/jdv.15998.
- Kempers S, DuBois J, Forman S, et al : Tirbanibulin Ointment 1% as a Novel Treatment for Actinic Keratosis : Phase 1 and 2 Results. J Drugs Dermatol 2020 Nov 1 ; 19(11) : 1093-1100.
- Zink A, Traidl-Hoffmann C, et al. : Green tea in dermatology – myths and facts. J Dtsch Dermatol Ges 2015 Aug ; 13(8) : 768-775.
- Cramer P, Stockfleth E, et al : Actinic keratosis : where do we stand and where is the future going to take us ? Expert Opin Emerg Drugs 2020 Mar ; 25(1) : 49-58.
DERMATOLOGIE PRAXIS 2021 ; 31(2) : xx-xx