La neutropénie est un invité fréquent dans les cabinets médicaux en tant que pathologie à part entière, mais aussi en tant que symptôme associé à de nombreuses maladies et en tant qu’effet indésirable d’un médicament. La sensibilité aux infections qui en découle peut représenter un défi dans de nombreux cas. Une bonne gestion permet d’éviter des conséquences dangereuses.
La neutropénie est un invité fréquent dans les cabinets d’hématologie et d’oncologie, en tant que pathologie à part entière, mais aussi en tant que symptôme associé à de nombreuses maladies et en tant qu’effet indésirable de médicaments. La sensibilité aux infections qui en découle peut représenter un défi dans de nombreux cas. Cela s’explique notamment par l’étendue du spectre clinique. De la situation d’urgence de la neutropénie fébrile à la forme chronique souvent inoffensive, tout est représenté. Pour une prise en charge optimale, il est donc important de connaître la cause de la neutropénie.
Degrés de gravité de la neutropénie
L’approche thérapeutique diffère également en fonction de la gravité et donc du risque d’infection. Par forme légère, on entend un nombre absolu de neutrophiles (absolute neutrophil count, ANC) compris entre 1000 et 1500 cellules par microlitre. Une neutropénie modérée correspond à des ANC compris entre 500 et 1000 cellules par microlitre et une neutropénie/agranulocytose sévère à des ANC inférieurs à 500 cellules par microlitre (tableau 1).
Alors que les formes légères ne nécessitent souvent aucun traitement, la fièvre et l’agranulocytose nécessitent l’utilisation immédiate et empirique d’antibiotiques à large spectre et, le cas échéant, de facteurs de stimulation des colonies de granulocytes (G-CSF) [1–3].

Toutes les neutropénies ne se valent pas
Pour caractériser la neutropénie, il est important de connaître non seulement sa sévérité, mais aussi son évolution. Ainsi, on distingue en principe les formes aiguës et chroniques. La dynamique temporelle, les prises de médicaments antérieures et les infections subies, ainsi que les antécédents familiaux, peuvent fournir des informations sur le mécanisme sous-jacent. Il existe des formes primaires et secondaires de neutropénie (tableau 1). Les neutropénies primaires sont beaucoup plus rares que les neutropénies d’origine extrinsèque. Cependant, ils doivent être envisagés, en particulier chez les jeunes patients, les cas chroniques depuis l’enfance et les antécédents familiaux positifs [2–4].

La neutropénie idiopathique chronique est l’une des neutropénies primaires les plus courantes. Les femmes sont les plus touchées. Avec une durée d’au moins trois mois, il s’agit d’un diagnostic d’exclusion. En conséquence, il ne doit pas y avoir de cause génétique, infectieuse, inflammatoire, auto-immune, maligne ou médicamenteuse. Bien qu’il existe une sensibilité accrue aux infections bactériennes, la maladie a généralement une évolution bénigne. Un traitement par G-CSF n’est pas toujours nécessaire et n’est pas recommandé lorsque les ANC sont supérieurs à 500 cellules/µl et qu’il n’y a pas d’infections récurrentes [5]. Elle doit être évaluée individuellement. Jusqu’à présent, aucune cause n’a pu être trouvée pour expliquer les grandes différences individuelles en matière de sensibilité aux infections.
De même, la neutropénie ethnique bénigne, qui touche principalement les personnes d’origine africaine et méditerranéenne, n’a généralement pas de conséquences cliniques, ou alors une évolution bénigne [6]. C’est également le cas de la neutropénie familiale bénigne, clairement génétique mais indépendante de l’ethnie [2]. Alors que la base génétique de la neutropénie familiale bénigne n’est pas connue, la neutropénie ethnique bénigne est associée à des variantes du récepteur de l’antigène de Duffy [7,8].
Un autre exemple de neutropénie congénitale généralement légère est la neutropénie cyclique. Il s’agit d’un trouble héréditaire autosomique dominant, souvent associé à des mutations dans le gène ELANE [9]. Elle se caractérise par des fluctuations périodiques du nombre de neutrophiles avec une période d’oscillation d’environ 21 jours. Pendant le nadir, certaines personnes souffrent d’aphtes oraux ou d’autres infections, mais dans l’ensemble, l’évolution est généralement bénigne [2].
En revanche, le syndrome de Kostmann, également connu sous le nom de neutropénie congénitale sévère (NCS), est une maladie qui entraîne une forte sensibilité aux infections dès l’enfance et augmente le risque de développer une leucémie myéloïde aiguë [10]. Une neutropénie persistante chez les enfants, les adolescents ou les jeunes adultes peut être le signe d’une insuffisance de la moelle osseuse sous-jacente. Dans de tels cas, une évaluation plus approfondie par des experts spécialisés est recommandée.
Si les neutropénies congénitales et idiopathiques ne sont pas à négliger dans le bilan des causes, une neutropénie isolée est dans la plupart des cas acquise. Différents médicaments, des maladies de la moelle osseuse, des carences, des infections et des processus immunologiques peuvent être considérés comme des déclencheurs.
Un phénomène courant : la neutropénie médicamenteuse
La plus grande partie des neutropénies sont dues à des médicaments [1,11–13]. L’incidence des agranulocytoses iatrogènes est d’environ 1 à 5 par million d’habitants par an, avec un taux de mortalité d’environ 5% [1,14]. Il existe typiquement une association temporelle avec le traitement médicamenteux. En principe, de nombreux médicaments peuvent provoquer des neutropénies par deux mécanismes différents, mais plus de la moitié des cas sont déclenchés par un petit nombre de substances actives (aperçu 2) [11–16,22]. D’une part, les anticorps induits par le médicament peuvent entraîner une destruction immuno-médiée des granulocytes neutrophiles. D’autre part, il existe des agents ayant des effets cytotoxiques directs sur les précurseurs myéloïdes, tels que les phénothiazines, la clozapine, la dapsone et le procaïnamide [15].

Contrairement à la neutropénie à médiation immunitaire, la toxicité directe est liée à la dose. Alors que dans ce cas, c’est la quantité qui fait le poison, les dommages causés aux granulocytes dans le cadre d’une formation d’anticorps induite par un médicament sont indépendants du temps et de la dose. Comme la sensibilisation est susceptible de durer toute la vie, il suffit d’une petite dose de la substance déclenchante pour provoquer une neutropénie, voire une agranulocytose, à plusieurs reprises. En raison des différents mécanismes de lésion des neutrophiles, les effets de différents médicaments sont difficiles à prédire et à caractériser. La figure 1 donne un aperçu de quelques données empiriques.
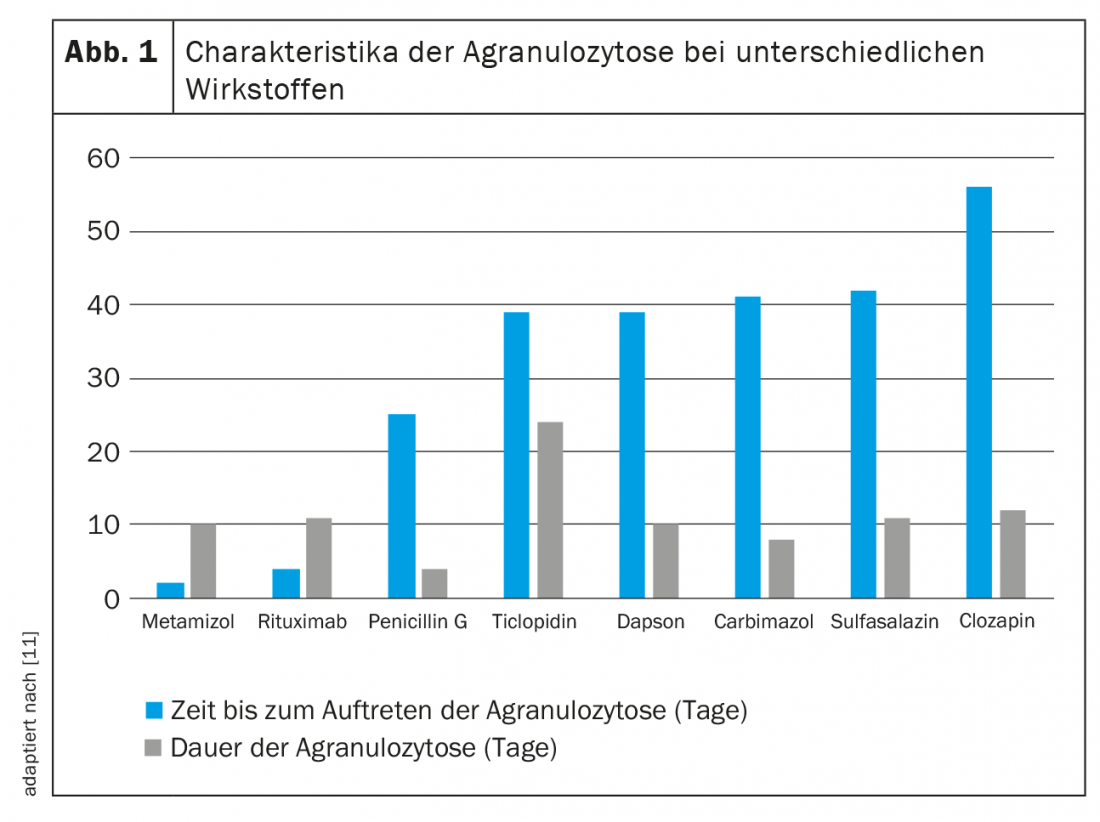
La substance probablement la plus tristement célèbre qui présente un risque d’agranulocytose est le métamizole (Novalgine®). Des données à ce sujet ont été publiées dès 1964 [16]. En général, la neutropénie se produit au cours des deux premiers mois de traitement et se normalise en deux semaines [11]. On estime que le risque de neutropénie due au métamizole se situe entre 1/116 et 1/466 000 expositions. Le risque absolu est faible pour des doses normales et une utilisation courte, avec de grandes différences géographiques [17,18]. Alors que l’incidence est élevée en Suède, par exemple, elle semble être plus faible aux Pays-Bas ou en Espagne. Cela pourrait être dû à des schémas d’utilisation différents, car le risque augmente avec l’administration prolongée de médicaments et une co-médication défavorable. L’hypothèse selon laquelle, par exemple, les Britanniques, les Irlandais et les Scandinaves ont un risque plus élevé d’agranulocytose liée au métamizole en raison de leur ethnie a été examinée dans une étude épidémiologique [19]. Celle-ci a conclu que certains allèles HLA pourraient également avoir un lien avec le développement d’une neutropénie sous traitement par métamizole.
En fin de compte, on peut dire que le métamizole – bien que critique d’un point de vue hématologique – est un choix acceptable dans un petit nombre de cas, malgré le risque d’agranulocytose, en particulier par rapport aux analgésiques alternatifs tels que les anti-inflammatoires non stéroïdiens (AINS). Ceux-ci ont tendance à avoir un profil d’effets secondaires encore plus défavorable, qui ne doit pas être négligé [20]. Le métamizole doit toutefois être utilisé avec modération et avec les précautions nécessaires. Bien que des contrôles de laboratoire réguliers ne soient pas recommandés chez les patients asymptomatiques, les personnes concernées doivent être informées du risque d’agranulocytose et de ses symptômes [21].
En général, l’âge avancé, un mauvais état de performance, une septicémie ou un choc, une insuffisance rénale et des taux d’ANC inférieurs à 100 cellules/µl sont considérés comme des facteurs de mauvais pronostic en cas de neutropénie médicamenteuse [1]. En revanche, le traitement par antibiotiques intraveineux à large spectre et G-CSF améliore le pronostic [1]. Grâce à une expérience croissante dans la gestion des patients concernés, de grands progrès ont été réalisés dans ce domaine au cours des dernières années. Cependant, l’administration de G-CSF, en particulier, reste controversée. Statistiquement, l’administration du G-CSF permet de réduire les hospitalisations et l’utilisation d’antibiotiques, mais il n’existe pas de directives claires concernant l’utilisation du G-CSF dans les agranulocytoses médicamenteuses non liées à la chimiothérapie [13,22–24]. Si le nombre de neutrophiles est inférieur à 100 cellules/µl, des facteurs de croissance hématopoïétiques doivent être administrés, sinon la décision doit être prise au cas par cas.
Neutropénie et infections : La poule et l’œuf
Des virus tels que le VIH, l’EBV, le CMV , l’hépatite A et le Sras-CoV-2 peuvent provoquer des neutropénies. En outre, une neutropénie peut être observée en cas de typhoïde, de brucellose, de tularémie, de shigellose et de tuberculose, le déficit en neutrophiles favorisant à son tour l’infection. Les rickettsies et divers parasites peuvent également provoquer des neutropénies. La grippe est plus répandue sous nos latitudes et touche chaque année la Suisse. La plupart du temps, les cas de neutropénie sont légers et transitoires, mais il existe un lien clair entre les deux. Le risque semble plus élevé pour la grippe B que pour la grippe A [25]. Un autre risque qui peut être éliminé par la vaccination contre la grippe.
Gestion dans la pratique clinique quotidienne
Alors que la fièvre en cas de neutropénie constitue toujours une indication pour un traitement antibiotique adéquat avec ou sans administration de G-CSF, la recherche de la cause qui s’ensuit s’avère souvent être un processus de longue haleine (figure 2) [2,3]. Les évolutions chroniques, et en particulier les évolutions légères à l’âge adulte, indiquent plutôt des formes primaires de neutropénie, comme la neutropénie ethnique bénigne. En revanche, une survenue aiguë est un indicateur d’une genèse médicamenteuse ou infectieuse du trouble, en particulier en cas d’antécédents d’exposition. Si le nombre de neutrophiles se normalise au cours de l’évolution, aucun autre examen n’est nécessaire dans ce cas. Toutefois, si l’étiologie n’est pas claire, il convient de procéder à un examen de la moelle osseuse.
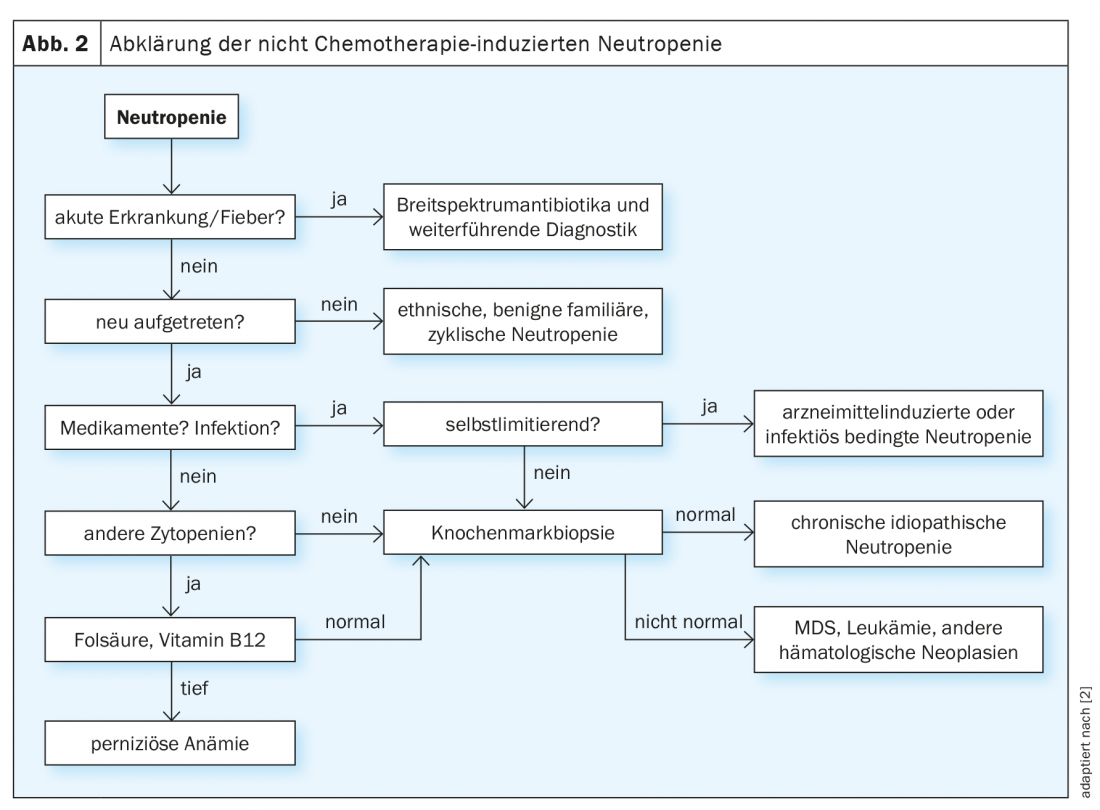
Le traitement de la neutropénie non liée à la chimiothérapie dépend en premier lieu du risque d’infection individuel et de la cause, l’éventail allant de l’administration continue de G-CSF à une procédure d’attente. Il est important que tous les patients connaissent leur risque individuel d’infection ainsi que les signaux d’alerte et les précautions à prendre, et qu’ils puissent agir en conséquence.
En cas d’infection aiguë, l’administration de G-CSF peut être envisagée [2,3,26]. Elle ne doit jamais être basée uniquement sur le nombre de neutrophiles et ne doit donc être utilisée qu’en cas de neutropénies symptomatiques. Il suffit d’augmenter l’ANC à plus de 250 à 300 cellules/µl pour réduire drastiquement le taux d’infection chez les patients symptomatiques [2].
Bien entendu, le traitement de la cause de la neutropénie, si elle existe, est la priorité. La substitution de l’acide folique et de la vitamine B12, ainsi que le traitement des neutropénies auto-immunes par le méthotrexate ou le cyclophosphamide, par exemple, ne sont que quelques exemples qui soulignent l’importance d’un examen approfondi des causes [27].
Cas particulier du COVID-19
Les données sur l’administration de G-CSF en présence d’une infection par le Sras-CoV-2 sont certes encore peu nombreuses, mais elles sont néanmoins plutôt inquiétantes, en particulier chez les patients atteints de tumeurs. Par exemple, dans une étude portant sur 55 patients, un moins bon résultat de la maladie a été observé lors du traitement par G-CSF [28]. Les 16 personnes qui ont reçu le G-CSF avaient des besoins en oxygène plus importants et une mortalité plus élevée. Une étude de cas de trois cas a postulé que le G-CSF favorisait l’inflammation et l’activation des macrophages comme mécanisme. Chez tous les patients, l’aggravation clinique est survenue environ 72 heures après l’administration du médicament [29]. Des observations comparables ont été décrites dans un autre rapport de cas concernant un patient de 47 ans atteint de COVID-19 [30].
Les données actuelles ne permettent certainement pas d’évaluer de manière définitive le risque d’un traitement par G-CSF en présence de COVID-19. Le besoin de données supplémentaires est important et celles-ci pourraient montrer la voie pour les années à venir.
Perspectives
Une analyse rétrospective de tous les cas de neutropénie isolée inférieure à 500 cellules/µl entre 2015 et septembre 2020 est actuellement en cours à l’Hôpital universitaire de l’Île de Berne. Les patients ayant subi une chimiothérapie ou une radiothérapie et ceux présentant d’autres cytopénies parallèles ne sont pas inclus. Il s’agit en premier lieu de collecter des données sur la cause, le traitement, le taux d’infection et d’hospitalisation ainsi que sur d’autres résultats. Nous espérons découvrir des corrélations qui pourraient être pertinentes pour la stratification du risque et donc pour la thérapie.
Messages Take-Home
- Les neutropénies/agranulocytoses doivent faire l’objet de notre attention en raison du risque accru d’infection avec des évolutions potentiellement graves.
- La neutropénie induite par les médicaments est la forme la plus courante de neutropénie isolée.
- Les formes chroniques bénignes de neutropénies chez l’adulte sont des diagnostics d’exclusion et ont généralement une évolution bénigne.
- Le traitement par G-CSF doit toujours être évalué au cas par cas et est recommandé en cas d’infections récurrentes et de taux de neutrophiles inférieurs à 0,5 × 109/L. Le G-CSF peut également être utilisé pour traiter des infections à VIH. L’administration prophylactique d’antibiotiques est déconseillée.
- Une neutropénie peut survenir à la suite d’une infection par COVID-19. L’effet du G-CSF sur les patients atteints de COVID-19 n’est pas encore clair. L’utilisation du G-CSF, en particulier chez les patients atteints de tumeurs, doit se faire avec prudence jusqu’à ce que des données supplémentaires soient disponibles.
Littérature :
- Andres E, et al : Présentation clinique et prise en charge de l’agranulocytose induite par les médicaments. Expert review of hematology 2011 ; 4(2) : 143-151.
- Gibson C, Berliner N : Comment nous évaluons et traitons la neutropénie chez les adultes. Blood 2014 ; 124(8) : 1251-1258.
- Dale DC : Comment diagnostiquer et traiter la neutropénie. Current opinion in hematology 2016 ; 23(1) : 1-4.
- Palmblad J, et al : How we diagnose and treat neutropenia in adults. Expert review of hematology 2016 ; 9(5) : 479-487.
- Dale DC, Bolyard AA : An update on the diagnosis and treatment of chronic idiopathic neutropenia. Curr Opin Hematol 2017 ; 24(1) : 46-53.
- Atallah-Yunes SA, Ready A, Newburger PE : neutropénie ethnique bénigne. Blood reviews 2019 ; 37 : 100586.
- Rappoport N, et al : The Duffy antigen receptor for chemokines, ACKR1,- ‘Jeanne DARC’ of benign neutropenia. British journal of haematology 2019 ; 184(4) : 497-507.
- Reich D, et al : La réduction du nombre de neutrophiles chez les personnes d’origine africaine est due à une variante de régulation dans le récepteur antigénique de Duffy pour le gène des chimiokines. PLoS Genet 2009 ; 5(1) : e1000360.
- Dale DC : Neutropénie cyclique et chronique : une mise à jour sur le diagnostic et le traitement. Clinical advances in hematology & oncology 2011 ; 9(11) : 868-869.
- Welte K, Zeidler C, Dale DC : neutropénie congénitale sévère. Séminaires en hématologie. 2006 ; 43(3) : 189-195.
- Andersohn F, Konzen C, Garbe E : Systematic review : agranulocytosis induced by nonchemotherapy drugs. Annals of internal medicine 2007 ; 146(9) : 657-665.
- Garbe E : Agranulocytose induite par les médicaments non chimiothérapeutiques. Avis d’expert sur la sécurité des médicaments 2007 ; 6(3) : 323-335.
- Andres E, et al : Modern management of non-chemotherapy drug-induced agranulocytosis : a monocentric cohort study of 90 cas and review of the literature. European journal of internal medicine 2002 ; 13(5) : 324-328.
- Kaufman DW, et al : Incidence relative de l’agranulocytose et de l’anémie aplasique. Am J Hematol 2006 ; 81(1) : 65-67.
- Tesfa D, Keisu M, Palmblad J : Agranulocytose induite par les médicaments idiosyncratiques : mécanismes possibles et prise en charge. American journal of hematology 2009 ; 84(7) : 428-434.
- Huguley CM : Agranulocytosis induced by dipyrone, a hazardous antipyretic and analgesic. JAMA 1964 ; 189 : 938-941.
- Ibanez L, et al : Agranulocytosis associated with dipyrone (metamizol). European journal of clinical pharmacology 2005 ; 60(11) : 821-829.
- Hedenmalm K, Spigset O : Agranulocytosis and other blood dyscrasias associated with dipyrone (metamizole). European journal of clinical pharmacology 2002 ; 58(4) : 265-274.
- Shah RR : L’agranulocytose induite par le métamizole (dipyrone) : le risque varie-t-il en fonction de l’ethnie ? J Clin Pharm Ther 2019 ; 44(1) : 129-133.
- Fauler J : Effets non dirigés des AINS et des coxibs. MMW Progrès de la médecine 2005 ; 147(31-32) : 31-35.
- Stamer UM, et al : Dipyrone (métamizole) : Considerations on monitoring for early detection of agranulocytosis. Douleur 2017 ; 31(1) : 5-13.
- Njue L, Baerlocher GM : Neutropénies/agranulocytoses induites par les médicaments. le médecin informé 2018 ; 02/2018 : 23-26.
- Beauchesne MF, Shalansky SJ : Nonchemotherapy drug-induced agranulocytosis : a review of 118 patients treated with colony-stimulating factors. Pharmacotherapy 1999 ; 19(3) : 299-305.
- Sprikkelman A, de Wolf JT, Vellenga E : The application of hematopoietic growth factors in drug-induced agranulocytosis : a review of 70 cas. Leucémie 1994 ; 8(12) : 2031-2036.
- Higgins P, et al. : Rates of neutropenia in adults with influenza A or B : a retrospective analysis of hospitalised patients in South East Queensland during 2015. Intern Med J 2016 ; 46(11) : 1328-1332.
- Dale DC, et al : A randomized controlled phase III trial of recombinant human granulocyte colony-stimulating factor (filgrastim) for treatment of severe chronic neutropenia. Blood 1993 ; 81(10) : 2496-2502.
- Starkebaum G : neutropénie chronique associée à une maladie auto-immune. Seminars in hematology 2002 ; 39(2) : 121-127.
- Morjaria S, et al. : The Effect of Neutropenia and Filgrastim (G-CSF) in Cancer Patients With COVID-19 Infection. medRxiv 2020.
- Nawar T, et al : Granulocyte-colony stimulating factor in COVID-19 : Is it stimulating more than just the bone marrow ? Am J Hematol 2020 ; 95(8) : E210-E3.
- Taha M, Sharma A, Soubani A : Dégradation clinique lors de la récupération des neutropénies après traitement par G-CSF chez un patient atteint de COVID-19. Respiratory medicine case reports 2020 ; 31 : 101231.
InFo ONKOLOGIE & HÉMATOLOGIE 2021 ; 9(1) : 5-9