La plèvre est impliquée dans environ 30% des maladies affectant le système respiratoire. Cela se caractérise souvent par l’apparition d’un épanchement. L’incidence totale des épanchements pleuraux dans les pays occidentaux industrialisés est d’environ 300/100 000.
La plèvre est impliquée dans environ 30% des maladies affectant le système respiratoire. Cela se caractérise souvent par l’apparition d’un épanchement. L’incidence globale des épanchements pleuraux est élevée, environ 300/100 000 dans les pays occidentaux industrialisés. En cas de maladies cardiaques, hépatiques ou rénales concomitantes, il s’agit généralement de transsudats dont la proportion est de 40 à 46%. Les exsudats nécessitant une clarification sont estimés jusqu’à 60% dans une population mixte de médecine interne. Ceux-ci se répartissent en 40-45% de causes inflammatoires-microbiennes, 20-30% d’épanchements malins et 10-18% d’épanchements réactionnels, par exemple en cas de thromboembolie. Le reste comprend les causes rares et les épanchements idiopathiques.
Fondamentaux
L’espace pleural mesure environ 5-30 µm. Normalement, on trouve jusqu’à 15 ml de liquide pleural dans la cavité pleurale, un filtrat microvasculaire de la plèvre pariétale. La pression pleurale résulte de la force d’expansion de la paroi thoracique, de la force de rétraction élastique du poumon ainsi que de la pression capillaire hydrostatique et de la pression oncotique. Il en résulte un léger afflux de liquide dans l’espace pleural. Le liquide est échangé par les vaisseaux lymphatiques de la plèvre pariétale, normalement environ 15-30 ml par 24 h et par hémithorax. Celle-ci peut être augmentée jusqu’à 500 ml. Les modifications des conditions de pression, des conditions d’écoulement ou l’augmentation de la production dans le cadre de processus inflammatoires ou malins conduisent finalement à la formation d’un épanchement pleural, les premières donnant généralement lieu à un transsudat, les autres à un exsudat.
L’échographie thoracique, qui est une technique disponible presque partout, ou la tomodensitométrie permettent de mieux visualiser les modifications pleurales, bien mieux que la radiographie thoracique d’ensemble. Ils permettent une classification descriptive. Le caractère et l’étendue des modifications pleurales, la présence d’un épanchement, sa taille, les ventricules, les relations des modifications avec les poumons et la paroi thoracique sont enregistrés. En outre, une biopsie ciblée peut être réalisée à l’aide des techniques d’imagerie. Ils peuvent également révéler des indices étiologiques, tels que des thrombus centraux, comme indice d’embolies pulmonaires.
W. Frank a proposé quatre questions clés pour construire le diagnostic : (1) une thoracocentèse doit-elle être réalisée ? (2) s’agit-il d’un transsudat ou d’un exsudat ? (3) quelle est l’étiologie de l’épanchement en cas d’exsudat ? (4) quand quelles techniques biopsiques sont indiquées ? Le diagnostic d’épanchement a déjà une forte probabilité d’aboutir à une clarification (jusqu’à 75% des cas). L’ajout des procédures endoscopiques et biopsiques permet d’atteindre plus de 90%. C’est la base de l’algorithme présenté.
Ponction pleurale – thoracocentèse
Une thoracocentèse est indiquée lorsqu’un épanchement est présent et que les considérations cliniques ne sont pas clairement en faveur d’un transsudat. Aujourd’hui, la ponction est généralement assistée par échographie. Les aiguilles ne doivent pas être sous-dimensionnées afin de pouvoir retirer un matériau visqueux, le cas échéant. Une anesthésie locale peut être utile, mais ne doit pas toujours être réalisée, car la simple ponction d’essai ne dépasse guère l’ampleur de la ponction anesthésique. En cas de ventricules, plusieurs ponctions peuvent être nécessaires, mais peuvent également donner des résultats différents. Les épanchements bilatéraux ne nécessitent généralement pas d’évaluation invasive des deux côtés, car ils sont principalement corrélés en termes de paramètres clés. Pour le diagnostic, un prélèvement de 20 à 30 ml d’épanchement est suffisant. Le prélèvement de grandes quantités est généralement effectué sur indication thérapeutique pour réduire la détresse respiratoire et constitue souvent une mesure d’urgence.
Premières étapes de l’évaluation
La première étape consiste à évaluer visuellement l’épanchement. On distingue l’épanchement clair ou trouble et le pus (empyème), ainsi que l’épanchement sanguin ou chyleux. L’odeur est également un critère important. Une odeur nauséabonde caractérise souvent un empyème. La sédimentation et la centrifugation peuvent révéler une turbidité due à un débris cellulaire. Le dosage de l’hémoglobine ou de l’hématocrite permet de distinguer l’épanchement hémorragique de l’hématothorax. Le diagnostic différentiel entre les épanchements chyleux et pseudochyleux est possible grâce à la détermination des triglycérides dans l’épanchement.
Analyse chimique
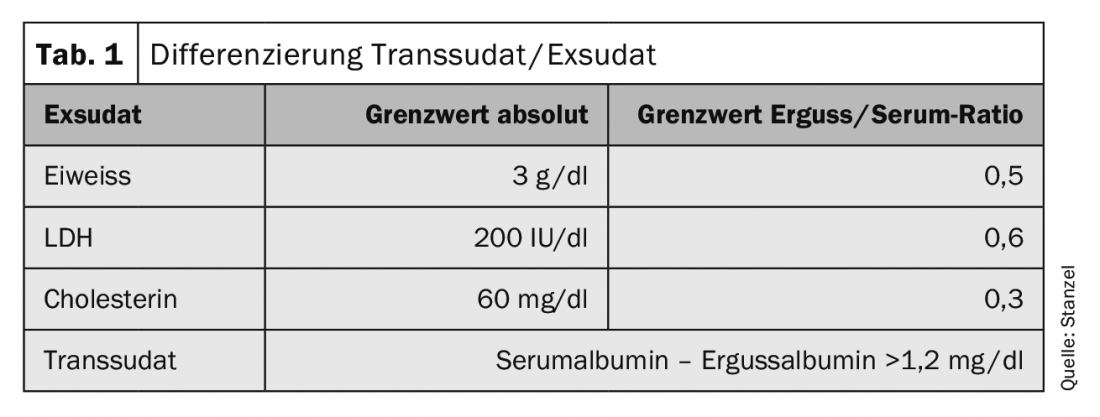
L’étape suivante est l’analyse de la teneur en protéines. Une classification en transsudat ou exsudat est effectuée selon les critères Light. En cas de maladie clairement explicative d’un transsudat, il n’est pas nécessaire, selon la doctrine générale, d’aller plus loin dans le diagnostic. De même, un épanchement malin est en grande partie exclu en présence d’un transsudat. En cas de lymphangiose carcinomateuse de la plèvre ou de lymphome malin de la plèvre, des transsudats passagers ont été décrits, de sorte que le diagnostic doit parfois être étendu au transsudat également. Des ponctions répétées et des thérapies telles qu’une médication diurétique peuvent également entraîner une modification. Le dosage supplémentaire de la LDH peut être utile pour détecter les transsudats dont le taux de protéines est élevé uniquement en raison d’un traitement diurétique. En revanche, en cas d’exsudat, il est généralement nécessaire de procéder à un examen plus approfondi.
Le dosage des protéines dans le liquide pleural est une étape cruciale (tableau 1). La pertinence est améliorée par l’évaluation de la valeur pleurale par rapport à la valeur sérique. Une analyse supplémentaire du taux de LDH dans l’épanchement pleural par rapport au taux sérique améliore la sensibilité. Le dosage du cholestérol peut contribuer à une différenciation plus poussée. En cas d’épanchement chyleux, outre l’aspect visuel caractéristique, le dosage des triglycérides ou des chylomicrons permet de poser le diagnostic. La délimitation des “pseudo-exsudats” peut être difficile. Il s’agit de transsudats chroniques ou de transsudats modifiés par un traitement diurétique. Le dosage de l’amylase dans l’épanchement peut révéler un lien avec une pancréatite aiguë ou chronique ou une perforation de l’œsophage. D’autres paramètres peuvent en outre être pris en compte dans le diagnostic. Selon la maladie sous-jacente, la détermination des neutrophiles, du pH, du NT-proBNP ou du facteur rhumatoïde ou d’autres paramètres peut être utile.
La détermination du pH est importante à la fois pour l’épanchement parapneumonique et l’épanchement malin. Un pH ≤7,30 n’est généralement observé qu’en cas d’empyème, rarement en cas d’épanchement tuberculeux ou d’épanchement pleural malin avancé. Associé à une baisse du glucose, cela indique un épaississement de la plèvre et une inhibition du transfert entre la circulation sanguine et l’espace pleural. Pour la détermination du pH, le liquide prélevé est analysé de la même manière qu’une analyse des gaz du sang. L’abaissement du pH et du glucose est une mesure de la gravité et de l’étendue d’un processus pleural.
Le diagnostic de l’épanchement tuberculeux constitue un défi particulier. Une lymphocytose prononcée dans l’épanchement, des taux élevés d’albumine et de LDH associés à une baisse du glucose peuvent être des indices d’une étiologie tuberculeuse. La détection de la tuberculose par microscopie et culture n’est pas facile et ne réussit que dans 25% des cas en moyenne. Le dosage de l’adénosine désaminase (ADA), une enzyme inflammatoire associée aux macrophages et aux cellules T, permet d’augmenter la sensibilité avec un seuil de 47 U/ml dans le dosage enzymatique. Les techniques d’amplification de l’ADN permettant de détecter des séquences d’ADN spécifiques à la mycobactérie tuberculosis sont utiles. Ils peuvent permettre de détecter rapidement une pleurésie tuberculeuse. Cependant, les sensibilités et les spécificités varient davantage. Le diagnostic ne devrait donc jamais se baser uniquement sur un résultat isolé.
Cytologie
L’examen cytologique de l’épanchement est une procédure très simple et très répandue qui doit être incluse dès l’examen initial de l’épanchement pleural, sauf en cas de transsudation. La malignité peut déjà être prouvée par un résultat cytologique positif, que ce soit en raison d’une infiltration maligne de la plèvre ou de l’envahissement de la plèvre par des métastases. Cependant, les résultats des études varient considérablement en fonction de la maladie tumorale et de son étendue. Les patients présentant un épanchement malin et un pH d’épanchement inférieur à 7,30 ont eu un résultat cytologique positif dans 78% des cas. Pour un pH de coulée supérieur à 7,30, cette valeur est tombée à seulement 51%. Les techniques de biologie moléculaire et cellulaire permettent de nouvelles approches. Les marqueurs inflammatoires et oncologiques sont désormais bien établis. L’immunocytologie, en particulier, permet un diagnostic plus précoce et plus sensible. En outre, l’utilisation d’un panel de divers marqueurs facilite le diagnostic différentiel entre le mésothéliome et l’adénocarcinome.
Biopsie à l’aiguille
Compléter une biopsie de la plèvre lorsqu’un premier examen cytologique n’a pas permis de clarifier la situation est aujourd’hui controversé et peu courant. Seule la biopsie pleurale contribue de manière significative à la clarification de la pleurésie tuberculeuse. Dans une étude portant sur 254 patients, des granulomes calcifiés ont été détectés dans des biopsies à l’aiguille chez 79,8% des patients, les autres ayant pu être confirmés par des examens culturels. Le taux de clarification dépend du nombre de biopsies et atteint un niveau optimal lorsque six biopsies ou plus sont prélevées ou lorsque du tissu pleural est détecté dans au moins deux des biopsies. En cas d’incidence élevée de tuberculose, la combinaison de la détermination de l’ADA, de la prévalence des lymphocytes et de la biopsie à l’aiguille permet d’obtenir le taux de diagnostic le plus élevé pour les exsudats inexpliqués.
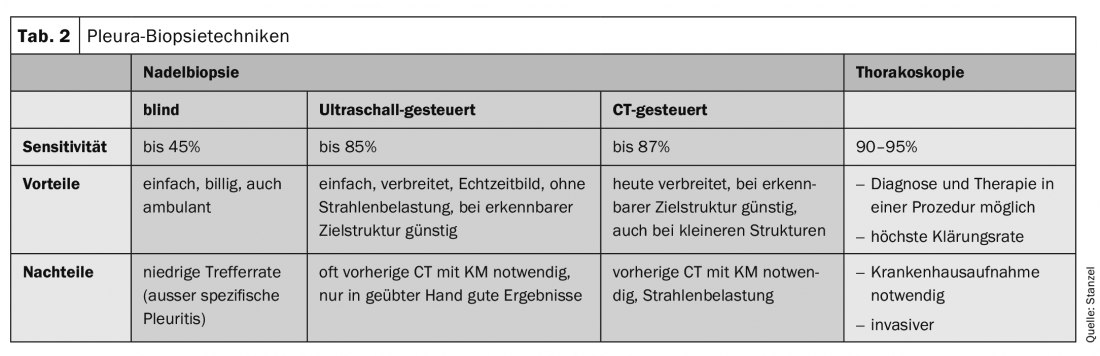
En cas d’épanchement malin, la biopsie à l’aiguille à l’aveugle est beaucoup moins sensible que la cytologie de l’épanchement. Par rapport à la thoracoscopie, la biopsie à l’aiguille est également nettement inférieure (36% vs 87%). Associée à des techniques d’imagerie modernes telles que l’échographie thoracique ou le scanner, elle permet de poser plus souvent des diagnostics définitifs. La qualité des biopsies réalisées à l’aide de l’aiguille de coupe automatique est excellente, car elles sont généralement obtenues sans artefact et correspondent à des cylindres d’estampage découpés de manière lisse. La biopsie à l’aiguille sous contrôle échographique ou assistée par scanner donne de bons résultats, en particulier lorsqu’un épaississement pleural ou des nodules sont détectables et peuvent être ciblés par l’aiguille sous contrôle de l’imagerie (tableau 2).
Thoracoscopie
Après avoir épuisé toutes les possibilités mentionnées jusqu’à présent, une proportion non négligeable d’épanchements, environ 20 à 25%, reste inexpliquée. Après l’algorithme, l’étape suivante est la thoracoscopie. La simple attente avec contrôle de l’évolution (“wait and see”) n’est généralement une option que pour les patients gravement malades et en très mauvais état général. Si une clarification définitive est utile et souhaitée, qu’il n’y a pas de contre-indications et que les résultats de la thoracoscopie sont susceptibles de modifier la procédure, celle-ci doit être effectuée. Un autre argument en faveur de la thoracoscopie est souvent l’option supplémentaire de la pleurodèse thoracoscopique, en particulier en cas d’épanchements importants et/ou récurrents. Le diagnostic et le traitement interventionnel sont ainsi réalisés en une seule étape.
En 1910, Jacobaeus a réalisé pour la première fois une thoracoscopie pour diagnostiquer une pleurésie exsudative. Dès les années 1970, avec Brandt et Loddenkemper en Allemagne et Boutin en France, cette méthode a été établie en Europe pour l’évaluation des maladies pleurales et des épanchements pleuraux. Associée à la technologie vidéo moderne, elle a donné naissance à la vidéothoracoscopie en qualité HD, aujourd’hui courante (Fig. 1).

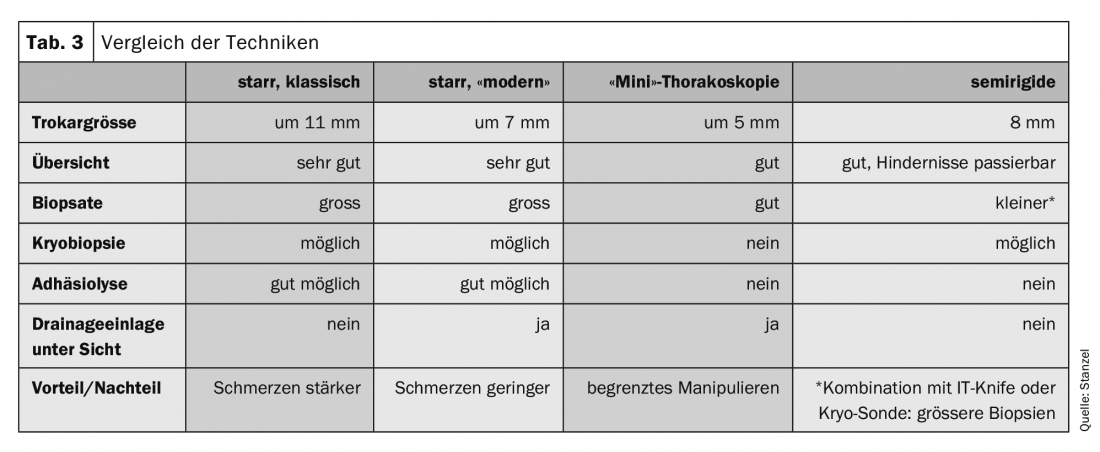
Classiquement, la thoracoscopie interne – “medical thoracscopy” en anglais – est réalisée sous anesthésie locale et sédation dans des salles d’endoscopie avec des instruments réutilisables et a un caractère essentiellement diagnostique (tab. 3). Mais il existe également des possibilités thérapeutiques entre les mains du pneumologue interventionnel. La thoracoscopie, en particulier la thoracoscopie interventionnelle, peut alors être réalisée sous anesthésie générale. Les indications de la thoracoscopie sont énumérées dans le tableau 4. Chaque indication est très étroitement liée à la forme et à la technique d’anesthésie. En Allemagne, seuls l’examen et le traitement de l’épanchement pleural et la biopsie pleurale sous contrôle visuel sont encore répandus et plus largement acceptés comme indications de médecine interne.
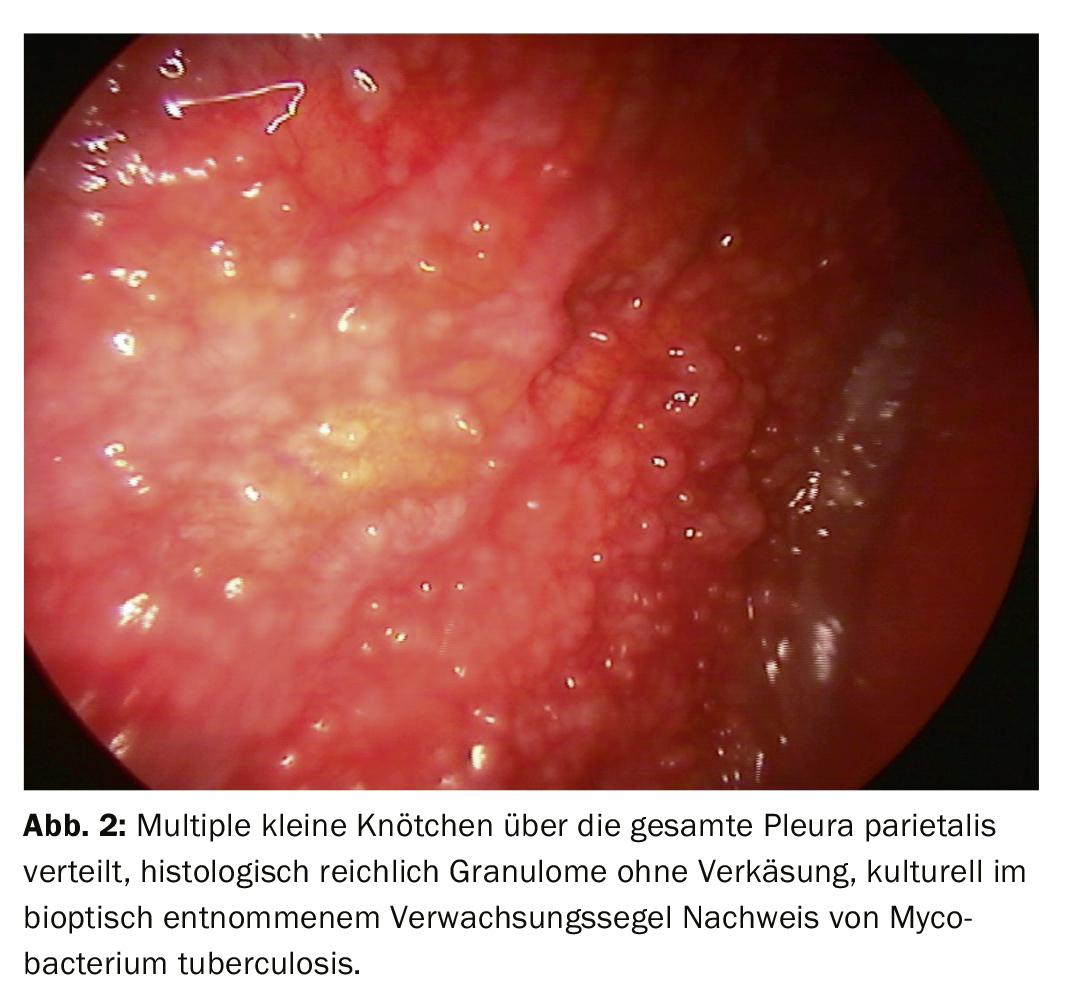
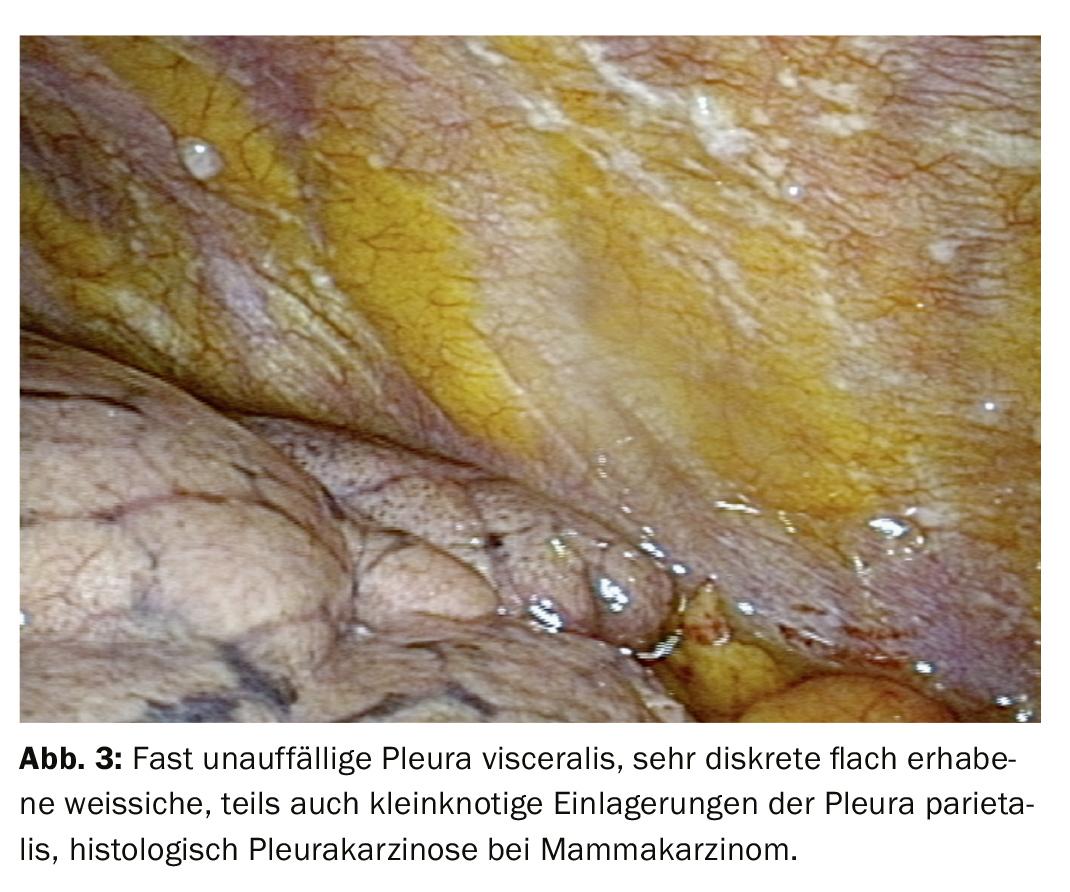
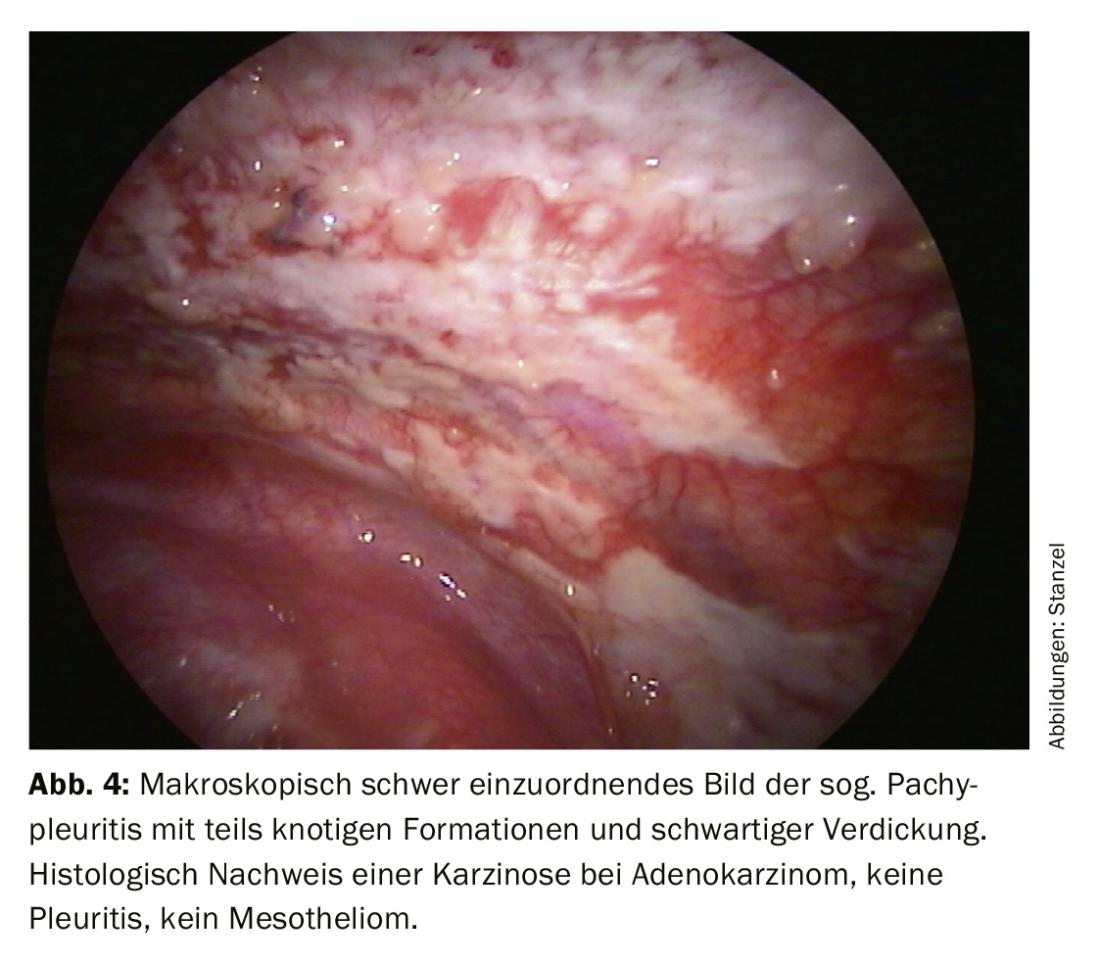
Après un processus de diagnostic progressif, l’accent est généralement mis sur la distinction entre un événement inflammatoire et un épanchement malin (Fig. 2). L’histologie à partir de biopsies de la plèvre réalisées à l’aide de pinces permet une attribution plus claire. Dans l’oncologie moderne, le traitement ultérieur du tissu tumoral joue également un rôle important, car les analyses moléculaires peuvent avoir une influence décisive sur le traitement, en particulier dans le cas du cancer du poumon. Il peut donc être important d’examiner non seulement le matériel cytologique, mais aussi des biopsies plus importantes, qui peuvent être facilement obtenues par biopsie directe à la pince ou par cryobiopsie lors de la thoracoscopie, même si seules des manifestations tumorales discrètes sont visibles. (Fig.3). Le mésothéliome pleural, diagnostic différentiel important de l’épanchement malin, a vu sa fréquence diminuer de manière significative. Mais là encore, une meilleure différenciation et une meilleure classification histologique sur la base du matériel de biopsie obtenu lors de la thoracoscopie peuvent constituer une bonne indication (fig. 4).
Certains pneumologues considèrent également que la phase précoce d’un épanchement parapneumonique ou d’un empyème est une indication à la thoracoscopie interne, mais alors plutôt d’un point de vue thérapeutique. Plus le tableau clinique évolue vers un empyème compliqué, plus la VATS par le chirurgien thoracique est envisagée, car le débridement devient de plus en plus important. Lorsque le diagnostic moins invasif ne permet pas de distinguer avec suffisamment de certitude la pleurésie de la pleurésie spécifique, la thoracoscopie permet d’obtenir un taux de clarification de >90%. Outre le traitement histologique et microbiologique supplémentaire des échantillons de tissus, les matériaux prélevés lors du débridement (dépôts de fibrine, voiles et cavités) doivent également être soumis à des examens complémentaires (Fig. 2). Pour ces questions, le matériel doit également être traité de manière appropriée (sérum physiologique, traitement rapide). Les techniques hautement sensibles telles que la PCR sont moins souvent nécessaires.
En cas de pneumothorax, la thoracoscopie est aujourd’hui le plus souvent réalisée par le chirurgien thoracique sous forme de VATS lorsqu’il existe une indication opératoire. Certains centres défendent ou ont défendu la thèse selon laquelle, lors de la pose d’un drain thoracique en cas de pneumothorax symptomatique, une thoracoscopie interne peut très bien également déterminer la stratégie ultérieure et celle-ci peut être effectuée par le même accès avant la pose du drain. Mais comme les recommandations actuelles pour le pneumothorax vont dans le sens d’une ponction unique avec des cathéters de petit calibre en première intention, la thoracoscopie interne n’est pratiquement plus pratiquée avec cette indication.
L’équipement nécessaire à la réalisation de la thoracoscopie se compose d’instruments rigides tels que trocart avec manchon, valve, optique, pinces et aspirateur. (Tab. 3, 5). Pour les examens sous anesthésie locale, il est aujourd’hui courant d’utiliser des instruments de plus petit diamètre, généralement autour de 6-7 mm. Des instruments plus grands, de 10 à 12 mm, sont également utilisés, principalement sous anesthésie générale. mm de diamètre sont utilisés, mais ne sont plus guère courants. Un diamètre d’instrument plus grand entraîne également plus de douleurs et d’inconfort pendant et après la thoracoscopie. La “mini-thoracoscopie” est réalisée avec des instruments encore plus petits, d’un diamètre de 3 mm, la gaine présentant alors un diamètre extérieur de 5-6 mm. La procédure est alors moins invasive et moins douloureuse. Les résultats sont comparables à la procédure standard.
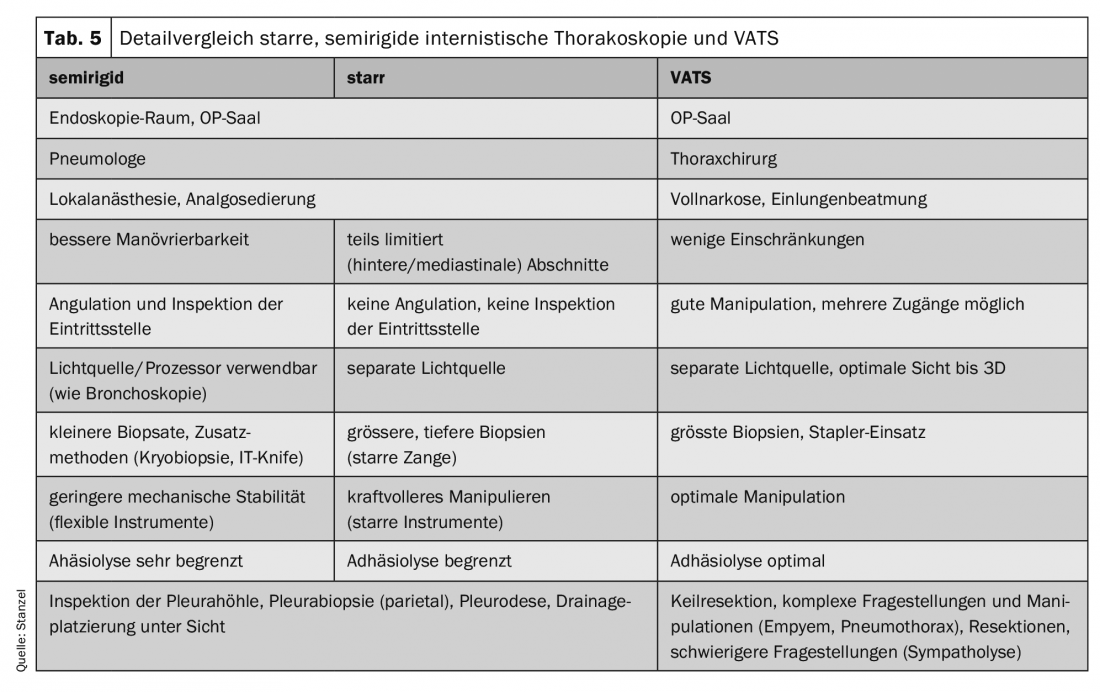
En alternative, un instrument semi-rigide a été développé, qui ressemble à un bronchoscope flexible et qui peut être déplacé autour des obstacles grâce à la possibilité de l’incliner. Les principaux inconvénients sont des biopsies plus petites et un prélèvement de biopsie souvent plus difficile qu’avec des pinces rigides. Ces inconvénients peuvent toutefois être partiellement compensés par l’utilisation de techniques supplémentaires (couteau électrique avec cautère électrique ou technique de cryobiopsie).
Le pneumothorax nécessaire à l’examen est créé soit de manière passive en laissant entrer l’air ambiant, généralement après ou en éliminant un épanchement, soit de manière active à l’aide d’un insufflateur. La localisation de l’épanchement et la mise en place du pneumothorax se font le plus simplement sous contrôle échographique. La pose d’un pneumothorax est réalisable en toute sécurité, même en cas d’épanchement minime ou d’absence d’épanchement. Le contrôle radioscopique n’est plus guère pratiqué aujourd’hui. Le plus souvent, l’examen est réalisé par une seule voie d’accès. Il peut parfois être nécessaire de créer une deuxième voie d’abord, notamment en cas d’adhérences, afin de pouvoir visualiser d’autres zones et de prélever des biopsies.
Les résultats de la thoracoscopie sont les meilleurs en cas de carcinose pleurale (fig. 3, 4). La biopsie à l’aiguille clarifie 44%, la cytologie 62%, la thoracoscopie seule atteint même 95%, voire 97% en combinaison avec les autres procédures. En cas de mésothéliome malin, la thoracoscopie apporte une contribution essentielle à la confirmation histologique, même si celle-ci est plus difficile. Une classification précise des stades et la détermination de la marche à suivre sont alors effectuées. Il est également possible de déterminer si une résection a des chances d’aboutir. En cas de pleurésie tuberculeuse, les chiffres pour la clarification sont les suivants : biopsie à l’aiguille 51%, + culture 61%, thoracoscopie (+ culture) 99% (fig. 2).
L’un des avantages de la thoracoscopie est un diagnostic plus précis. Une étude française a analysé 168 thoracoscopies internes. Chez 66 patients, le diagnostic était une pleurésie non spécifique après l’ensemble des examens diagnostiques. Pour 34 d’entre eux seulement, le diagnostic a été confirmé par thoracoscopie. En revanche, 16 ont révélé un mésothéliome malin, 10 une carcinose pleurale sur adénocarcinome, 3 un carcinome indifférencié et 3 une pleurésie spécifique. Il est relativement fréquent que le diagnostic finalement posé par thoracoscopie modifie toute la procédure ultérieure. Pour 155 des 182 patients, la procédure a été modifiée.
La biopsie de la plèvre est réalisée sous visualisation directe, le nombre de biopsies prélevées devant être compris entre 2 et 6. Dans tous les cas, il devrait également y avoir suffisamment de matériel macroscopique, en particulier si un diagnostic complet supplémentaire est effectué comme c’est le cas aujourd’hui (immunohistologie, analyse moléculaire). En l’absence d’une structure cible claire, de multiples zones doivent être biopsiées. La biopsie doit être réalisée au niveau pariétal sur la côte. Les biopsies viscérales sont associées à un risque de fuite d’air prolongée, celles de l’espace intercostal à un saignement du vaisseau intercostal ou à une lésion du nerf. En soulevant et en tirant latéralement, il est souvent possible de décoller la plèvre à la manière d’un papier peint et d’obtenir ainsi une biopsie plus importante sans danger. Dans ce contexte, même sous analgosédation, les patients peuvent bouger et s’agiter en cas de douleur. Une injection locale supplémentaire est inhabituelle et n’est généralement pas nécessaire. En règle générale, le matériel de biopsie est placé dans du formol et soumis à un traitement histologique. En cas d’origine infectieuse, en particulier si une cause spécifique est suspectée, du matériel doit également être placé dans du sel de cuisine et transmis rapidement à un laboratoire approprié. La biopsie électrochirurgicale ou la cryobiopsie sont de nouveaux moyens d’augmenter le rendement, en particulier lorsque l’on travaille avec l’instrument semi-rigide.
Les patients qui souffrent d’un épanchement pleural malin et qui sont symptomatiques présentent souvent un épanchement étendu. La chimiothérapie n’est pas toujours un traitement prometteur, surtout lorsque la détresse respiratoire liée à l’épanchement est au premier plan et qu’il faut y remédier rapidement. Dans ce cas, la thoracoscopie offre simultanément une option thérapeutique avec la réalisation d’une pleurodèse, généralement par insufflation supplémentaire de talc. Les taux de réussite sont généralement estimés à >90%.
Une contre-indication absolue à la thoracoscopie est l’adhérence et le colmatage de l’espace pleural, comme cela peut se produire dans les processus malins avancés, en particulier le mésothéliome pleural. Les processus inflammatoires et l’empyème peuvent également en être la cause, tout comme une opération ou une pleurodèse antérieure. Les contre-indications relatives comprennent une dyspnée ou une hypoxémie prononcée qui n’est pas due à un épanchement. D’autres sont une situation cardiovasculaire instable, une maladie hémorragique, une toux inextinguible et une hypertension pulmonaire ou une obésité prononcée.
La thoacoscopie interne est une procédure sûre et caractérisée par un faible taux de complications lorsqu’elle est réalisée par un examinateur formé et expérimenté. Le BTS Pleural Disease Guideline fait état d’un taux de mortalité de 0,34%, souvent au détriment du talcage. D’autres complications telles que l’empyème, l’hémorragie, la métastase canalaire, la fuite d’air, le pneumothorax ou la pneumonie surviennent jusqu’à 1,8%, et des complications moins importantes telles que l’emphysème sous-cutané, une hémorragie mineure, une infection locale, une hypotension ou de la fièvre jusqu’à 7,3%. Pour la thoracoscopie semi-rigide, les taux de complications sont légèrement inférieurs à ceux de la thoracoscopie rigide. Le saignement d’un vaisseau intercostal constitue une complication grave, qui peut généralement être évitée. Une intervention de chirurgie thoracique peut alors s’avérer nécessaire. C’est pourquoi il est parfois recommandé de ne pratiquer une thoracoscopie que si un chirurgien thoracique est disponible en urgence.
Résumé
La thoracoscopie interne est une procédure de diagnostic sûre, avec peu de complications et un taux de diagnostic élevé. Les caractéristiques essentielles sont la moindre invasivité par rapport à la VATS, la moindre complexité et les coûts réduits. La thoracoscopie se trouve ainsi à la fin d’un flux de travail (algorithme) qui conduit à la clarification de la cause d’une maladie pleurale dans plus de 90% et offre en outre des options thérapeutiques, le plus souvent utilisées en cas d’épanchement malin, mais aussi en cas d’épanchement parapneumonique ou d’empyème et de pneumothorax.
Messages Take-Home
- En cas d’épanchement pleural inexpliqué, le taux de clarification par thoracoscopie interne passe à plus de 90%.
- La thoracoscopie interne est une procédure peu invasive, réalisée sous anesthésie locale et analgosédation.
- L’échographie du thorax a remplacé la radioscopie comme technique d’accompagnement pour la planification et la réalisation de la thoracoscopie.
- En présence de lésions pleurales circonscrites, une biopsie à l’aiguille assistée par échographie ou scanner peut apporter des éclaircissements ; en cas de lésions diffuses, seule la thoracoscopie permet généralement d’y voir plus clair.
- L’épanchement malin récidivant peut être diagnostiqué par thoracoscopie en une seule séance et éliminé définitivement par une poudrage au talc.
Littérature :
- Light R : Maladies pleurales. Baltimore, MD : Lippincott Williams & Wilkins 2007.
- Collins TR, Sahn SA : Thoracocentèse. Valeur clinique, complications, problèmes techniques et expérience des patients. Chest 1987 ; 91(6) : 817-822.
- Seijo LM, Sterman DH : Pneumologie interventionnelle. N Engl J Med 2001 ; 344(10) : 740-749.
- Hooper CE, Lee YCG, Maskell NA : Mise en place d’un service spécialisé dans les maladies pleurales. Respirology 2010 ; 15(7) : 1028-1036.
- Stanzel F, Ernst A : Diagnostic des maladies de la plèvre. Pneumologue 2008 ; 5 : 211-218.
- Frank W. Procédure diagnostique de l’épanchement pleural. Pneumologie 2004 ; 58 : 777-790.
- Ferrer J : Effusion pleurale tuberculeuse et empyème tuberculeux. Sem Crit Care Med 2001 ; 6/22 : 637-646.
- Rodriguez-Panadero F, Janssen JP, Astoul P : Thoracoscopy : general overview and place in the diagnosis and management of pleural effusion. Eur Resp J 2006 ; 28 : 409-421.
- Rahman NM, au nom du British Thoracic Society Pleural Disease Guideline Group. Thoracoscopie locale anaesthésique : British Thoracic Society Pleural Disease Guideline 2010. Thorax 2010 ; 65(suppl 2) : ii54-ii60.
- Loddenkemper R : Thoracoscopy – state of the art. Eur Resp J 1998 ; 11 : 213-221.
- Rodriguez-Panadero F, Janssen JP, Astoul P : Thoracoscopy : general overview and place in the diagnosis and management of pleural effusion. Eur Resp J 2006 ; 28 : 409-421.
- Tassi G, Marchetti G : Minithoracoscopy : A Less Invasive Approach to Thoracoscopy. Chest 2003 ; 124 : 1975-1977.
- Pyng L, Mathur PN, Colt HG : Advances in Thoracoscopy : 100 Years since Jacobaeus. Respiration 2010 ; 79 : 177-186.
- Alraiyes AH, Dhillon SS, Harris K, et al : Medical Thoracoscopy : Technique and Application. PLEURA 2016 ; 3 : 1-11.
- Janssen JP : Pourquoi vous faites ou ne faites pas de thoracoscopie. Eur Respir Rev 2010 ; 19 : 117, 213-216.
- Woolhouse I, au nom du BTS Mesothelioma Guideline Development Group : British Thoracic Society Guideline for the Investigation and Management of Malignant Pleural Mesothelioma. Thorax 2018 ; 73 : i1-i30.
- Blanc FX, Atassi K, Bignon J, Housset B : Valeur diagnostique de la thoracoscopie médicale dans la maladie pleurale – Une étude rétrospective de 6 ans. Chest 2002 ; 121 : 1677-1683.
InFo PNEUMOLOGIE & ALLERGOLOGIE 2020 ; 2(1) : 8-14