Les possibilités médicamenteuses dans le traitement du cancer du poumon ont évolué rapidement ces dernières années. Outre la chimiothérapie classique, l’immunothérapie et la thérapie ciblée des mutations pilotes occupent une place de plus en plus importante. L’importance de la biopsie et de la re-biopsie sous traitement a énormément augmenté.
Les possibilités médicamenteuses dans le traitement du cancer du poumon ont évolué rapidement ces dernières années. Outre la chimiothérapie classique, l’immunothérapie et la thérapie ciblée des mutations pilotes occupent une place de plus en plus importante. La condition de base pour un traitement médicamenteux personnalisé est l’examen immunohistochimique et la pathologie moléculaire du tissu tumoral. En raison de ces développements, l’importance de la biopsie et de la re-biopsie sous traitement a énormément augmenté.
En raison de son rapport bénéfice/risque favorable, la bronchoscopie est la méthode de choix. L’examen doit permettre de clarifier la situation thoracique dans son ensemble. Cela inclut les manifestations tumorales centrales et périphériques et le statut des ganglions lymphatiques médiastinaux.
La condition préalable obligatoire est la présence d’une imagerie en coupe thoracique, au moins sous la forme d’un scanner à contraste renforcé, et de manière optimale d’un PET-CT combiné.
Tumeur centrale
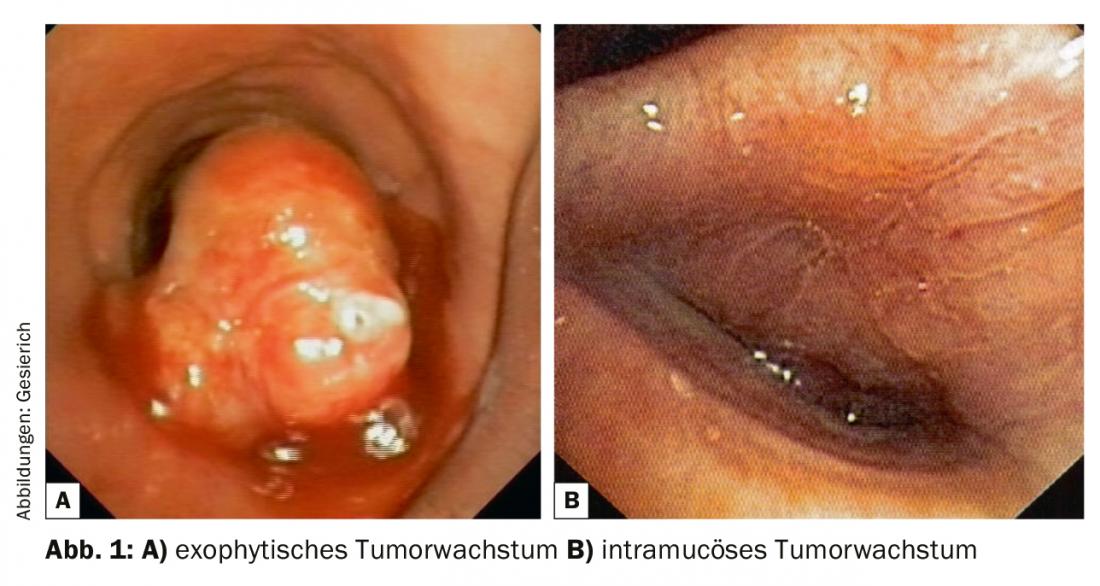
Une atteinte tumorale centrale dans la zone visible par bronchoscopie doit d’abord être décrite dans sa localisation et son étendue. La distance au repère proximal et distal le plus proche (carène principale, ostia de lobe, de segment et de sous-segment) ainsi que la longueur du segment bronchique atteint par la tumeur doivent être indiquées. Pour ce faire, le bronchologue doit connaître les possibilités de chirurgie thoracique, y compris les interventions bronchoplastiques complexes (“résections de la manchette”). Le type d’atteinte tumorale (exophytique, intramuqueuse, sous-muqueuse) doit être décrit. Toute sténose des voies aériennes qui en résulte (endoluminale-exophytique ; compression extrinsèque ; sténoses combinées) doit être caractérisée et quantifiée.
L’étape suivante est la biopsie, qui doit tenir compte de la forte augmentation des besoins en tissus de la pathologie pour effectuer également des analyses immunohistochimiques et moléculaires. En cas de tumeur exophytique (Fig. 1), le prélèvement de biopsies à la pince est généralement suffisant à cet effet. Si l’ablation d’exophytes tumoraux est prévue en même temps pour la recanalisation, une extraction à l’aide d’une cryosonde est également envisageable, ce qui fournit d’excellents échantillons pour le traitement histopathologique. Ce type de prélèvement présente également des avantages en cas de croissance tumorale intramuqueuse en raison de la profondeur plus importante de la biopsie. En cas de croissance sous-muqueuse, une aspiration transbronchique à l’aiguille (TBNA) est généralement nécessaire pour la confirmation histologique. Elle peut être réalisée à l’aide d’aiguilles TBNA conventionnelles et flexibles, mais l’échographie endobronchique (EBUS) peut également être utilisée pour le ciblage.
Tumeur périphérique
Il existe deux voies d’accès possibles aux manifestations tumorales périphériques, qui diffèrent en termes de rendement diagnostique et de risque (tableau 1) : La ponction transthoracique a une sensibilité élevée. Dans le cas de foyers en contact avec la paroi thoracique, elle peut être guidée par échographie dans les mains du pneumologue. Si du tissu pulmonaire contenant de l’air se trouve entre le foyer et la paroi thoracique, un accès guidé par scanner est nécessaire pour le radiologue. Il existe toutefois un risque important de pneumothorax en raison de la lésion nécessaire de la plèvre. La biopsie transbronchique guidée par bronchoscopie a une sensibilité moindre, en particulier pour les petits foyers. Cependant, comme elle se fait via naturalis, elle est également associée à un taux de pneumothorax nettement plus faible. C’est pourquoi l’accès bronchoscopique doit être privilégié – chaque fois que cela est possible -, d’autant plus qu’il permet d’explorer d’autres manifestations tumorales thoraciques au cours de la même intervention. Pour choisir individuellement la méthode optimale, une étude approfondie du scanner thoracique en fenêtre pulmonaire est nécessaire, en prêtant une attention particulière à la relation de position du foyer avec l’arbre bronchique et à la présence d’une bronche afférente. Une haute résolution sous la forme d’une faible épaisseur de couche (≤1 mm) est un grand avantage à cet égard.

Avant de pratiquer une biopsie transbronchique, l’examinateur doit planifier mentalement la voie d’accès avec le plus de précision possible sur le scanner thoracique. Pour pouvoir diriger les instruments de biopsie le plus loin possible en périphérie, il convient de choisir un bronchoscope fin (<5 mm). Les fabricants ont maintenant développé pour cette indication des bronchoscopes ultrafins (≤3 mm) avec un canal de travail suffisant. En outre, il convient de rechercher des indices indirects de localisation de la tumeur dans la zone visible par bronchoscopie, tels que des traces de sang, des phénomènes de compression et des formations de miroir de sécrétion dans les ostia.
Le sondage au-delà de la zone visible par bronchoscopie nécessite l’utilisation d’une autre méthode de navigation et de guidage de l’instrument de biopsie. Pour cela, on utilise classiquement la radioscopie. Un mouvement concomitant du foyer sur l’image fluoroscopique au moment de la biopsie (“signe de vacillement”) peut indiquer que l’objectif a été atteint. Une combinaison d’instruments de biopsie (pince, brosse cytologique, aiguille TBNA) peut augmenter le rendement diagnostique. Cependant, la sensibilité diminue rapidement proportionnellement à la taille du foyer périphérique (tableau 1).
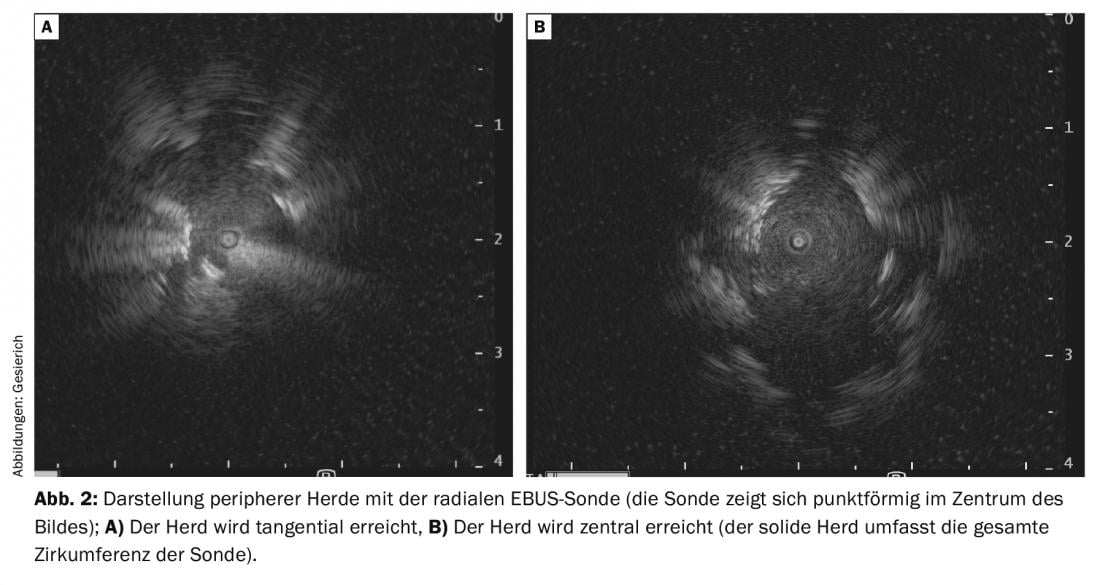
Cela incite au développement d’une multitude d’autres aides à la navigation [2]. En raison de son faible coût et de son utilisation rapide, la sonde à ultrasons radiale (rEBUS) est la plus répandue. Un transducteur rotatif placé à l’extrémité d’une sonde flexible fournit une image à 360° de l’environnement bronchique. Sur le chemin du foyer, l’image échographique typique est celle d’un parenchyme pulmonaire contenant de l’air. Lorsque le foyer est atteint, il est délimité sur l’échographie. Il convient de distinguer une position tangentielle au foyer d’une position centrale à l’intérieur du foyer (visualisation de tissus solides dans toute la circonférence de la sonde) (Fig. 2A et B). Cette dernière situation est associée à un meilleur rendement diagnostique. Le trajet ainsi trouvé est ensuite reproduit avec l’instrument de biopsie, la position de la sonde rEBUS sur l’image fluoroscopique servant de référence. Pour faciliter le ciblage, la sonde peut également être utilisée pour avancer un cathéter de guidage vers le foyer, par lequel les instruments de biopsie sont ensuite introduits après le retrait de la sonde. Cette approche permet également d’utiliser des cryosondes ultrafines pour la biopsie transbronchique. Cela permet d’obtenir de grandes biopsies hémisphériques qui, contrairement à une biopsie à la pince plus orthograde, contiennent également des parties tangentielles de l’environnement bronchique. Par conséquent, cette méthode doit être envisagée en particulier lorsque le foyer périphérique n’est visualisé que de manière tangentielle dans le rEBUS.
La navigation électromagnétique (EMN) est une méthode nettement plus coûteuse et qui prend plus de temps. Le patient est alors allongé dans un champ électromagnétique généré par un bord intégré au divan d’examen. La navigation s’effectue à l’aide d’une sonde à l’extrémité de laquelle sont induits dans des bobines des courants d’induction qui varient en fonction de sa position dans le champ électromagnétique et dont l’ampleur permet de le localiser. Le scanner thoracique du patient doit être préalablement lu dans le système de navigation comme une “carte routière”, la position de la pointe de la sonde est ensuite affichée en trois dimensions sur l’image du scanner. Cette méthode implique également l’utilisation d’un cathéter de guidage au niveau du foyer périphérique, à travers lequel la biopsie peut ensuite être réalisée. Enfin, il existe l’option de la bronchoscopie virtuelle (VB) : un logiciel reconstruit un arbre bronchique virtuel à partir de l’ensemble des données d’un scanner thoracique haute résolution, grâce auquel il est possible de planifier à l’avance et de manière semi-automatique un trajet vers le foyer périphérique. Pendant la bronchoscopie réelle avec un bronchoscope ultra-fin, une comparaison continue entre l’image virtuelle et l’image endoscopique est effectuée à l’aide d’un logiciel. Au niveau des sites de division bronchique, le logiciel indique le sous-segment à sélectionner.
Les aides à la navigation décrites permettent d’atteindre une sensibilité allant jusqu’à 70%, même pour les petits foyers périphériques [3]. La limite reste l’accessibilité technique d’une bronche d’alimentation. C’est pourquoi il existe des tentatives expérimentales de quitter l’arbre bronchique et de procéder par voie transparenchymateuse vers le foyer périphérique (“bronchoscopic transparenchymal nodule access”, BTPNA). Une bronchoscopie virtuelle permet de planifier un “point d’entrée” (POE) dans la paroi des voies respiratoires et un trajet aussi peu vascularisé que possible à travers le parenchyme jusqu’au foyer. Lors de la bronchoscopie, une ponction est alors effectuée au niveau de la POE et un tunnel est créé vers le foyer périphérique via un trocart.
A l’heure actuelle, l’utilisation de systèmes de bronchoscopie assistée par robot peut être considérée comme expérimentale et probablement très coûteuse. La “Ion Platform” (Intuitive Surgical, Sunnyvale, CA, États-Unis) se compose d’un cathéter flexible avec un canal de travail de 2 mm, dont l’extrémité peut être inclinée dans tous les plans par des mouvements finement contrôlés. Le cathéter est traversé sur toute sa longueur par une fibre de détection qui fournit des informations en retour sur sa forme et sa position. L’examinateur peut contrôler le système à distance via une console, au moyen d’une boule de suivi et d’une molette de défilement, ce qui est traduit par le robot en mouvements précis et épurés de la pointe de la sonde. Le reste du ciblage est similaire à celui de la bronchoscopie virtuelle, la fibre du capteur fournissant des informations supplémentaires sur la navigation et la stabilité de la position pendant la biopsie [4].
Dans le cadre de l’introduction attendue du dépistage du cancer du poumon, il faut s’attendre à un grand nombre de foyers périphériques nécessitant des investigations, la majorité de ces résultats étant bénins. Dans ce contexte également, un développement de l’instrumentation bronchoscopique pour le sondage périphérique est à saluer, afin de permettre une clarification aussi peu invasive que possible de ces résultats.
Pour certaines localisations tumorales difficiles à atteindre par biopsie transbronchique, un accès peut être trouvé à l’aide d’une aspiration transbronchique à l’aiguille via un bronchoscope de ponction à ultrasons (EBUS-TBNA). Cela s’applique aux tumeurs paramédiastinales des deux lobes supérieurs, adjacentes à la trachée et à l’œsophage, ainsi qu’aux tumeurs péribronchiques et hilaires.
Statut des ganglions lymphatiques médiastinaux
Le statut des ganglions lymphatiques médiastinaux est le facteur pronostique le plus important chez les patients non métastatiques à distance et un paramètre crucial pour déterminer l’opérabilité dans le cancer du poumon. La détection préthérapeutique la plus précise possible d’une atteinte ganglionnaire médiastinale a donc une grande importance pour la planification du traitement.
Les méthodes d’imagerie, y compris le PET-CT, ont une sensibilité et une spécificité insuffisantes (tableau 2). Un staging invasif est donc nécessaire.

En raison de sa grande portée, de sa sensibilité et de sa spécificité élevées, ainsi que de son risque moindre, l’endosonographie et l’aspiration transbronchique à l’aiguille guidée par ultrasons (EBUS-TBNA) sont désormais recommandées dans les directives comme méthode mini-invasive de premier choix pour le staging médiastinal, tandis que les voies d’accès chirurgicales invasives (médiastinoscopie, thoracoscopie vidéo-assistée) ont reçu un statut de réserve pour les situations incertaines.
L’examinateur doit avoir une connaissance détaillée de l’anatomie des ganglions lymphatiques thoraciques. Pour ce faire, la carte des ganglions lymphatiques de l’International Association for the Study of Lung Cancer (IASLC) est utilisée dans sa version proposée en 2009, qui peut être consultée en détail dans la publication correspondante [6,7]. Chaque station ganglionnaire est définie en fonction de sa relation topographique avec l’arbre trachéobronchique et les vaisseaux thoraciques. La station 1 correspond aux ganglions lymphatiques supracalviculaires et est donc classée au niveau N3. Les stations 2 à 9 sont situées dans le médiastin, du côté cranial vers le côté caudal. Ils sont classés au niveau N2 en cas de siège ipsilatéral de la tumeur et au niveau N3 en cas de tumeur controlatérale. La station 10 est localisée au niveau du hile, les stations 11 à 14 sont situées au niveau lobaire, segmentaire et sous-segmentaire dans les poumons. Ceux-ci appartiennent au niveau N1 en cas de tumeur ipsilatérale et au niveau N3 en cas de tumeur controlatérale. La figure 3 montre la sélection des stations ganglionnaires accessibles par endosonographie. Alors que la médiastinoscopie ne couvre que les ganglions lymphatiques paratrachéaux supérieurs et inférieurs (stations 2 et 4) et les ganglions infracarinaires (station 7), l’échographie endobronchique (EBUS) atteint en plus les ganglions hilaires (station 10), interlobaires (station 11) et segmentaires (station 12). Un accès transoesophagien (échographie endoscopique ; EUS) permet en outre de ponctionner les ganglions lymphatiques médiastinaux inférieurs (stations 8 et 9).
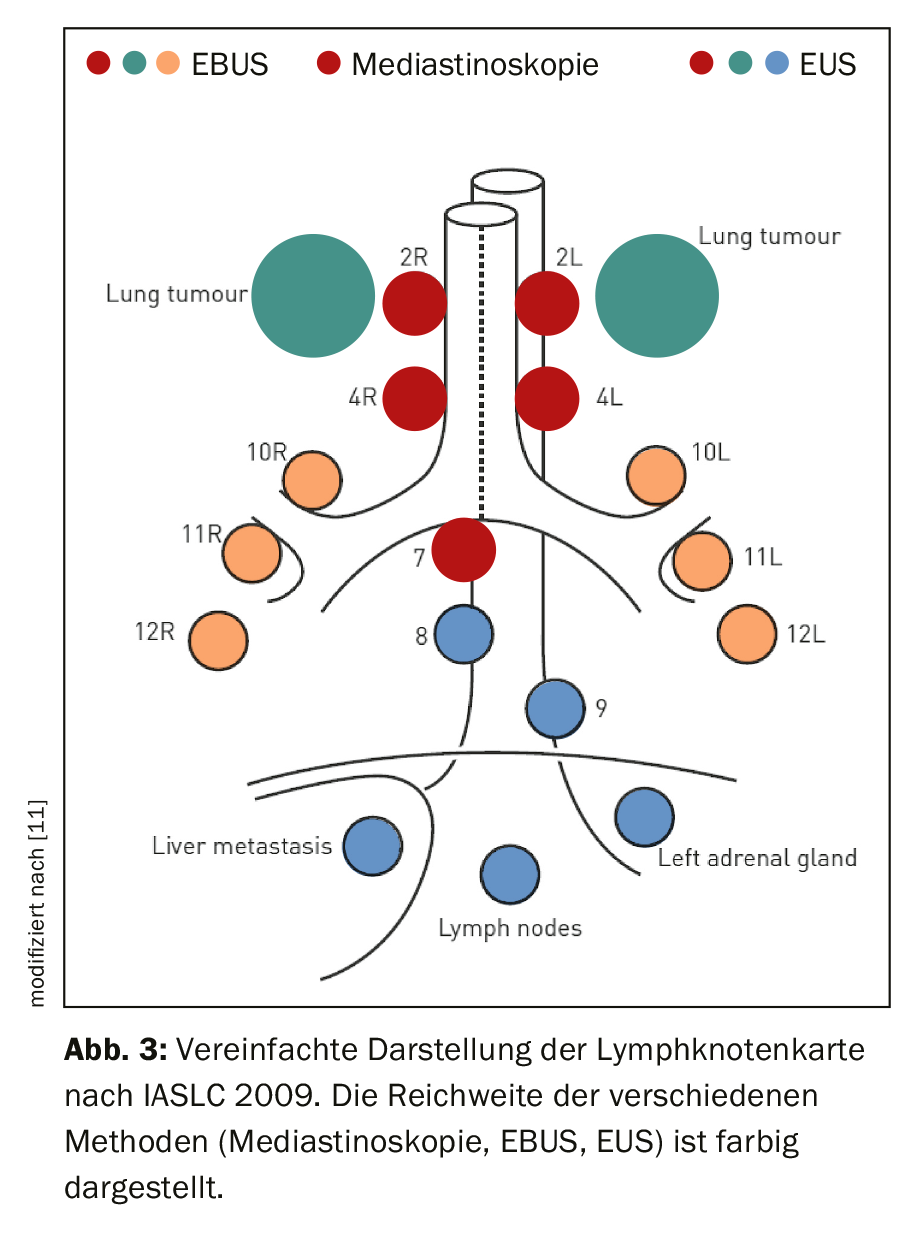
Le staging endosonographique doit être complet et systématique. Les lignes directrices de l’European Respiratory Society (ERS) recommandent à cet effet – lorsqu’elles sont disponibles – de combiner l’EBUS et l’EUS, car c’est la seule façon de bénéficier de toute la portée de l’endosonographie [8]. L’examen EUS est généralement réalisé à l’aide d’un gastroscope à ultrasons tenu par le gastroentérologue. Mais le bronchoscope à ultrasons (EUS-B) peut également être introduit par l’œsophage. Cela nécessite une formation adéquate de l’examinateur, mais permet un staging endosonographique complet par le pneumologue en une seule intervention, avec une charge de travail réduite pour le patient et des coûts moindres en conséquence. Les lignes directrices recommandent au moins une aspiration à l’aiguille dans les ganglions lymphatiques paratrachéaux inférieurs (stations 4R et 4L) et infracarinaires (station 7). En outre, toutes les stations qui présentent des anomalies radiologiques et/ou endosonographiques doivent être échantillonnées. Pour l’endosonographie, un seuil de taille de 5 mm a souvent été utilisé dans les études. Comme l’EBUS-TBNA est une méthode cytologique, l’échantillonnage doit commencer au niveau N3 et progresser vers le niveau N1 en passant par le niveau N2. Une autre procédure pourrait entraîner un upstaging, c’est-à-dire un transfert de cellules malignes des ganglions lymphatiques tumoraux de bas niveau vers des récipients d’échantillons attribués à des ganglions de niveau supérieur.
Un staging endosonographique [8] est indiqué dans tous les cas où le médiastin est radiologiquement anormal, défini par des ganglions médiastinaux >1 cm au scanner et/ou avec une activité métabolique au PET. Lorsque le médiastin est radiologiquement normal, l’indication est posée dans les situations suivantes : siège central de la tumeur primaire, suspicion radiologique de métastases ganglionnaires au niveau du hile (situation N1) et tumeur périphérique >3 cm. Si la technique de l’aiguille endoscopique donne un résultat positif, l’atteinte des ganglions lymphatiques peut être considérée comme confirmée. Si aucune cellule tumorale n’est trouvée, un résultat faussement négatif ne peut pas être exclu. La fréquence de ce phénomène est estimée à 24% dans la littérature [1]. En cas de pertinence pour la décision thérapeutique, cette situation doit être suivie d’un staging chirurgical invasif (fig. 4).
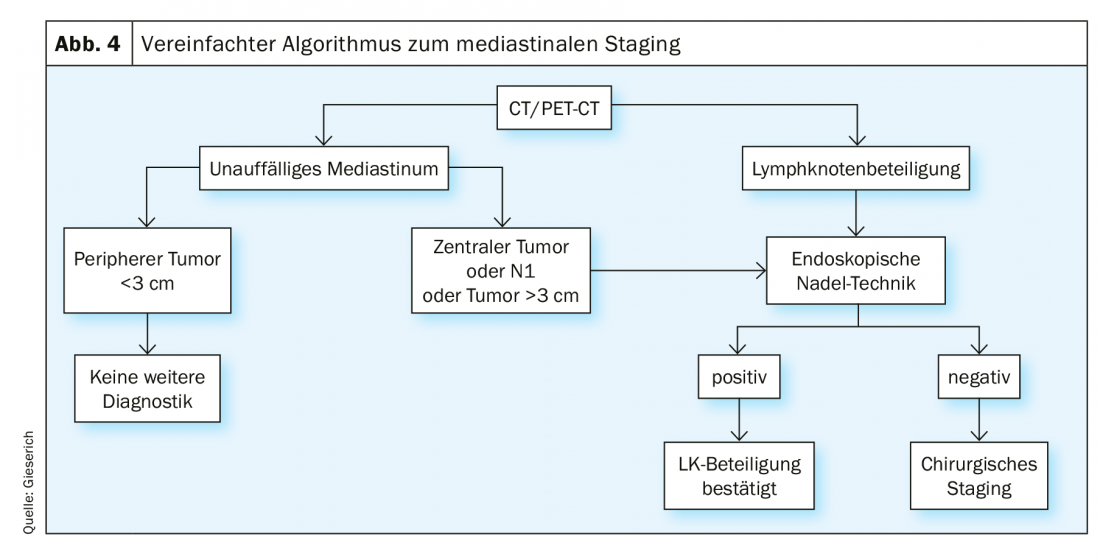
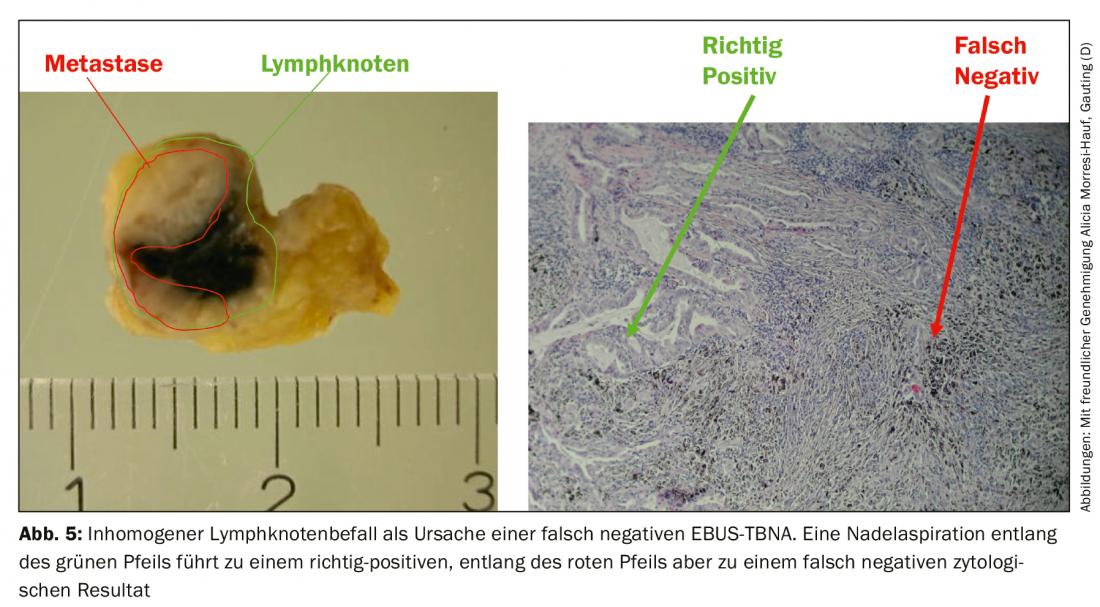
Le taux de faux négatifs résulte d’une atteinte tumorale non homogène des ganglions lymphatiques, l’aiguille ne captant dans le pire des cas que du parenchyme ganglionnaire sain (Fig. 5). En plus de la comparaison avec les résultats radiologiques, l’endosonographie fournit également des critères pour classer davantage les aspirations négatives de l’aiguille. D’une part, les caractéristiques de l’image EBUS conventionnelle qui sont associées à la malignité sont décrites : Alors que les ganglions bénins ont tendance à avoir une forme ovale avec des bords flous et un hile vasculaire typique, les ganglions malins ont tendance à prendre une forme arrondie, le bord devient plus nettement délimité, le vaisseau central du hile peut être absent et la texture de l’écho peut devenir inhomogène en raison de nécroses de coagulation. D’autre part, l’élastographie peut être utilisée comme méthode échographique encore expérimentale. Cette méthode représente la déformabilité (élasticité) du tissu étudié. Dans l’application thoracique, on exploite ainsi la déformation des ganglions lymphatiques par les pulsations régulières du cœur et des gros vaisseaux. La déformabilité est alors reportée sur une échelle de couleurs, comme la vitesse du flux en échographie duplex, et superposée à l’image B de l’échographie. La représentation des couleurs passe d’une élasticité élevée à une élasticité faible, du rouge au jaune et au vert, puis au bleu. La prédiction de la malignité repose ici sur l’hypothèse que le tissu ganglionnaire perd son élasticité en raison de l’infiltration du carcinome. Les ganglions malins apparaissent donc majoritairement bleus (Fig. 6A), les ganglions bénins majoritairement non bleus. L’examinateur doit indiquer ces résultats – s’ils sont disponibles – dans le rapport d’examen et les inclure dans la discussion de la conférence sur la tumeur.

Dans les situations où la tumeur primaire périphérique n’est pas accessible par bronchoscopie, les métastases ganglionnaires médiastinales et hilaires peuvent être les seules manifestations tumorales accessibles. Il est donc important de souligner que tous les examens histopathologiques nécessaires, y compris les analyses moléculaires, peuvent être réalisés sur les prélèvements à l’aiguille obtenus par endosonographie. Cela suppose un traitement des échantillons de haute qualité dans le laboratoire de pathologie, qui comprend, outre les préparations de frottis, la préparation d’un bloc de cellules par centrifugation, l’enrichissement du matériel cytologique et l’inclusion en paraffine.
Métastases
Les métastases à distance s’opposent généralement à un traitement à visée curative. C’est pourquoi, dans les situations radiologiquement peu claires, il est également nécessaire de procéder à un examen histologique. Alors que pour les métastases cérébrales et osseuses, il faut généralement se fier à l’imagerie, d’autres sites métastatiques sont plus accessibles à la collecte d’échantillons.
Si un épanchement pleural survient dans le cadre d’un cancer du poumon, on procède d’abord à un examen cytologique du prélèvement pleural. Comme la sensibilité n’est que d’environ 50%, si la cytologie est négative et qu’il y a une pertinence thérapeutique, l’étape suivante consiste à effectuer une thoracoscopie vidéo-assistée pour exclure avec certitude une carcinose pleurale.
En cas de masse surrénalienne, la sensibilité et la spécificité de l’imagerie ne sont pas suffisantes pour établir un diagnostic définitif, de sorte qu’une confirmation histologique peut être souhaitable, en particulier en cas de métastases isolées. La voie d’accès classique est la ponction transcutanée guidée par scanner. L’accès endosonographique par le tractus gastro-intestinal supérieur permet dans la plupart des cas une ponction transgastrique de la surrénale gauche, mais dans certains cas, la surrénale droite peut également être atteinte par voie transduodénale. Cela se fait généralement entre les mains du gastroentérologue à l’aide d’un gastroscope à ultrasons. L’accès à la glande surrénale gauche à l’aide d’un bronchoscope à ultrasons est faisable, mais encore expérimental (fig. 6B et C), ce qui rend à nouveau l’intervention accessible au pneumologue et peut être réalisée dans la même séance que la bronchoscopie [9]. Il existe en outre dans la littérature des rapports de cas isolés sur la sécurisation de métastases hépatiques et de métastases dans les ganglions lymphatiques épigastriques par la même voie.
Aspects procéduraux
Les exigences décrites pour une bronchoscopie moderne en cas de cancer du poumon laissent entrevoir la complexité de l’intervention. En principe, toutes les méthodes énumérées peuvent être utilisées en technique purement flexible. Cependant, les sondages périphériques délicats et le staging endosonographique complet prennent du temps et nécessitent des conditions d’examen calmes. Une unité de bronchoscopie moderne doit donc disposer de la possibilité de réaliser l’examen sous anesthésie générale. La technique de la bronchoscopie rigide est optimale à cet effet. Si celui-ci n’est pas disponible, le masque laryngé peut être choisi comme voie d’accès pour la ventilation. Cela permet une libre mobilité des instruments bronchoscopiques flexibles – en particulier le bronchoscope de ponction à ultrasons – dans la trachée, de sorte que les stations de ganglions lymphatiques paratrachéaux restent également accessibles.
En outre, les exigences en matière de qualification de l’enquêteur sont élevées. Avec l’expérience, le rendement diagnostique augmente et le taux de complications diminue. Pour l’endosonographie, il existe des simulateurs ainsi que des modèles d’organes en caoutchouc ou d’animaux qui permettent au stagiaire de franchir la première partie de la courbe d’apprentissage. L’étape suivante consiste en une prise en charge progressive de l’examen du patient sous supervision. Étant donné que la courbe d’apprentissage peut varier d’un individu à l’autre et qu’il est arbitraire de fixer un nombre minimum d’examens, la littérature [10] propose des tests standardisés et validés qui permettent d’évaluer les compétences du bronchologue avant de procéder à un examen indépendant.
Messages Take-Home
- La bronchoscopie est la méthode de choix pour la confirmation histologique du carcinome pulmonaire. Elle permet une évaluation complète de la situation thoracique, y compris des manifestations tumorales centrales et périphériques, ainsi que du statut des ganglions lymphatiques médiastinaux.
- La cryosonde prend de plus en plus d’importance, à la fois comme outil de biopsie centrale et transbronchique et comme outil de recanalisation des sténoses exophytiques des voies respiratoires.
- Les aides à la navigation pour le sondage des foyers périphériques connaissent un développement rapide, de la sonde radiale à ultrasons, simple et peu coûteuse à utiliser, aux méthodes plus complexes comme la navigation électromagnétique et la bronchoscopie virtuelle, en passant par des approches expérimentales comme l’accès transparenchymateux et la bronchoscopie assistée par robot.
- Les stations ganglionnaires thoraciques sont divisées en 14 stations selon la carte de l’IASLC de 2009, dont l’anatomie doit être maîtrisée par l’examinateur.
- Dans les lignes directrices sur le staging médiastinal, les techniques d’aiguille guidées par endosonographie sont désormais considérées comme des méthodes de premier choix en raison de leur grande sensibilité et de leur faible taux de complications.
- La portée totale est obtenue par un accès combiné par l’appareil respiratoire (EBUS) et l’œsophage (EUS). Ces deux opérations peuvent être réalisées en une seule fois à l’aide d’un bronchoscope à ultrasons.
Littérature :
- Rivera MP, Mehta AC : American College of Chest P : Diagnostic initial du cancer du poumon : lignes directrices de pratique clinique basées sur les preuves de l’ACCP (2ème édition). Chest 2007 ; 132 : 131S-148S.
- Ishiwata T, Gregor A, Inage T, Yasufuku K : Advances in interventional diagnostic bronchoscopy for peripheral pulmonary lesions. Expert Rev Respir Med 2019 ; 13 : 885-897.
- Wang Memoli JS, Nietert PJ, Silvestri GA : Meta-analysis of guided bronchoscopy for the evaluation of the pulmonary nodule. Chest 2012 ; 142 : 385-393.
- Fielding DIK, Bashirzadeh F, Son JH, et al. : Première utilisation humaine d’un nouveau système de navigation robotique assisté par fibre optique pour les petits nodules pulmonaires périphériques. Respiration 2019 ; 98 : 142-150.
- Silvestri GA, Gonzalez AV, Jantz MA, et al : Methods for staging non-small cell lung cancer : Diagnosis and management of lung cancer, 3rd ed : American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2013 ; 143 : e211S-250S.
- Rusch VW, Asamura H, Watanabe H, et al : The IASLC lung cancer staging project : a proposal for a new international lymph node map in the next seventh edition of the TNM classification for lung cancer. J Thorac Oncol 2009 ; 4 : 568-577.
- Tournoy KG, Annema JT, Krasnik M, et al :. Endoscopic and endobronchial ultrasonography according to the proposed lymph node map definition in the seventh edition of the tumor, node, metastasis classification for lung cancer. J Thorac Oncol 2009 ; 4 : 1576-1584.
- Vilmann P, Clementsen PF, Colella S, et al : Combined endobronchial and esophageal endosonography for the diagnosis and staging of lung cancer : European Society of Gastrointestinal Endoscopy (ESGE) Guideline, in cooperation with the European Respiratory Society (ERS) and the European Society of Thoracic Surgeons (ESTS). Endoscopy 2015 ; 47 : c1.
- Crombag LM, Annema JT : Analyse de la glande surrénale gauche chez les patients atteints de cancer du poumon à l’aide du scope d’échographie endobronchique : un essai de faisabilité. Respiration 2016 ; 91 : 235-240.
- Konge L, Vilmann P, Clementsen P, et al : Reliable and valid assessment of competence in endoscopic ultrasonography and fine-needle aspiration for mediastinal staging of non-small cell lung cancer. Endoscopy 2012 ; 44 : 928-933.
- DOI http://dx.doi.org/10.1055/s-0034-1392040 Publié en ligne : 0.0. Endoscopy 2015 ; 47 : 545-559 © Georg Thieme Verlag KG Stuttgart – New York ISSN 0013-726X
InFo PNEUMOLOGIE & ALLERGOLOGIE 2019 ; 1(3) : 6-11